单端孢霉烯族毒素转化降解研究进展
2010-10-19邹忠义贺稚非李洪军邹程焓韩鹏飞杨佳艺
邹忠义,贺稚非,李洪军*,邹程焓,韩鹏飞,杨佳艺
(西南大学食品科学学院,重庆 400716)
单端孢霉烯族毒素转化降解研究进展
邹忠义,贺稚非,李洪军*,邹程焓,韩鹏飞,杨佳艺
(西南大学食品科学学院,重庆 400716)
单端孢霉烯族毒素广泛存在于粮食、动物饲料及以被污染粮食为原料的食品中,给食品安全带来了一定的隐患。许多学者正在研究用物理、化学以及生物的方法将单端孢霉烯族毒素进行转化降解。本文就这些方法进行概述,重点阐述化学法和生物法的最新研究进展,包括转化作用机理、转化产物及其毒性,旨在为单端孢霉烯族毒素的转化降解研究提供参考。
单端孢霉烯族毒素;转化;降解;机理;产物;毒性
Abstract:Trichothecenes are commonly found in grain and animal feed and human food produced from contaminated grain,which brings a food safety risk. Physical, chemical and biological methods have been posed to evaluate their usefulness in the transformation and degradation of trichothecenes. These methods are reviewed in this paper and their research progress is discussed in detail. Meanwhile, the mechanisms of transformation, transformation products and toxicity are also elucidated,This paper is expected to provide some references for further studying the transformation and degradation of trichothecenes.
Key words:trichothecenes;transformation;degradation;mechanism;product;toxicity
单端孢霉烯族毒素(trichothecenes)是一大族化学性质相关的真菌毒素,由镰刀菌属、漆斑霉属、木霉属、单端孢属、头孢霉属、轮枝孢霉属和黑色葡萄状穗霉属中的一些真菌产生。它们具有相同的基本环结构和一个特征性的C-12,13-环氧基团。根据它们的化学结构,单端孢霉烯族毒素划分为4种类型:A、B、C、D型,其中,A、B型单端孢霉烯族毒素比较常见,它们的结构和简称如图1和表1所示[1]。A型单端孢霉烯族毒素在C8位上不含有羰基官能团,B型单端孢霉烯族毒素在C8位上含有羰基官能团。

图1 A、B型单端孢霉烯族毒素的基本结构Fig.1 Basic structures of type A and B trichothecenes
单端孢霉烯族毒素对真核细胞具有多重抑制作用,通过对蛋白质、DNA和RNA合成的抑制,以及对线粒体功能、细胞分裂和膜功能的抑制,从而对人类和动物的健康产生免疫抑制作用[2]。在食品和饲料中,单端孢霉烯族毒素主要来源于被真菌污染的小麦、大麦和玉米等粮食。由这些原料加工成的早餐麦片、焙烤制品、啤酒及配合饲料等产品中,往往含有单端孢霉烯族毒素[3-4]。如果饲养动物的饲料中含有单端孢霉烯族毒素,它们可能通过奶、肉及蛋进入人类和动物的食物链[5-7]。因此,防止单端孢霉烯族毒素进入人和动物食物链的策略包括:防止单端孢霉烯族毒素污染粮食;对已经存在于食物和饲料中的毒素进行降解处理;抑制胃肠道对毒素的吸收[8]。但目前能有效防止毒素污染粮食及抑制胃肠道吸收毒素的方法不多,对单端孢霉烯族毒素进行转化降解的研究就有了比较重要的意义。
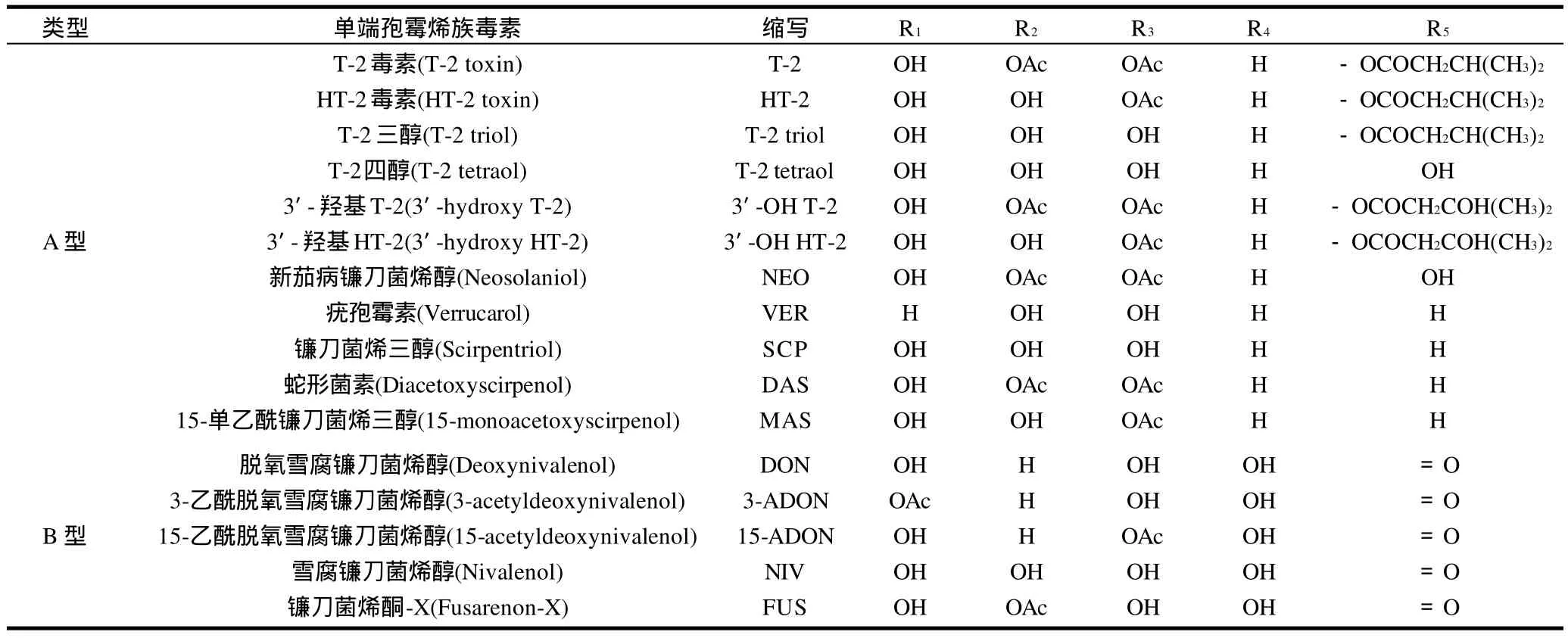
表1 A、B型单端孢霉烯族毒素及其结构Table 1 Type A and B trichothecenes and their respective structures
目前已经有许多学者开展了物理、化学和生物的方法对单端孢霉烯族毒素进行转化降解研究。本文对各种方法的研究报道进行综述,重点阐述化学法和生物法的研究进展,旨在为单端孢霉烯族毒素的转化降解研究提供参考。
1 物理方法
物理方法去除单端孢霉烯族毒素包括清洗、加热、微波、超声波、吸附等,其中一些方法已经取得了一定的进展,但这些物理方法的效果不太理想,不能完全清除受试的真菌毒素或降低其毒性,并且往往会改变营养成分,这使得它们在实际应用中受到了限制[9-13]。
1.1 热处理
脱氧雪腐镰刀菌烯醇(DON)在120℃时很稳定,在210℃部分分解[14]。Bretz 等[15-16]、Abramson 等[17]报道了在高温条件下,DON的浓度会降低,当DON和3-乙酰脱氧雪腐镰刀菌烯醇(3-ADON)被加热时(特别是在碱性条件下),产生了6种化合物的混合物,经细胞毒性实验,转化产物的毒性低于DON。Beyer等[18]研究在烘烤和烹饪过程中T-2毒素的稳定性,发现T-2毒素的转化产物毒性下降了。目前还没有确凿的证据表明高温分解是DON或T-2降解的原因,它的反应机制还需要进一步的研究。
1.2 辐照
大多数的真菌毒素具有复杂的分子结构,一般不受辐照影响。已经有学者研究了伽马射线和电子束对粮食中单端孢霉烯族毒素的降解作用。为了分解DON、3-ADON和T-2毒素,干物料所需要的辐照剂量要高于湿物料的辐照剂量。水分子辐照后产生的自由基会与真菌毒素反应。随着伽马射线辐照剂量的增加,DON和3-ADON在水溶液的浓度降低,水溶液的毒性下降[19-20]。但在电子束辐照实验中,没有发现降解产物[21-22]。辐照可能是工业上脱毒的一个方法,但是应用于干燥的粮食或其他干燥物料脱毒时,效果就很有限。
2 化学方法
2.1 碱处理
单端孢霉烯族毒素与碱反应后,结构会发生变化。例如,Young等[23]研究发现,DON在0.1mol/L的NaOH溶液中,75℃处理1h,产生3种相对分子质量为266的同分异构体混合物,将其命名为norDON A、norDON B和norDON C。Bretz等[15-16]发现,在相同的反应条件下,雪腐镰刀菌烯醇(NIV)产生norNIV A、norNIV B、norNIVC和NIV内酯,3-ADON产生norDON A、norDON B、norDON C和其他4种产物(9-羟甲基DON内酯、norDON D、norDON E和norDON F)。用人类肾脏永生上皮细胞(IHKE)进行细胞毒性实验表明,NIV和DON的半数有效浓度(EC50)分别为0.89、1.1μmol/L,而其转化产物浓度高达100μmol/L时,没有产生任何明显的毒性效应,这表明了NIV和DON的转化产物的毒性要低于NIV和DON。在实际应用碱处理时,应该考虑其可能导致的营养特性的改变,但这方面的报道不多,需要更加深入的研究。
2.2 氧化剂
氧化剂的氧化作用也能使单端孢霉烯族毒素的分子结构发生改变,从而使其生物活性发生改变。化学氧化试剂能与许多功能基团发生反应,例如臭氧最有可能攻击单端孢霉烯族毒素中的双键[24]。Young等[25]提出,臭氧对单端孢霉烯族毒素氧化作用,是在C-9,10双键上加上两个原子氧,分子的其他部分没有发生改变。DON氧化作用转化过程中,水分子起到了很重要的作用。例如:当湿润的臭氧(2.88%)以150mL/min的低速,通过霉变玉米(DON含量为1000μg/g)1h,能减少90%的DON,而当臭氧和霉变玉米都处于干燥状态时,DON的减少量却很小[11]。此外,在臭氧饱和水蒸气体系中,pH值的大小对单端孢霉烯族毒素的氧化作用也很重要,在pH4~6时,DON、3-ADON、15-ADON、DAS、MAS、FUS、NEO和VER完全降解;在pH7~8时,受试的单端孢霉烯族毒素与臭氧之间反应的程度取决于C8位的氧化状态;在pH9时,几乎没有反应发生。
Burrows等[26-27]报道,在室温条件下,次氯酸钠(NaClO)将疣孢霉素(Verrucarol,VER)转化成两种产物,将DON转化成一种产物。VER的氧化包括在C-9,10双键中C9上的亲核进攻,C-12,13环氧基团的开环,C10、C13单键的形成,C4的氧化、氯化及环化形成半酮缩醇。而NaClO对DON的氧化作用不会使C-12,13环氧基团开环,而是形成C-9,10环氧化合物和C8、C15半酮缩醇。这表示在C8位上的羰基可能有催化NaClO对DON的氧化作用,DON的转化速率是VER的10倍证明了这一点。用0.25% NaClO-0.025mol/L的NaOH溶液处理T-2毒素4h,能抑制T-2毒素的生物活性,NaClO被推荐作为T-2毒素和其他单端孢霉烯族毒素的净化剂[28-29]。
2.3 还原剂
食品添加剂中的还原剂,例如抗坏血酸、亚硫酸氢钠(NaHSO3)和焦亚硫酸钠(Na2S2O5),具有转化粮食中DON的能力。用2%抗坏血酸,22℃处理小麦24h,能将DON浓度降低50%。用NaHSO3处理小麦粉后,DON的残留量只有5%。在100℃,输入水分含量为22%的饱和蒸汽,并不断搅拌,1%的Na2S2O5能使霉变小麦中DON的含量从7.6mg/kg 降到0.28mg/kg[11]。
3 生物方法
3.1 羟基化和羰基化氧化作用
灌木酒神菊属(Baccharisspp.)微生物和猪能将T-2毒素通过羟基化作用氧化成3'-OH T-2或者3'-OH HT-2[31-32]。Kobayashi等[33]指出,细胞色素P-450依赖的单加氧酶系能催化双羟基化反应。Yoshizawa等[34]指出,羟基化氧化作用发生在肝微粒体中,需要NADPH的参与。苯巴比妥能诱导大多数细胞色素P-450同工酶系,起到催化作用,从而加强这一反应,苯巴比妥能在肝中通过羟基化和糖酯化作用代谢掉。
土壤微生物能使DON中C3位上的羟基通过羰基化作用氧化成3-酮-DON[35]。Shima等[36]报道,一株土壤杆菌属-根瘤菌属(Agrobacterium-Rhizobiumsp.)的菌株E3-39,能将DON转化成3种产物,其中主要产物是3-酮-DON,它的免疫抑制力是DON的1/10。在细胞培养液和滤液中发现了该菌株产生的DON转化酶(系),但在细胞提取液中没有发现该酶(系),这表明可以用分析生物化学技术从细胞培养液中分离纯化DON转化酶(系)。等[37]推测,乙醇脱氢酶能协同辅酶NADH或NADPH,将DON转化成3-酮-DON,但没有去证明这一机制。
Yoshizawa等[38]报道,3'-OH T-2毒素的急性毒性(LD50=4.63 mg/kg)略高于T-2毒素的急性毒性(LD50=5.31mg/kg),而3'-OH HT-2毒素的急性毒性(LD50=22.8 mg/kg)远低于HT-2毒素的急性毒性(LD50=6.50mg/kg)。然而,Islam等[39]通过罗伊贝尔肝癌细胞株(H4-II-E)测试T-2毒素、HT-2毒素及它们羟基化产物的细胞毒性时,发现毒性大小顺序为:T-2>HT-2>3'-OH T-2>3'-OH HT-2,他们报道的结果有所不同,目前还没有见到其他有关氧化产物毒性的报道。
3.2 脱环氧作用
Zhou等[40]发现微生物能将单端孢霉烯族毒素代谢成脱环氧产物,例如将DON代谢成脱环氧DON (DOM-1)。Swanson等[41]、Young等[42]没有发现T-2毒素、NEO、DAS和FUS的直接脱环氧产物,这可能是因为这4种单端孢霉烯族毒素C4位上存在着乙酰基,从而不利于反应的发生。
Eriksen等[43]通过DNA合成中5-溴-2'-脱氧尿苷(尿嘧啶)合成实验分析,DOM-1的毒性是DON的1/54,脱环氧NIV的毒性是NIV的1/55。Swanson等[44]用脱环氧T-2毒素(人工合成)刺激大鼠皮肤,发现它的毒性是T-2毒素的1/400。目前,还没有见到其他有关单端孢霉烯族毒素脱环氧产物毒性的报道。
目前真细菌菌株BBSH 797是唯一商品化运用于动物饲料脱毒的微生物,这种胶囊化的微生物产品被用于家禽和猪的饲料,其中就有BIOMIN股份有限公司的品牌产品(Mycofix),动物实验结果显示,这个品牌的产品能显著降低DON对母猪和奶牛,以及T-2毒素对肉鸡的不良反应。Hochsteiner等[45]认为该产品对奶牛的积极作用可能是因为该产品增强了瘤胃微生物的活性。He等[46-47]先用来自于鸡大肠的微生物发酵含有DON的发霉玉米,然后再喂食幼猪进行性能测试,与喂食未经处理发霉玉米的幼猪对比,发现幼猪每日进食量、体质量增加量、饲料利用率分别高出19%、54%、37%,但是这些指标仍低于喂食不含DON饲料的幼猪,没对微生物进行分离鉴定。Li等[48]用含有DON的玉米(其中DON含量等同于5μg/g)喂食幼猪,猪表现出了明显的不良反应,猪每日进食量、体质量增加量、饲料利用率均出现了明显的下降,而用发酵了的发霉玉米喂食幼猪,猪的反应与喂食不含毒素玉米时相同。
最近,Guan等[49]、Islam等[50]报道,来源于鲶鱼和土壤的微生物能将DON脱环氧化形成DOM-1。
3.3 水解脱乙酰基作用
除了C-12,13环氧基团和C-9,10双键之外,大多数的单端孢霉烯族毒素都含有乙酰基,它的数量和位置也影响单端孢霉烯族毒素的毒性。脱乙酰基作用能使单端孢霉烯族毒素的毒性发生改变,例如T-2毒素脱乙酰产物HT-2毒素毒性降低[51]。
T-2毒素能被土壤细菌短小杆菌属菌株114-2水解成HT-2毒素,再脱去两分子乙酰基,形成T-2三醇[52],瘤胃细菌菌株BBSH 797能进一步脱乙酰基形成脱环氧T-2 四醇[53]。
不同来源的微生物和动物器官(如肝脏)能进行脱乙酰化作用,这表明在不同的生物体系中,广泛分布着负责该反应的酶类。几种常用的酯酶抑制剂被用来测试猪肝对T-2毒素的脱乙酰基作用。相对于一般性的非特异性酯酶,乙酰胆碱型酶类更加可能是T-2毒素脱乙酰基作用的原因[54]。肝微粒体中的羧酸酯酶同工酶或白细胞中的羧酸酯酶能将T-2毒素转化成HT-2毒素,红细胞中一种羧酸酯酶能将T-2转化成NEO[55-56]。目前关于这种生化途径,以及单端孢霉烯族毒素水解酶类还不是很清楚,因此,单端孢霉烯族毒素水解作用的机制还需要进行更深入的研究。
3.4 水合作用
He等[57]用以DON作为唯一碳源的无机盐培养基,从土壤中分离得到一株曲霉属菌株NJA,经过两个星期的孵化,改菌株能将94.4%的DON转化成一种相对分子质量比DON大18.1的化学物质,但其没有描述其分子结构和转化产物的毒性,这可能是水分子的OH-和H+加到碳碳双键两个碳原子上的水合作用产物。
3.5 苷化共轭作用
单端孢霉烯族毒素的苷化共轭物可能是葡萄糖醛酸苷和葡萄糖苷。单端孢霉烯葡萄糖醛酸苷很可能是单端孢霉烯族毒素C3位上的羟基通过糖苷键连接葡萄糖醛酸的一类化合物。大鼠肝微粒体葡萄糖醛酸基转移酶(或葡萄糖苷酸酶)能将单端孢霉烯族毒素葡萄糖苷酸化[58]。而单端孢霉烯葡萄糖苷是单端孢霉烯族毒素通过糖苷键连接葡萄糖异头碳的一类化合物。从DON处理过的玉米悬浮微生物培养物中分离得到了DON-3-葡萄糖苷[59],在小麦[60]和啤酒[3]中也发现了该物质。拟南芥中的UDP-葡萄糖基转移酶,催化UDP-葡萄糖中的葡萄糖转移到DON和15-DON的C3位羟基上[61]。
4 结 语
虽然已经有许多关于单端孢霉烯族毒素转化降解的研究报道,但得到实际应用的却不多。这可能主要是因为还不够了解转化作用的机理,转化产物的结构、稳定性和毒性,以及转化作用对食物和饲料营养价值的影响等副作用,这些方面还需要深入的研究。
物理方法的效果不太理想,不能完全清除受试的真菌毒素或降低其毒性,并且往往会改变营养成分。虽然许多化学处理能显著降低单端孢霉烯族毒素的浓度,但化学转化作用可能会降低食物和饲料中的营养价值,也有可能残留有毒物质,这些副作用限制了它们的应用[62]。生物方法通过脱环氧化、羰基化、羟基化、水解及葡萄糖苷酸化等反应,在温和的条件下,将单端孢霉烯族毒素转化成低毒或无毒产物。在这些反应中,酶起到了关键的作用。研究转化降解单端孢霉烯族毒素的酶类,将它们分离纯化,了解它们的特性。应用高级分子生物学和基因工程技术,来确认产生脱毒酶类的基因[63-65]。得到这些基因后,一方面可以在农作物中克隆和表达,开发具有降解单端孢霉烯族毒素的品种,另一方面可以在微生物中克隆和表达,构建微生物重组体,工业化大规模生产具有转化降解单端孢霉烯族毒素作用的酶类。因此,在食品和饲料工业中,转化降解单端孢霉烯族毒素的酶类具有广阔的应用前景。
[1] HE Jianwei, ZHOU Ting, YOUNG J C, et al. Chemical and biological transformations for detoxification of trichothecene mycotoxins in human and animal food chains:a review[J]. Trends in Food Science &Technology, 2010, 21(2):67-76.
[2] ROCHA O, ANSARI K, DOOHAN F M. Effects of trichothecene mycotoxins on eukaryotic cells:a review[J]. Food Additives and Contaminants,2005, 22:369-378.
[3] LANCOVA K, HAJSLOVA J, POUSTKA J, et al. Transfer of Fusarium mycotoxins anddeoxynivalenol (deoxynivalenol-3-glucoside)from field barley through malt to beer[J]. Food Additives and Contaminants,2008, 25:732-744.
[4] PITTET A. Natural occurrence of mycotoxins in foods and feeds:a decade in review[C]//de KOE W J, SAMSON R A, van EGMOND H P.Mycotoxins and phycotoxins in perspective at the turn of the millennium.Proceedings of the 10th International IUPAC Symposium on Mycotoxins and Phycotoxins. Wageningen, Netherlands, 2001:153-172.
[5] GOYARTS T, DNICKE S, VALENTA H, et al. Carry-over ofFusariumtoxins (deoxynivalenol and zearalenone) from naturally contaminated wheat to pigs[J]. Food Additives and Contaminants, 2007, 24(4):369-380.
[6] SEELING K, DNICKE S, VALENTA H, et al. Effects ofFusariumtoxin-contaminated wheat and feed intake level on the biotransformation and carry-over of deoxynivalenol in dairy cows[J]. Food Additives and Contaminants, 2006, 22:1008-1020.
[7] VALENTA H, DNICKE S. Study on the transmission of deoxynivalenol and deepoxy-deoxynivalenol into eggs of laying hens using a highperformance liquid chromatography-ultraviolet method with clean-up by immunoaffinity columns[J]. Molecular Nutrition and Food Research,2005, 49:779-785.
[8] KABAK B, DOBSON A D W, VAR I. Strategies to prevent mycotoxin contamination of food and animal feed:a review[J]. Critical Reviews in Food Science and Nutrition, 2006, 46:593-619.
[9] PRONYK C, CENKOWSKI S, ABRAMSON D. Superheated steam reduction of deoxynivalenol in naturally contaminated wheat kernels[J].Food Control, 2006, 17:789-796.
[10] SHETTY P H, JESPERSEN L.Saccharomyces cerevisiaeand lactic acid bacteria as potential mycotoxin decontaminating agents[J]. Trends in Food Science & Technology, 2006, 17:48-55.
[11] YOUNG J C. Reduction in levels of deoxynivalenol in contaminated corn by chemical and physical treatment[J]. Journal of Agricultural and Food Chemistry, 1986, 34:465-467.
[12] YOUNG J C, SUBRYAN L M, POTTS D, et al. Reduction in levels of deoxynivalenol in contaminated wheat by chemical and physical treatment[J]. Journal of Agricultural and Food Chemistry, 1986, 34:461-465.
[13] KARLOVSKY P. Biological detoxification of fungal toxins and its use in plant breeding, feed, and food production[J]. Natural Toxins, 1999, 7(1):1-23.
[14] WHO. Food additives series 47:Safety evaluation of certain mycotoxins in food[S]. Geneva:WHO, 2001:419-528.
[15] BRETZ M, BEYER M, CRAMER B, et al. Thermal degradation of theFusariummycotoxin deoxynivalenol[J]. Journal of Agricultural and Food Chemistry, 2006, 54:6445-6451.
[16] BRETZ M, KNECHT A, GCKLER S, et al. Structural elucidation and analysis of thermal degradation products of theFusariummycotoxin nivalenol[J]. Molecular Nutrition & Food Research, 2005, 49:309-316.
[17] ABRAMSON D, HOUSE J D, NYACHOTI C M. Reduction of deoxynivalenol in barley by treatment with aqueous sodium carbonate and heat[J]. Mycopathologia, 2005, 160:297-301.
[18] BEYER M, FERSE I, MULAC D, et al. Structural elucidation of T-2 toxin thermal degradation products and investigations toward their occurrence in retail food[J]. Journal of Agricultural and Food Chemistry,2009, 57:1867-1875.
[19] HOOSHMAND H, KLOPFENSTEIN C F. Effects of gamma irradiation on mycotoxin disappearance and amino acid contents of corn, wheat, and soybeans with different moisture contents[J]. Plant Foods for Human Nutrition, 1995, 47:227-238.
[20] O'NEILL K, DAMOGLOU A P, PATTERSON M F. The stability of deoxynivalenol and 3-acetyl deoxynivalenol to gamma irradiation[J].Food Additives and Contaminants, 1993, 10(2):209-215.
[21] STEPANIK T, KOST D, NOWICKI T, et al. Effects of electron beam irradiation on deoxynivalenol levels in distillers dried grain and solubles and in production intermediates[J]. Food Additives & Contaminants:Part A, 2007, 24(9):1001-1006.
[22] KOTTAPALLI B, WOLF-HALL C E, SCHWARZ P. Effect of electronbeam radiation on the safety and quality ofFusariuminfected malting barley[J]. International Journal of Food Microbiology, 2006,110:224-231.
[23] YOUNG J C, BLACKWELL B A, APSIMON J W. Alkaline degradation of the mycotoxin 4-deoxynivalenol[J]. Tetrahedron Letters, 1986,27:1019-1022.
[24] MCKENZIE K S, SARR A B, MAYURA K, et al. Oxidative degradation and detoxification of mycotoxins using a novel source of ozone[J].Food and Chemical Toxicology, 1997, 35:807-820.
[25] YOUNG J C, ZHU Honghui, ZHOU Ting. Degradation of trichothecene mycotoxins by aqueous ozone[J]. Food and Chemical Toxicology, 2006,44(3):417-424.
[26] BURROWS E P, SZAFRANIEC L L. Hypochlorite-promoted transformations of trichothecenes, Verrucarol[J]. Journal of Organic Chemistry,1986, 51:1494-1497.
[27] BURROWS E P, SZAFRANIEC L L. Hypochlorite-promoted transformations of trichothecenes, 3. Deoxynivalenol[J]. Journal of Natural Products, 1987, 50(6):1108-1112.
[28] THOMPSON W L, WANNEMACHER R W. Detection and quantitation of T-2 mycotoxin with a simplified protein synthesis inhibition assay[J].Applied and Environmental Microbiology, 1984, 48:1176-1180.
[29] FAIFER G C, VELAZCO V, GODOY H M. Adjustment of the conditions required for complete decontamination of T-2 toxin residues with alkaline sodium hypochlorite[J]. Bulletin of Environmental Contamination and Toxicology, 1994, 52:102-108.
[31] MIROCHA C J, ABBAS H K, TREEFUL L, et al. T-2 toxin and diacetoxyscirpenol metabolism byBaccharisspp.[J]. Applied and Environmental Microbiology, 1988, 54(9):2277-2280.
[32] CORLEY R A, SWANSON S P, GULLO G J, et al. Disposition of T-2 toxin, a trichothecene mycotoxin, in intravascularly dosed swine[J].Journal of Agricultural and Food Chemistry, 1986, 34:868-875.
[33] KOBAYASHI J, HORIKOSHI T, RYU J C. The cytochrome P-450-dependent hydroxylation of T-2 toxin in various animal species[J]. Food and Chemical Toxicology, 1987, 25:539-544.
[34] YOSHIZAWA T, SAKAMOTO T, OKAMOTO K.in vitroFormation of 3'-hydroxy T-2 and 3'-hydroxy HT-2 toxins from T-2 toxin by liver homogenates from mice and monkeys[J]. Applied and Environmental Microbiology, 1984, 47:130-134.
[35] HE J. Microbial strategies for management ofFusarium graminearumand transformation of deoxynivalenol[D]. Guelph:University of Guelph,2008:153.
[36] SHIMA J, TAKASE S, TAKAHASHI Y, et al. Novel detoxification of the trichothecene mycotoxin deoxynivalenol by a soil bacterium isolated by enrichment culture[J]. Applied and Environmental Microbiology,1997, 63:3825-3830.
[38] YOSHIZAWA T, SAKAMOTO T, AYANO Y, et al. 3'-Hydroxy T-2,3'-hydroxy HT-2 toxins:new metabolites of T-2 toxin, a trichothecene mycotoxin, in animals[J]. Agricultural and Biological Chemistry, 1982,46:2613-2615.
[39] ISLAM Z, NAGASE M, OTA A, et al. Structure-function relationship of T-2 Toxin and its metabolites in inducing thymic apoptosisin vivoin mice[J]. Bioscience, Biotechnology and Biochemistry, 1998, 62:1492-1497.
[40] ZHOU T, HE J, GONG J. Microbial transformation of trichothecene mycotoxins[J]. World Mycotoxin Journal, 2008, 1(1):23-30.
[41] SWANSON S P, ROOD J H D, BEHRENS J C, et al. Preparation andcharacterization of the deepoxy trichothecenes:deepoxy HT-2, deepoxy T-2 triol, deepoxy T-2 tetraol, deepoxy 15-monoacetoxyscirpenol, and deepoxy scirpentriol[J]. Applied and Environmental Microbiology, 1987,53:2821-2826.
[42] YOUNG J C, ZHOU Ting, YU Hai, et al. Degradation of trichothecene mycotoxins by chicken intestinal microbes[J]. Food and Chemical Toxicology, 2007, 45(1):136-143.
[43] ERIKSEN G S, PETTERSSON H, LINDBERG J E. Absorption, metabolism and excretion of 3-acetyl don in pigs[J]. Archives of Animal Nutrition, 2003, 57:335-345.
[44] SWANSON S P, HELASZEK C, BUCK W B, et al. The role of intestinal microflora in the metabolism of trichothecene mycotoxins[J].Food and Chemical Toxicology, 1988, 28:823-829.
[45] HOCHSTEINER W, SCHUH M, LUGER K, et al. Influence of mycotoxins contaminated feed blood parameters and milk production[J].Berliner und Munchener Tierrztliche Wochenschrift, 2000, 113:14-21.
[46] HE Ping, YOUNG L G, FORSBERG C. Microbially detoxified vomitoxin-contaminated corn for young pigs[J]. Journal of Animal Science,1993, 71:963-967.
[47] HE Ping YOUNG L G, FORSBERG C. Microbial transformation of deoxynivalenol (vomitoxin)[J]. Applied and Environmental Microbiology,1992, 58:3857-3863.
[48] LI Xinzhen, ZHU J, LANGE DE C F M, et al. Microbial detoxification of deoxynivalenol (DON) demonstrated in a swine feeding trial[C]//The 2008 Canadian Institute of Food Science & Technology Conference.Charlottetown, Canada, 2008-05-25.
[49] GUAN Shu, HE Jianwei, YOUNG J C, et al. Transformation of trichothecene mycotoxins by microorganisms from fish digesta[J].Aquaculture, 2009, 290(3/4):290-295.
[50] ISLAM M R, HE Jianwei, PAULS P P, et al. Isolation and characterization of soil bacteria capable of detoxifying the mycotoxin deoxynivalenol(DON)[C]//The American Phytopathological Society 2008 Meeting. 2008-07-26, Minneapolis, USA.
[51] BETINA V. Structure-activity relationships among mycotoxins[J].Chemico Biological Interactions, 1989, 71:105-146.
[52] UENO Y, NAKAYAMA K, ISHII K, et al. Metabolism of T-2 toxin inCurtobacteriumsp. strain 114-2[J]. Applied and Environmental Microbiology, 1983, 46(1):120-127.
[53] FUCHS E, BINDER E M, HEIDLER D, et al. Structural characterization of metabolites after the microbial degradation of type A trichothecenes by the bacterial strain BBSH 797[J]. Food Additives and Contaminants,2002, 19:379-386.
[54] WEI R D, CHU F S. Modification ofin vitrometabolism of T-2 toxin by esterase inhibitors[J]. Applied and Environmental Microbiology,1985, 50:115-119.
[55] JOHNSEN H, ODDEN E, JOHNSEN B A, et al. Metabolism of T-2 toxin by blood cell carboxylesterases[J]. Biochemical Pharmacology,1988, 37:3193-3197.
[56] JOHNSEN H, ODDEN E, LIE O. Metabolism of T-2 toxin by rat liver carboxylesterase[J]. Biochemical Pharmacology, 1986, 35:1469-1473.
[57] HE Chenghua, FAN Yanhong, LIU Guofang, et al. Isolation and identification of a strain ofAspergillus tubingensiswith deoxynivalenol biotransformation capability[J]. International Journal of Molecular Sciences,2008, 9:2366-2375.
[58] WU Xianai, MURPHY P, CUNNICK J, et al. Synthesis and characterization of deoxynivalenol glucuronide:its comparative immunotoxicity with deoxynivalenol[J]. Food and Chemical Toxicology, 2007, 45:1846-1855.
[59] SEWALD N, von GLEISSENTHALL J L, SCHUSTER M, et al.Structure elucidation of a plant metabolite of 4-desoxynivalenol[J]. Tetrahedron Asymmetry, 1992, 3(7):953-960.
[60] BERTHILLER F,ASTA C, SCHUHMACHER R, et al. Masked mycotoxins:determination of a deoxynivalenol glucoside in artificially and naturally contaminated wheat by liquid chromatography-tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2005,53:3421-3425.
[61] POPPENBERGER B, BERTHILLER F, LUCYSHYN D, et al. Detoxification of theFusariummycotoxin deoxynivalenol by a UDP-glucosyltransferase fromArabidopsis thaliana[J]. Journal of Biological Chemistry, 2003, 278:47905-47914.
[62] KABAK B, DOBSON A D W, VAR I. Strategies to prevent mycotoxin contamination of food and animal feed:a review[J]. Critical Reviews in Food Science and Nutrition, 2006, 46:593-619.
[63] ALTALHI A D. Plasmid-mediated mycotoxin zearalenone inPseudomonas putidaZEA-1[J]. American Journal of Biochemistry and Biotechnology, 2007, 3(1):150-158.
[64] ALTALHI A D, EL-DEEB B. Localization of zearalenone detoxification gene(s) in pZEA-1 plasmid ofPseudomonas putidaZEA-1 and expressed inEscherichia coli[J]. Journal of Hazardous Materials, 2009,161:1166-1172.
[65] TAKAHASHI-ANDO N, OHSATO S, SHIBATA T, et al. Metabolism of zearalenone by genetically modified organisms expressing the detoxification gene fromClonostachys rosea[J]. Applied and Environmental Microbiology, 2004, 70(6):3239-3245.
Research Progress in Transformation and Degradation of Trichothecenes
ZOU Zhong-yi,HE Zhi-fei,LI Hong-jun*,ZOU Cheng-han,HAN Peng-fei,YANG Jia-yi
(College of Food Science, Southwest University, Chongqing 400716, China)
TS201.6
A
1002-6630(2010)19-0443-06
2010-01-08
国家“973”计划项目(2009CB118806)
邹忠义(1982—),男,博士研究生,研究方向为现代食品加工理论与技术。E-mail:zzy911zzy911@163.com
*通信作者:李洪军(1961—),男,教授,博士,研究方向为肉类科学与酶工程。E-mail:hongjunli1961@yahoo.com.cn
