冰结构蛋白对湿面筋蛋白冻藏稳定性的影响
2010-10-19李玲玲贾春利黄卫宁金亮秀RAYASDUARTEPatricia
李玲玲,贾春利,黄卫宁,*,金亮秀,RAYAS-DUARTE Patricia
(1.江南大学食品学院,食品科学与技术国家重点实验室,江苏 无锡 214122;2.美国俄克拉荷马州立大学农产品与食品研究中心,美国 俄克拉荷马州 斯蒂尔沃特 74078-6055)
冰结构蛋白对湿面筋蛋白冻藏稳定性的影响
李玲玲1,贾春利1,黄卫宁1,*,金亮秀1,RAYAS-DUARTE Patricia2
(1.江南大学食品学院,食品科学与技术国家重点实验室,江苏 无锡 214122;2.美国俄克拉荷马州立大学农产品与食品研究中心,美国 俄克拉荷马州 斯蒂尔沃特 74078-6055)
研究冬小麦冰结构蛋白(ISP)对湿面筋蛋白冻藏稳定性的影响。采用差示扫描量热仪、动态流变仪、扫描电子显微镜分别研究空白湿面筋蛋白(未添加ISP)和添加ISP的湿面筋蛋白冻藏不同时间后可冻结水含量、流变学特性及超微结构的变化。结果表明:1)随着冻藏时间延长,湿面筋蛋白可冻结水含量逐渐增大;冻藏时间相同时,添加ISP湿面筋蛋白的融化焓小于空白湿面筋蛋白。2)湿面筋蛋白的弹性模量、黏性模量和蠕变均随冻藏时间的延长而降低;冻藏时间相同时,含ISP湿面筋蛋白的蠕变明显小于空白湿面筋蛋白的相应参数。3)湿面筋蛋白网络经过冻藏后,不规则的孔洞更大,引入ISP后,冰晶形成的不规则孔洞相对于空白湿面筋蛋白更加细小和均匀。说明ISP能够通过减少湿面筋蛋白体系中的可冻结水含量,抑制冰晶形成和重结晶,从而减小冻藏过程中湿面筋蛋白网络遭受的破坏。
冰结构蛋白;湿面筋蛋白;可冻结水;动态流变学特性;微观结构
Abstract:To understand the effect of ice-structuring protein (ISP) from winter wheat on the stability of frozen hydrated gluten,the freezable water content, rheological properties and microstructure of hydrated gluten with and without added ISP frozen for 1, 2, 4, 7 weeks and 9 weeks were determined by differential scanning calorimetry (DSC), rheometer and scanning electron microscopy (SEM), respectively. The results showed that:1) the amount of freezable water in hydrated gluten increased with increasing frozen time, while the addition of ISP could prevent the increase in freezable water content that; 2) both theG' andG' of hydrated gluten decreased with increasing frozen storage time, while hydrated gluten containing ISP always had higherG'andG' than its blank counterpart at the same frozen storage time points; and 3) less damage of gluten network caused by ice growth and recrystallization was observed for hydrated gluten containing ISP compared with control one at the same frozen storage time points. These results indicate that ISP can prevent hydrated gluten network from ice crystal damage.
Key words:ice-structuring protein;hydrated gluten;freezable water;dynamic rheological properties;microstructure中图分类号:Q816 文献标识码:A 文章编号:1002-6630(2010)19-0025-04
小麦面筋蛋白是一种黄白色有弹性和延伸性的物质,主要由麦醇溶蛋白和麦谷蛋白组成,面筋蛋白吸水后,蛋白分子逐渐水化,分子间相互作用形成三维网状结构[1-5],赋予面团持水性、面团黏结性与黏弹性等流变学性质[6-7]。冷冻是已被广泛应用的一种食品保存方法,但在冷冻贮藏过程中,因温度波动而引起的重结晶现象可引起湿面筋网络结构物化性质的改变,尤其可冻结水形成冰晶后体积增加,表现出异常的膨胀特性,使得蛋白质的三维网络结构受到挤压而破坏。关于湿面筋蛋白冻融稳定性方面的研究是冷冻面团及其制品体系基础研究的重要部分,具有实践指导意义[8]。
2006年,我国卫生部公布冰结构蛋白(ice-structur-ing protein,ISP)即抗冻蛋白是可用于冷冻食品中的新型食品添加剂[9],可以被多种生物如鱼类,植物及昆虫所合成,以保证它们在低温下可以生存[10]。ISP有3种主要功能:热滞活性、修饰冰晶及抑制重结晶[11-12]。周美玲[13]及潘振兴[14]在国内率先对ISP在冷冻面团体系中的应用研究进行了报道。关于ISP在冷冻面团及其食品体系中的研究正在成为烘焙与发酵技术领域的热点课题之一。
本实验采用差示扫描量热仪研究冻藏时间对湿面筋蛋白中可冻结水含量的影响;用动态流变仪研究冷冻湿面筋蛋白的黏弹性模量随冻藏时间的变化;采用扫描电子显微镜观察不同冻藏时间下冷冻湿面筋蛋白网络结构的变化,进而分析湿面筋蛋白中冰-水相平衡的变化及冰结构蛋白影响湿面筋蛋白冻藏稳定性的作用机制,为冷冻面制品的研究提供参考。
1 材料与方法
1.1 材料
冰结构蛋白(ISP) 加拿大弗兰伯勒生物冰技术有限公司;面筋蛋白 山东瑞祥淀粉有限公司。
1.2 仪器与设备
Pyris 1差示量热扫描仪 英国Perkin-Elmer公司;SX-40扫描电子显微镜 日本明石公司;冷冻干燥机美国Abconco公司;AR1000动态流变仪 英国TA公司。
1.3 方法
1.3.1 样品制备
称取一定量的小麦面筋蛋白粉与蒸馏水,按质量比1:1的比例混合均匀,将制得的湿面筋蛋白用保鲜膜包裹,放在常温下稳定1h,然后切成圆片,用保鲜膜包裹放在-18℃冰箱中。
1.3.2 可冻结水含量测定
用铟和锡校准差示扫描量热仪。用剃刀从冷冻湿面筋蛋白圆片中心部位取10~15mg,密封在小铝盒中,放入DSC,空气作参比。在-15℃和5℃各保持5min,从-15℃升温到5℃,升温速度为1℃/min。记录可冻结水的焓变(ΔH)。
1.3.3 动态流变学实验
测定条件:直径20mm、偏角1°椎板,温度25℃,频率范围0.01~100rad/s,应变量10%,测定贮能模量G′及损耗模量G′随频率(0.01~100rad/s)的变化。
1.3.4 冷冻湿面筋蛋白微观结构观察
取冷冻湿面筋蛋白样品在30℃解冻2h后进行冷冻干燥。样品先用2.5%戊二醛固定,0.1mol/L磷酸缓冲液漂洗,再用1%四氧化二锇固定,0.1mol/L磷酸缓冲液冲洗,用30%、50%、70%、90%、100%乙醇梯度洗脱。用醋酸异戊酯置换出乙醇后,采用临界点干燥法进行干燥,经离子溅射喷金后,置于扫描电子显微镜下观察样品结构。加速电压为5kV。
2 结果与分析
2.1 可冻结水含量研究
面筋蛋白质中水分子主要以结合水、可冻结结合水和自由水3种状态存在[15]。所谓的可冻结水主要由自由水和可冻结结合水组成;所谓的非冻结水主要由结合水和另一部分松散的结合水组成。冻藏过程中,冰晶是破坏面筋蛋白质网络结构的主要因素之一,而可冻结水含量决定了面团在冻藏过程中冰晶的形成量,可冻结水越少,面筋的网络结构保持的越完整。可冻结水(冰)的含量可以通过计算DSC曲线峰值下的面积所测得的熔化焓值ΔH来反映[16-17]。图1即为本实验测定的典型冷冻湿面筋蛋白的DSC曲线。
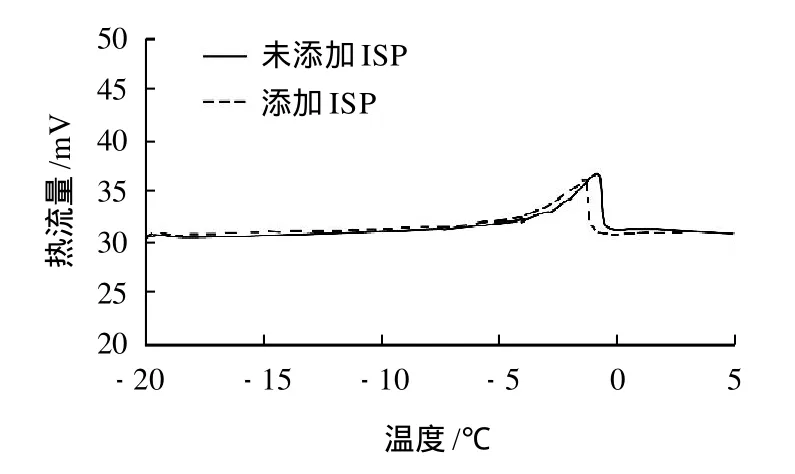
图1 典型冷冻湿面筋蛋白的DSC曲线Fig.1 Typical DSC spectra of frozen gluten with and without added ISP
由图1可以看出,冷冻面团的冰晶融化温度范围大致介于-7~2℃之间,这与宋国胜[18]得到的结果基本一致。

图2 湿面筋蛋白中的冰的融化焓Fig.2 Change in ice melting enthalpy in hydrated gluten with and without added ISP during frozen storage
用DSC测定冷冻湿面筋蛋白中可冻结水(冰)的含量。湿面筋蛋白中冰的融化焓随冻藏时间的变化如图2所示。随冻藏时间的延长,湿面筋蛋白样品融化焓值均呈增大趋势,即表明冷冻湿面筋蛋白中可冻结水量增加。空白样品在冻藏时间为1周时,冰的融化焓为88.5J/g,比Kontogiorgos等[19]得出的值要小些,这可能是因为面筋蛋白的来源以及面筋和水的比例不一致造成的。冻藏2周后,融化焓值为96J/g,增加了8.4%,而当冻藏时间达到9周时,融化焓达到112.5J/g,与第1周相比,焓值增加了27.1%。开始时水分的迁移和可冻结水的增加,可能是因为在较低温度下湿面筋蛋白的网络结构遭到破坏;当冻藏时间为9周时,可冻结水焓值又有所增加,这可能是因为在长时间冻藏过程中,冰晶的重结晶效应导致湿面筋网络结构破坏程度增加,使得水分从网络结构中离析出来,可冻结水量增加[20]。
加入冰结构蛋白后,冻藏1周冰的融化焓为83.4J/g,比空白样品降低了4.9%,而冻藏9周融化焓达到103.3J/g,比空白样品降低了8.9%,总的看来,加入ISP后,随着冻藏时间的增加,冰的融化焓仍是增加的,但是在冻藏时间相同时,含ISP的面筋蛋白冰融化焓值要明显小于空白样品,这是因为冰结构蛋白在范德华力、疏水相互作用和氢键作用下吸附到面筋蛋白体系中冰核表面,抑制冰核生长即抑制重结晶,减小了冰晶对湿面筋蛋白网络结构的破坏,从而减少了从网络结构中离析出的水分。
2.2 流变学特性变化
运用动态流变仪对样品进行频率扫描,研究其弹性模量和黏性模量的变化,即对样品施加相同的应力,研究振荡频率对弹性模量和黏性模量的影响。此方法可以在不破坏样品结构的情况下,直接获得与样品的弹性和黏性行为相关的信息。

图3 冻藏湿面筋蛋白弹性模量和黏性模量随频率的变化Fig.3 Changes inG' andG''of hydrated gluten frozen for different weeks with frequency
冻藏时间不同时,湿面筋蛋白弹性模量和黏性模量与频率之间的关系如图3所示。在频率为 0.1~100rad/s的范围内进行扫描时,湿面筋蛋白的弹性模量和黏性模量均是逐渐增加的,并且后者较前者增加更显著。其中G′始终大于G′′,因此面筋-水体系仍为黏弹性体系,这与先前报道的一致[21-22]。弹性模量和黏性模量均随冻藏时间的延长而减小,而前者的减小幅度较大。这些变化可能是由于在低温条件下,蛋白质构象发生改变或形成的冰晶对面筋网络结构的破坏而引起的。考虑到小麦面筋中的麦谷蛋白主要提供弹性,而麦胶蛋白主要为面筋提供黏性[21,23],随着冻藏时间的延长,G′变化较大,这也说明,在冻藏过程中,形成的冰晶可以更大程度上引起麦谷蛋白的断裂,进而使得弹性模量变化较为显著。
蠕变是指把一定大小的应力施加于黏弹性体时,物体形变(应变)随时间延长而逐渐增加的现象。25℃时,空白面筋蛋白及添加ISP的湿面筋蛋白在不同冻藏时间时的蠕变特性见图4。
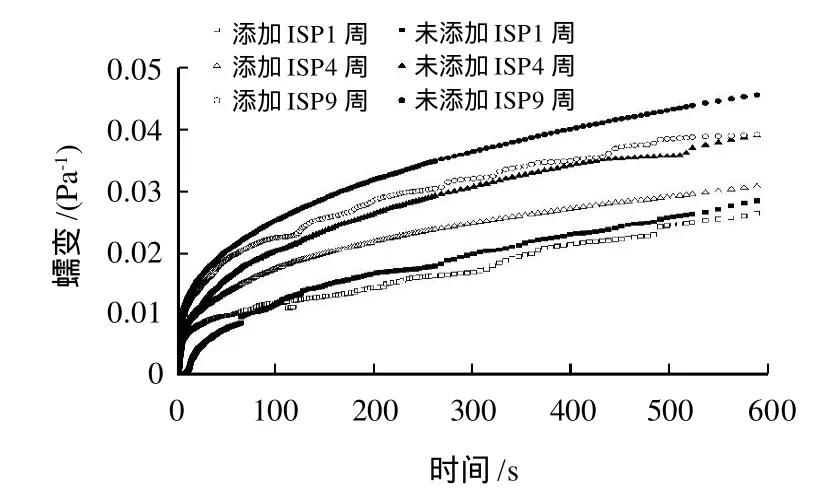
图4 ISP对冻藏湿面筋蛋白蠕变的影响Fig.4 Effect of added ISP on creep curves of hydrated gluten frozen for different weeks
蠕变曲线分为3个主要的阶段:1)瞬时弹性形变:在施加应力的-瞬间体系所发生的瞬时形变,在此阶段,如果应力除去,体系的形变会立即恢复;2)延迟弹性形变:紧接着体系的弹性形变开始缓慢增加;3)平衡形变:此时体系的弹性和黏性达到平衡,形变速率恒定。蠕变实验中,冻藏4周后面筋蛋白的形变明显增加,这表明面筋网络结构被破坏。当加入ISP时,面筋体系的形变量明显减小,表明加入ISP有效的保护了赋予面筋弹性的组分,即麦谷蛋白。Singh等[24]提出麦谷蛋白大聚体之间的缠绕产生的阻力抵抗变形和减慢滑移速率,缠绕点的数目决定于蛋白大聚体的长度和相对分子质量大小。因冻藏过程中形成的大冰晶可以破坏面筋蛋白之间的缠绕点,进而使得面筋蛋白的抗变形能力变差,引入ISP后,因其可以吸附到冰晶表面,有效抑制冰晶的生长和重结晶,减少对面筋蛋白结构的破坏,可以提高其抗变形能力。
2.3 微观结构研究
图5分别是空白湿面筋蛋白和添加ISP的湿面筋蛋白冻藏1、4、9周后的扫描电镜显微照片,图5A说明空白样品冻藏1周,便有粒径小的不规则空洞出现,说明此时已经有冰晶形成,随着冻藏时间的延长,面筋网络结构中的空洞逐渐变大,可以看到游离的淀粉颗粒存在。由图5C可以看出空白样品冻藏9周后,面筋网络结构中的空洞较大,说明重结晶形成的大冰晶对网络结构破坏程度较深。
图5a为冻藏1周后含质量分数0.5% ISP的湿面筋蛋白,与空白湿蛋白面筋蛋白(图5A)相比,网络结构中虽然也有空洞出现,但空洞粒径更小且均匀。冻藏4周后,即使加入ISP,面筋网络结构中的空洞不可避免的变大,面筋网络结构遭到破坏,但是遭受破坏的程度明显小于未加ISP的(图5b)。当冻藏时间延长到9周时,添加ISP在一定程度上降低了湿面筋网络结构遭受破坏(图5c)。这些结果说明引入ISP可以显著抑制冻藏对湿面筋蛋白网络结构的破坏。
冰晶形成以及重结晶效应所产生的大冰晶对面筋网络产生机械损伤是面筋网络在冻藏过程中受到破坏的最主要原因之一。因ISP可以抑制冰晶形成和重结晶,使得冷冻湿面筋蛋白网络内部和外部的可冻结水能够形成相对较小且均匀的冰晶,降低对湿面筋蛋白网络结构的破坏程度,从而提高冷冻面制品的品质。

图5 冻藏湿面筋蛋白SEM图(×600)Fig.5 SEM photographs of hydrated gluten with and without added ISP after different weeks of frozen storage (×600)
3 结 论
本实验研究了冰结构蛋白(ISP)对小麦湿面筋蛋白可冻结水含量、流变学性质和微观结构的影响,得到以下主要结论:随冻藏时间的延长,冰晶破坏了面筋网络结构,可冻结水含量增加,ISP可减少冷冻湿面筋蛋白中可冻结水的含量,维持冻藏过程中面筋蛋白网络结构的完整性;从流变学实验中可以看出,小麦湿面筋蛋白的G′和G′′随冻藏时间的延长而降低,在蠕变实验中,小麦湿面筋蛋白的形变随冻藏时间的延长而增加,添加ISP后可以显著减小其形变;SEM实验表明,空白样品冻藏1周,便有粒径小的不规则空洞出现,随着冻藏时间的延长,面筋网络结构中的空洞逐渐变大。添加ISP后可以抑制冻藏过程对湿面筋蛋白网络结构的破坏。
综上所述,冰结构蛋白对于提高湿面筋蛋白冻藏稳定性有很好的效果,本实验为ISP作为一种新型的添加剂,在冷冻面团及冷冻面制品中的应用提供了基础研究信息。
[1] DON C, LICHTENDONK W J, PLIJTER J J, et al. The effect of mixing on glutenin particle properties:aggregation factors that affect gluten function in dough[J]. Journal of Cereal Science, 2005, 41:69-83.
[2] DON C, LICHTENDONK W J, PLIJTER J J, et al. Understanding the link between GMP and dough:from glutenin particles in flour towards developed dough[J]. Journal of Cereal Science, 2003, 38:157-165.
[3] WEEGELS P L, HAMER R J. Functional properties of wheat glutenin[J]. Journal of Cereal Science, 1996, 23(1):1-18.
[4] OUTHAN M, MACRITCHIE F. Molecular weight distribution of wheat proteins[J]. Cereal Chemistry, 1999, 76:827-836.
[5] DON C, LICHTENDONK W, PLIJTER J J, et al. Glutenin macropolymer:a gel formed by glutenin particles[J]. Journal of Cereal Science, 2003, 37:1-7.
[6] TSIAMI A A, BOT A. Rheology of mixture of glutenin subfractions[J].Journal of Cereal Science, 1997, 26:l-9.
[7] LI W L, DOBRASZCZYK B J. Stress relaxation behavior of dough,gluten protein and gluten fractions[J]. Cereal Chemistry, 2003, 80:333-338.
[8] 黄卫宁, 邹奇波, 贾春利. 一种提高发酵型冷冻面团中蛋白质抗冻性的方法:中国, 200610037644.3[P]. 2009-03-11.
[9] 黄卫宁. 冰结构蛋白:GB2760新成员[N]. 中国食品报, 2006-08-22.
[10] CREVEL R W R, FEDYK J K, SPURGEON M J. Antifreeze proteins:characteristics, occurrence and human exposure[J]. Food and Chemical Toxicology, 2002, 40:899-903.
[11] ATICI O, NALBANTOGLU B. Antifreeze proteins in higher plants[J].Phytochemistry, 2003, 64:1187-1196.
[12] GRIFFITH M, EWART K V. Antifreeze proteins and their potential use in frozen foods[J]. Biotechnology Advances, 1995, 13:375-402.
[13] 周美玲, 邹奇波, 黄卫宁, 等. 冰结构蛋白影响冷冻面团及面包体系发酵烘焙与热力学特性的研究[J]. 食品科学, 2008, 29(11):125-129.
[14] 潘振兴, 邹奇波, 黄卫宁, 等. 冰结构蛋白对长期冻藏冷冻面团抗冻发酵特性与超微结构的影响[J]. 食品科学, 2008, 29(8):39-42.
[15] AKON H, TOSHIR L. DSC investigation of the states of water in poly(vinyl2 alcohol) membranes[J]. Polymer, 1985, 26(8):1207-1211.
[16] LAAKSONEN T J, ROOS Y H. Thermal, dynamic-mechanical, and dielectric analysis of phase and state transitions of frozen wheat doughs[J]. Journal of Cereal Science, 2000, 32:281-292.
[17] PABLO D, ALBERTO E, MARIA C A. Effect of freezing and frozen storage on the gelatinization and retrogradation of amylopectin in dough baked in a differential scanning calorimeter[J]. Food Research International,2003, 36:357-363.
[18] 宋国胜, 胡松青, 李琳, 等. 冷冻环境对湿面筋蛋白中可冻结水的影响[J]. 华南理工大学学报:自然科学版, 2009, 37(4):120-124.
[19] KONTOGIORGOS V, GOFF H D. Effect of aging and ice structuring proteins on the morphology of frozen hydrated gluten networks[J].Biomacromolecules, 2007, 8:1293-1299.
[20] AUTIO K, SINDA E. Frozen doughs:rheological changes and yeast viability[J]. Cereal Chemistry, 1992, 69:409- 413.
[21] KHATKAR B S, BELL A E, SCHOFIELD J D. The dynamic rheological properties of gluten and gluten sub-fractions from wheats of good and poor bread making quality[J]. Journal of Cereal Science, 1995, 22:29-44.
[22] HAYTA M, SCHOFIELD D. Dynamic rheological behavior of wheat glutens during heating[J]. Journal of the Science of Food and Agriculture,2005, 85:1992-1998.
[23] KOKINI J L, COCERO A M, MADEKA H, et al. The development of state diagrams for cereal proteins[J]. Trends in Food Science and Technology, 1994, 5:281-288.
[24] SINGH H, MACRITCHE F. Application of polymer science to protein of gluten[J]. Journal of Cereal Science, 200l, 33:23l-243.
Effect of Ice-structuring Protein on the Stability of Frozen Hydrated Gluten
LI Ling-ling1,JIA Chun-li1,HUANG Wei-ning1,*,KIM Yangsoo1,RAYAS-DUARTE Patricia2
(1. State Key Laboratory of Food Science and Technology, College of Food Science and Technology, Jiangnan University, Wuxi 214122, China;2. Food and Agricultural Products Research Center, Oklahoma State University, Stillwater OK 74078-6055, USA)
2009-12-15
国家自然科学基金项目(31071595);美国农业部国际交流与合作项目[A-(86269)];加拿大农业部国际交流与合作项目(CCSIC-Food-00107);国家现代农业(燕麦)产业技术体系建设专项目(nycytz-14)
李玲玲(1983—),女,硕士研究生,研究方向为谷物与烘焙科学、功能配料与食品添加剂。E-mail:lilingling1216@163.com
*通信作者:黄卫宁(1963—),男,教授,博士,研究方向为烘焙与发酵技术、谷物食品化学。E-mail:wnhuang@jiangnan.edu.cn
