羊肚菌多糖PMEP-1对大鼠肠道内短链脂肪酸的影响
2010-10-19吴素蕊曾凯芳桂明英陈宗道赵国华
明 建,吴素蕊,曾凯芳,桂明英,陈宗道,赵国华,*
(1.西南大学食品科学学院,重庆 400715; 2.重庆市特色食品工程技术研究中心,重庆 400715;3.昆明食用菌研究所,云南 昆明 650223)
羊肚菌多糖PMEP-1对大鼠肠道内短链脂肪酸的影响
明 建1,2,吴素蕊3,曾凯芳1,2,桂明英3,陈宗道1,2,赵国华1,2,*
(1.西南大学食品科学学院,重庆 400715; 2.重庆市特色食品工程技术研究中心,重庆 400715;3.昆明食用菌研究所,云南 昆明 650223)
研究羊肚菌多糖PMEP-1对大鼠肠道内短链脂肪酸的影响。以SD大鼠为实验模型,进行分组喂养,分别灌胃高剂量(400mg/(kg bw·d))、中等剂量(200mg/(kg bw·d))、低剂量(mg/(kg bw·d))的羊肚菌多糖PMEP-1,为期4周,定期收集大鼠粪便样。粪便处理后通过气相色谱法测定大鼠肠道内的短链脂肪酸含量。结果表明:羊肚菌多糖PMEP-1对于大鼠肠道内乙酸、丙酸、异丁酸、丁酸、戊酸、己酸的产生有较大影响,而对于庚酸和异戊酸没有明显作用;不同的灌胃剂量对大鼠肠道短链脂肪酸的影响有较大差异,以中等剂量和低剂量多糖对短链脂肪酸的产生影响明显,各剂量组大鼠肠道内短链脂肪酸的含量在第7~14天时最多。
羊肚菌;多糖;短链脂肪酸;大鼠
Abstract:In this study, the effect of a polysaccharide fraction from fruit bodies ofMorchella esculenta(L.) Pers, named PMEP-1 on short-chain fatty acids in the intestinal tract of rats was investigated. SD rats were orally administered PMEP-1 at high dosage (400 mg/kg bw·d), medium dosage (200 mg/kg bw·d) and low dosage (100 mg/kg bw·d) for a period of four weeks.Rat feces were collected periodically during the trial. Short-chain fatty acids in intestinal tract of rats were determined by gas chromatography. The results indicated that PMEP-1 had an obvious effect on the production of acetic acid, propionic acid,isobutyric acid, butyric acid, valeric acid and caproic acid, but had no obvious effect on the production of heptanoic acid and isovaleric acid. PMEP-1 at various dosages exhibited considerably different effects on short-chain fatty acids. An obvious effect of medium and low dosages of PMEP-1 on short-chain fatty acids was observed. The highest productivity of short-chain fatty acids in intestinal tract of rats in each dose group appeared at 7-14 days.
Key words:Morchella esulenta(L.) Pers.;polysaccharide;short-chain fatty acids;rat
羊肚菌(Morchella esulenta(L.)Pers.),又称羊肚蘑、羊肝菜、编笠菌,因外观极似羊肚而得名,属于盘菌(Pezizales),羊肚菌科(Morchellaceae)[1]。《本草纲目》记载羊肚菌具有“甘寒无毒,益肠胃,化痰理气”的特性和功效[2-3]。现代医学发现,羊肚菌可以防癌、抗癌、预防感冒,并有增强人体免疫力的功效,具有重要的开发和利用价值[4-5]。
短链脂肪酸(short-chain fatty acids,SCFA)是碳链为1~6的有机脂肪酸,主要在大肠内由厌氧微生物发酵难消化碳水化合物(寡糖、非淀粉多糖、抗性淀粉等)而产生,其中的乙酸、丙酸、丁酸所占比例高达85%[6-7]。SCFA在很多方面都起着重要的作用[8-12],可以影响结肠上皮细胞的转运,促进结肠细胞和小肠细胞的代谢、生长、分化,为肠黏膜上皮细胞及肌肉、肾、心、脑提供能量,增加肠道血供,影响肝脂质与碳水化合物的调控。
本实验以SD大鼠为实验模型,进行分组饲养,分别灌胃不同剂量的羊肚菌多糖PMEP-1,定期收集大鼠便样,粪便处理后通过气相色谱法测定大鼠肠道中的短链脂肪酸含量,实验通过观察肠道内短链脂肪酸的变化情况,了解羊肚菌多糖PMEP-1对肠道短链脂肪酸的影响,为进一步研究羊肚菌多糖在体内的代谢途径提供参考。
1 材料与方法
1.1 动物与饲料
SD大鼠:体质量(220±15)g,雌雄各半,由重庆腾鑫生物技术有限公司提供。
饲料及配方:基础饲料配方(%):面粉25、麦片25、玉米面25、豆面10、鱼粉8、骨粉4、酵母粉2、精盐1;高脂饲料配方(%):基础饲料88.2、胆固醇1.5、猪油10、猪胆盐0.3。
1.2 材料与试剂
羊肚菌多糖(polysaccharides fromMorchella esculenta(L.)Pers.,PMEP-1):由本实验室按文献[13]方法分离纯化所得;标准品乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、己酸、庚酸、2-乙基丁酸均为色谱纯 美国Sigma公司;HCl(分析纯) 成都科龙试剂厂。
1.3 仪器与设备
GC2010型气相色谱 日本岛津公司;LXJ-64-01型高速台式离心机 北京医疗仪器厂;JA5002型电子天平上海精天电子仪器有限公司。
1.4 方法
1.4.1 动物分组饲养与粪便收集[14]
取SD大鼠30只,雄雌各半,实验前喂养基础饲料10d后,空腹称质量。根据体质量、性别随机分为5组:正常对照组(NC)、高脂对照组(MC)、低剂量组(LD)、中等剂量组(MD)和高剂量组(HD),每组6只。NC组喂基础饲料,其余各组均喂高脂饲料,且LD组、MD组和HD组分别按100、200、400mg/(kg bw·d)的剂量给予受试多糖,给予方式为灌胃。实验大鼠自由进食及饮水,实验期为4周。在大鼠饲养的过程中,每隔一周采集一次大鼠粪便,并编号待测。共计收集5次,每次分为5组,分别是正常对照组(NC)、高脂对照组(MC)、低剂量组(LD)、中等剂量组(MD)和高剂量组(HD)并做好记录。
1.4.2 短链脂肪酸的测定
采用气相色谱法[15]。
标准曲线的制作:按文献[15]分别配制不同浓度的乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、己酸、庚酸、2-乙基丁酸(内标)标准溶液后,用带有火焰离子化检测器和自动进样器的气相色谱仪器进行气相色谱分析。最后以面积为纵坐标,以浓度为横坐标,绘制标准曲线。
色谱条件:石英毛细管柱(30m×0.53mm,0.5μm)。测定采用程序升温,初温100℃,保持0.5min,然后以8℃/min速度升至180℃,保持1min,采用不分流测定方式,然后以20℃/min的速度升至200℃,保持5min。FID温度为240℃,进样口温度为200℃;进样量为1 μL;载气:氮气,流速为3 m L/m i n。数据处理在H P ChemStation气相色谱工作站中进行。
样品的分析测定:准确称取粪便样品0.5g于10mL离心管中;加入4mL稀释液(15mL 100mmol/L 2-乙基丁酸和50mL 5mmol/L的HCl混合而成);均质1min;于5000r/min离心20min;取1mL上清液于安培瓶中,进行GC分析。根据标准曲线计算得出短链脂肪酸含量。
1.4.3 数据处理
数据采用Excel 2000统计分析,重复3次,结果用“平均值±标准差”表示。
2 结果与分析
2.1 羊肚菌多糖PMEP-1对大鼠肠道内乙酸含量的影响

图1 不同剂量羊肚菌多糖PMEP-1对大鼠肠道内乙酸含量的影响Fig.1 Effect of PMEP-1 at different dosages on acetic acid in intestinal tract of rats
乙酸是膳食纤维发酵的主要代谢物,乙酸可以被许多组织摄取和利用,是机体从小肠不能消化吸收的碳水化合物中得到能量的主要途径。由图1可知,灌胃羊肚菌多糖PMEP-1后,大鼠肠道内产生的乙酸随着灌胃时间的延长而增加,其浓度比NC组的大鼠高;喂养高脂饲料的大鼠肠道内产生的乙酸也比NC组多,原因可能是高脂饲料在大鼠体内分解产生了较多的乙酸;羊肚菌多糖PMEP-1不同剂量组之间,大鼠肠道内乙酸的浓度也有明显差异,其中中等剂量组大鼠在第7天时肠道内产生的乙酸最多。
2.2 羊肚菌多糖PMEP-1对大鼠肠道内丙酸含量的影响

图2 不同剂量羊肚菌多糖PMEP-1对大鼠肠道内丙酸含量的影响Fig.2 Effect of PMEP-1 at different dosages on propionic acid in intestinal tract of rats
由图2可知,只喂养基础饲料的NC组大鼠肠道内的丙酸含量变化不大,而灌胃不同剂量羊肚菌多糖PMEP-1后,大鼠肠道内丙酸的含量显著增加,低剂量组大鼠肠道内丙酸含量在第14天时最高,之后显著下降,中高剂量组大鼠则在第7天就达到最大值,之后随灌胃时间缓慢下降;喂养高脂饲料的大鼠,肠道内产生的丙酸也增多,主要还是高脂饲料在大鼠体内分解产生了较多的丙酸。
2.3 羊肚菌多糖PMEP-1对大鼠肠道内异丁酸含量的影响

图3 不同剂量羊肚菌多糖PMEP-1对大鼠肠道内异丁酸含量的影响Fig.3 Effect of PMEP-1 at different dosages on isobutyric acid in intestinal tract of rats
由图3可知,随着灌胃时间的延长,正常对照组的大鼠肠道内的异丁酸在前14d内上升,从第14天开始逐渐下降;高脂对照组的大鼠肠道内的异丁酸一直呈下降趋势;高剂量组大鼠肠道内的异丁酸在前14d几乎没有变化,从14d开始呈下降趋势;中等剂量组的大鼠肠道内的异丁酸在第7天达到最高,而后开始下降;而低剂量组的大鼠肠道内的异丁酸变化总体呈降低趋势,前14d几乎没有变化。但各剂量组和高脂对照组相比,中等剂量的羊肚菌多糖PMEP-1在第7天时能明显提高大鼠肠道内的异丁酸含量。
2.4 羊肚菌多糖PMEP-1对大鼠肠道内丁酸含量的影响

图4 不同剂量羊肚菌多糖PMEP-1对大鼠肠道内丁酸含量的影响Fig.4 Effect of PMEP-1 at different dosages on butyric acid in intestinal tract of rats
丁酸是肠道所有发酵产物中最重要的一种,它是人类结肠、盲肠上皮细胞最重要的能量来源,在维持肠道内环境稳定和预防结肠癌发生等方面发挥良好的作用。由图4可知,与NC组大鼠相比,灌胃不同剂量的羊肚菌多糖PMEP-1后,大鼠肠道内丁酸的含量均有显著增加;在第7天时,中剂量和高剂量组大鼠产生的丁酸比其他实验组多,最为显著;而低剂量组大鼠肠道内丁酸的含量变化较小。高脂对照组大鼠肠道内产生的丁酸在第14天时达到最大,之后也显著降低。
2.5 羊肚菌多糖PMEP-1对大鼠肠道内异戊酸含量的影响
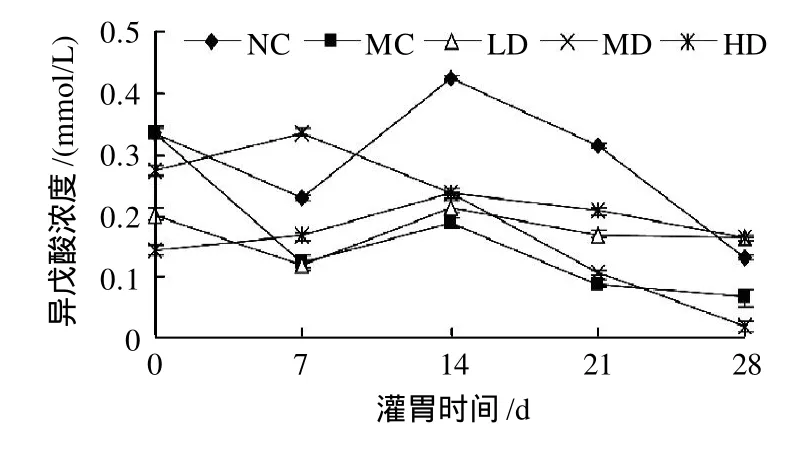
图5 不同剂量羊肚菌多糖PMEP-1对大鼠肠道内异戊酸含量的影响Fig.5 Effect of PMEP-1 at different dosages on isovaleric acid in intestinal tract of rats
由图5可知,随着喂养时间的延长,正常对照组大鼠肠道内的异戊酸在前14d内先降后升,第14天达到最高,之后显著下降;高脂对照组大鼠肠道内的异戊酸总体上呈下降趋势;高剂量组大鼠肠道内的异戊酸在前14d内呈缓慢上升趋势,之后逐渐下降;中等剂量组大鼠肠道内的异戊酸在第7天达到最高,而后开始下降;低剂量组大鼠肠道内的异戊酸变化不大。与高脂对照组相比,只有中等剂量的羊肚菌多糖PMEP-1在第7天时能提高大鼠肠道内的异戊酸含量。
2.6 羊肚菌多糖PMEP-1对大鼠肠道内戊酸含量的影响

图6 不同剂量羊肚菌多糖PMEP-1对大鼠肠道内戊酸含量的影响Fig.6 Effect of PMEP-1 at different dosages on valeric acid in intestinal tract of rats
由图6可知,随着时间的延长,NC组大鼠肠道内戊酸的含量持续增加;高脂对照组大鼠,肠道内产生的戊酸在第7天达到最高;与对照组相比,不同剂量的羊肚菌多糖PMEP-1对大鼠肠道内戊酸的影响比较复杂:各剂量组之间相比,中剂量组大鼠在第7天产生的戊酸比灌胃低剂量和高剂量都多,低剂量组大鼠在第14~21天产生的戊酸含量较多。
2.7 羊肚菌多糖PMEP-1对大鼠肠道内己酸含量的影响
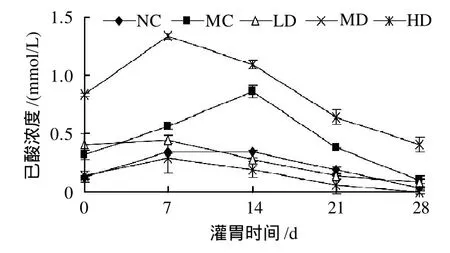
图7 不同剂量羊肚菌多糖PMEP-1对大鼠肠道内己酸含量的影响Fig.7 Effect of PMEP-1 at different dosages on caproic acid in intestinal tract of rats
由图7可知,随着喂养时间的延长,正常对照组大鼠肠道内的己酸在前7d内上升,从第14天开始逐渐下降;高脂对照组大鼠肠道内的己酸在前14d内显著增加,之后显著降低;高剂量组大鼠肠道内的己酸变化不明显,在21~28d时己酸的含量极少;低剂量组大鼠肠道内的己酸一直呈下降趋势;中等剂量组的大鼠肠道内的己酸含量在第7天达到最高,而后急剧降低。各剂量组与对照组相比,只有中等剂量的羊肚菌多糖PMEP-1能明显提高大鼠肠道内的己酸含量。
2.8 羊肚菌多糖PMEP-1对大鼠肠道内庚酸含量的影响
由图8可知,随着喂养时间的延长,正常对照组大鼠肠道内的庚酸含量在前7d内上升,之后显著下降;高脂对照组大鼠肠道内的庚酸含量在前14d内呈缓慢上升趋势,之后显著降低;高剂量组的大鼠肠道内的庚酸在前7d内不能测出,从7d开始呈上升趋势,到14d后开始下降;低剂量组大鼠肠道内的庚酸含量在前14d几乎没有变化,而后开始下降;而中等剂量组的大鼠肠道内的庚酸含量在前7d内逐渐增加,之后降低直至测不出来。

图8 不同剂量羊肚菌多糖PMEP-1对大鼠肠道内庚酸含量的影响Fig.8 Effect of PMEP-1 at different dosages on heptanoic acid in intestinal tract of rats
3 讨 论
羊肚菌多糖PMEP-1对于大鼠肠道内乙酸、丙酸、异丁酸、丁酸、戊酸、己酸的产生有较大影响。不同的灌胃剂量对大鼠肠道短链脂肪酸的影响有较大差异,就不同剂量而言,本研究发现,以中等剂量和低剂量多糖对短链脂肪酸的产生影响明显,而高剂量多糖对各短链脂肪酸的产生影响不大,其主要原因是高剂量组大鼠在喂养过程中食欲逐渐降低所致;就灌胃时间而言,在第7~14天各剂量对大鼠肠道短链脂肪酸的影响最大,几乎都是在这个时间段内达到了最大值。羊肚菌多糖PMEP-1对于大鼠肠道内庚酸和异戊酸的产生没有明显作用。而且不同剂量组之间对庚酸和异戊酸的产生几乎没有什么规律。
许多实验研究表明,碳水化合物底物的不同,发酵产生的短链脂肪酸的比例和生理作用也不同[16-17]。短链脂肪酸是由小肠内不被消化吸收的复杂碳水化合物(寡糖、非淀粉多糖、抗性淀粉等)进入大肠后由厌氧微生物发酵而产生的,其中短链脂肪酸(乙酸、丙酸、丁酸)所占比例高达85%,占产物的大部分。不同的多糖发酵可以产生不同比例的短链脂肪酸,这主要是由于碳水化合物结构的不同而影响肠道中不同菌群的发酵能力。由于羊肚菌多糖是由阿拉伯糖、甘露糖、葡萄糖、半乳糖等寡糖构成的高度分支杂多糖[13],不同种类的寡糖被降解成不同种类的短链脂肪酸,果胶与木聚糖降解的主要产物是乙酸,阿拉伯糖和半乳糖的则以丙酸为主。
羊肚菌多糖具有重要的生理功能活性[18-19],但其发挥生理功能的作用形式、构效关系等还有待明确。实验通过观察肠道内短链脂肪酸的变化情况,了解羊肚菌多糖PMEP-1对肠道短链脂肪酸的影响,为进一步研究羊肚菌多糖在体内的代谢提供参考。
[1] 任桂梅, 张少刚. 羊肚菌的研究进展[J]. 延安大学学报, 1999, 18(1):60-68.
[2] 宗凯, 杜光. 食(药)用羊肚菌研究现状[J]. 中国药师, 2006, 9(5):460-462.
[3] 刑增涛, 孙芳芳, 刘景圣, 等. 尖顶羊肚菌液体培养条件的研究[J].食用菌学报, 2004, 11(4):38-43.
[4] 薛福连. 林中一宝羊肚菌[J]. 绿化与生活, 2004(2):20.
[5] 李烨. 羊肚菌的研究与开发[J]. 中国食用菌, 2004, 23(1):9-11.
[6] 申瑞玲, 王章存, 姚惠源. 燕麦β-葡聚糖对小鼠肠道菌群的影响[J].食品科学, 2005, 26(12):208-212.
[7] TATSUYA M, SEIICHI K, AKIRA O, et al. Resistant proteins alter cecal short-chain fatty acid files in rats fed high amylose cornstarch[J].Journal of Nutrition, 1998, 128:1156-1164.
[8] 王子花, 申瑞玲, 李文全. 短链脂肪酸的产生及作用[J]. 畜牧兽医科技信息, 2007(2):12-13.
[9] 徐运杰, 方热军, 戴求仲. 短链脂肪酸的营养生理作用[J]. 饲养研究,2007(8):26-28.
[10] GUARNER F, MALAGELADA J. Gut flora in health and disease[J].Lancet, 2003, 361:512-519.
[11] SANDRA M, GEORGE T, MACFARLANE. Regulation of short-chain fatty acid production[J]. Proceedings of the Nutrition Society, 2003, 62:67-72.
[12] HIROSHI H, SATOKO H. Short-chain fatty acids suppress cholesterol synthesis in rat liver and intestine[J]. Journal of Nutrition, 1999, 129:942-948.
[13] 明建, 曾凯芳, 赵国华, 等. 羊肚菌水溶性多糖PMEP-1的分离纯化与结构特征分析[J]. 食品科学, 2009, 30(17):104-108.
[14] 徐叔云. 药理实验方法学[M]. 北京:人民卫生出版社, 1982:780-781.
[15] VINCENT L, EVA A, RENATO A. Measurement of fermentation products and substrate disappearance during incubation of dietary fiber sources with human faecal flora[J]. Lebensmittel-Wissenschaff und-Technologies,1998, 31:473-479.
[16] ZHAO Guohua, NYMAN M, JONSSON J A. Rapid determination of short-chain fatty acids in colonic contents and faeces of humans and rats by acidified water-extraction and direct-injection gas chromatography[J].Biomedical Chromatography, 2006, 20:674-682.
[17] ZHAO Guohua, LIU Jingfu, NYMAN M, et al. Determination of shortchain fatty acids in serum by hollow fiber supported liquid membrane extraction coupled with gas chromatography[J]. Journal of Chromatography B, 2007, 846(1/2):202-208.
[18] 孙晓明, 张卫明, 吴素玲, 等. 羊肚菌免疫调节作用研究[J]. 中国野生植物资源, 2001, 20(2):12-20.
[19] 明建, 曾凯芳, 赵国华, 等. 羊肚菌水溶性多糖PMEP-1降血脂作用研究[J]. 食品科学, 2009, 30(17):285-288.
Effect of a Polysaccharide Fraction from Fruit Bodies ofMorchella esculenta(L.) Pers on Short-chain Fatty Acids in Intestinal Tract of Rats
MING Jian1,2,WU Su-rui3,ZENG Kai-fang1,2,GUI Ming-ying3,CHEN Zong-dao1,2,ZHAO Guo-hua1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. Chongqing Special Food Programme and Technology Research Center, Chongqing 400715, China;3. Kunming Research Institute of Edible Mushroom, Kunming 650223, China)
R972.6
A
1002-6630(2010)19-0367-05
2010-05-10
中央高校基本科研业务费专项资金项目(XDJK2009C044);西南大学博士基金项目(SWU109005);云南省省校省院科技合作支持项目(2005YX24)
明建(1972—),男,副教授,博士,研究方向为食品化学与营养学。E-mail:mingjian1972@163.com
*通信作者:赵国华(1972—),男,教授,博士,研究方向为食品化学与营养学。E-mail:zhaoguohua1971@163.com
