猪胰脂肪酶水解花椒籽油动力学及条件优化
2010-09-13徐怀德刘立芳
徐怀德,唐 菊,刘立芳
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
猪胰脂肪酶水解花椒籽油动力学及条件优化
徐怀德,唐 菊,刘立芳
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
为开发花椒籽油中的α-亚麻酸,对猪胰脂肪酶水解花椒籽油的酶解特性和水解条件进行研究。结果表明:油水界面面积(αt)与温度(t)、搅拌速率(ω)、底物浓度(S)的关系为αt=0.04ω0.577t1.242S(1+0.02S)。水解反应速率随温度的变化服从Arrhenius方程,反应活化能为21.891kJ/mol。以米氏方程为理论基础,考虑αt对水解反应速率的影响,建立猪胰脂肪酶对花椒籽油的水解动力学模型。猪胰脂肪酶水解花椒籽油的适宜条件为:温度50℃、油质量分数30%、酶质量浓度72.9g/L,在此条件下反应4h后水解率达57.13%。
猪胰脂肪酶;花椒籽油;水解;动力学;条件优化
Abstract :In order to exploit α-linolenic acid from prickly ash seed oil, the hydrolysis characteristics of prickly ash seed oil by porcine pancreatic lipase were investigated and some key hydrolysis conditions were explored. The results indicated that an equation expressing oil-water interface (α t) with respect to reaction temperature (t), agitation speed (ω) and substrate concentration (S) was developed as follows: αt= 0.04ω0.577t1.242S (1 + 0.02S). The change in hydrolysis reaction rate with varying reaction temperature obeyed Arrhenius equation. The activation energy was 21.891 kJ/mol. Based on Michaelis-Menten equation and the effect of αt on reaction rate, a kinetic model was established to describe the hydrolysis of prickly ash seed oil by porcine pancreatic lipase. The optimal hydrolysis conditions of prickly ash seed oil by porcine pancreatic lipase were reaction temperature of 50 ℃, oil concentration of 30%, enzyme concentration of 72.9 g/L and reaction time of 4 h. The dgree of hydrolysis reached up to 57.13% under these optimal conditions.
Key words:porcine pancreatic lipase;prickly ash seed oil;hydrolysis;kinetic;condition optimization
花椒(Zanthoxylum bungeanum Maxim)被誉为我国“八大调味品”之一,目前在我国种植面积达80万hm2。花椒籽是花椒生产中的主要副产物,我国每年约有30~40万t的花椒籽油亟待开发利用[1-2]。花椒籽油中不饱和脂肪酸含量高达80%,其中亚油酸含量为25%~32%,α-亚麻酸含量为17%~24%[3],是极具开发潜力的油脂资源。α-亚麻酸是重要的医药、保健食品原料,具有抗炎症、抗血栓、抗心率失常、降血脂、改善血管弹性的作用,还具有调节中央神经系统、提高记忆力的功能,具有极高的经济价值和广阔的市场需求空间。花椒籽油的深度开发利用对提高花椒的种植效益、改善生态环境等具有重要意义。
近年来,花椒籽油主要用于生产油漆、制造肥皂、制备生物柴油,也有采用尿素包合法和色谱法分离纯化花椒籽油中的α-亚麻酸[2-3]。脂肪酸制备方法有酸水解法、皂化-酸水解法和酶催化水解法[4],酸水解法效率较低,皂化-酸水解法得到的产品颜色深,副产物多,为后续分离纯化带来很大困难。脂肪酶水解油脂制备脂肪酸具有条件温和、产品质量好、能耗低和环境污染小等优势,目前酶法已成为通过油脂生产脂肪酸的主要方法[5-6]。酶解亚麻油、鱼油、棕榈油、紫苏子油等制备脂肪酸的研究报道较多,但多数研究只停留在酶解条件的优化[7-10]。国外Okada 等[11]、Sulaiman等[12]对脂肪酶的酶解特性进行了研究,建立了脂肪酶催化油脂水解的动力学模型。而国内相关研究的报道较少,对酶解花椒籽油制备脂肪酸的研究尚未见报道。
本实验选用猪胰脂肪酶水解花椒籽油,研究其水解动力学特性,并对水解条件进行优化,以为花椒籽油及α-亚麻酸的开发应用提供参考。
1 材料与方法
1.1 材料与试剂
花椒籽油(平均相对分子质量为886) 陕西省韩城市金太阳花椒油脂药料有限责任公司。
猪胰脂肪酶(比活力8000U/g) 诺维信投资有限公司;KOH 天津市化学试剂厂;Na2HPO4、NaH2PO4天津金汇太亚化学试剂有限公司;酚酞指示剂 武汉市中天化工有限责任公司。
1.2 仪器与设备
DMBA-400数码显微镜 厦门麦克奥迪实业集团公司;MP200B电子天平 上海精密科学仪器有限公司;PHS-3C精密pH计 上海精密科学仪器有限公司雷磁仪器厂;HJ-4A数显恒温多头磁力搅拌器 金坛市杰尔瑞电器有限公司;KDC-40离心机 科大创新股份有限公司伟佳分公司。
1.3 方法
1.3.1 水解动力学实验
用0.05mol/L的Na2HPO4-NaH2PO4缓冲液(pH7.0)将猪胰脂肪酶配制成20U/mL酶液。将酶液及花椒籽油分别预热至水解温度后混合,在磁力搅拌器中恒温搅拌反应20min,取出后于沸水浴中灭酶15min。将水解产物离心,吸取2mL上层油相,用0.01mol/L KOH滴定,重复两次取平均值[13]。水解反应速率(υ)按式(1)计算[14]。

式中:V1为反应后样品消耗的KOH体积/mL;V0为反应前样品消耗的KOH体积/mL;c为KOH浓度/(mol/L);Vs为样品的体积/mL;t为反应时间/min。
1.3.2 油水界面面积(αt)的测定[15]
称取花椒籽油于三角瓶中,按实验预定的比例加入蒸馏水,在磁力搅拌器中恒温搅拌30min,吸取1滴样品于载玻片上,立即用显微镜测定分散在水相中的油滴粒径,每个样品测定200个油滴。将粒径按大小分为3组:小于10μm、10~20μm、20~30μm。按公式(2)计算平均粒径。

式中:D0为油滴平均粒径/m;i为测定油滴个数;j为粒径组数;di为第i个油滴的粒径/μm;θj为第j组油滴的个数在所测油滴总数中占的比例。
方程(3)为Calderbank[16]建立的油水界面面积与温度(t)、搅拌速率(ω)、底物浓度(S)的关系式:

式中:αt为油水界面面积/m-1;φ为油与反应体系的体积比;S为底物浓度/(mol/L);t为温度/℃;ω为搅拌速率/(r/min);α、m、k、n为常数。
1.3.3 中心组合试验[17]
称取猪胰脂肪酶于磨口三角瓶中,用0.05mol/L的Na2HPO4-NaH2PO4缓冲液(pH7.0)将其溶解,按比例加入花椒籽油,在恒温磁力搅拌器中恒温搅拌反应。根据前期预实验结果,选择搅拌速率为300r/min,反应时间为4h。以油质量分数、温度、酶质量浓度为试验因子,以水解率为响应值,采用中心组合试验优化猪胰脂肪酶水解花椒籽油的条件。水解率按公式(4)计算。

式中:AV0、AV分别为水解前后花椒籽油的酸价,水解前酸价(以KOH计),1.93mg/g;SV为水解前花椒籽油皂化值(以KOH计),190mg/g。
2 结果与分析
2.1 反应条件对油水界面面积的影响
2.1.1 底物浓度对油水界面面积的影响
磁力搅拌器中恒温40℃搅拌30min。搅拌速率和底物浓度对油水界面面积的影响如图1所示。

图1 底物浓度和搅拌速率对油水界面面积的影响Fig. 1 Effect of substrate concentration and agitation speed onαt
由图1可知,当底物浓度一定时,随着搅拌速率的加快,油水界面面积增大;当搅拌速率一定时,随着底物浓度的升高,油水界面面积增大。在底物浓度低于113mol/L时,油水界面面积的增速较快,底物浓度高于113mol/L时,油水界面面积的增速逐渐变缓。
2.1.2 温度对油滴平均粒径的影响
当底物浓度为113mol/L时,磁力搅拌器中搅拌30min,搅拌速率和温度对油滴平均粒径的影响如图2所示。

图2 温度和搅拌速率对油滴平均粒径的影响Fig.2 Effect of reaction temperature and agitation speed on the average diameter of oil droplets
由图2可见,随着搅拌速率和温度的升高,油滴平均粒径减小。
用方程(3)对图1和图2中的数据进行拟合,采用DPS软件估计模型参数,得到αt与t、ω及S的关系式:

统计检验的相关系数r=0.974,说明模型(3)对本实验数据的拟合是极显著的。
2.2 反应条件对反应速率的影响
2.2.1 底物浓度对反应速率的影响
酶质量浓度为30000g/L,温度40℃时,搅拌速率和底物浓度对反应速率的影响见图3。

图3 底物浓度和搅拌速率对反应速率的影响Fig.3 Effect of substrate concentration and agitation speed on reaction rate
由图3可见,随着底物浓度和搅拌速率的增大,反应速率上升。在同一搅拌速率下,底物浓度增加,油水界面面积增大,引起反应速率增大。当底物浓度高于224mol/L时,反应速率缓慢下降。
2.2.2 酶质量浓度对反应速率的影响
底物浓度为113mol/L,温度40℃时,搅拌速率和酶质量浓度对反应速率的影响见图4。
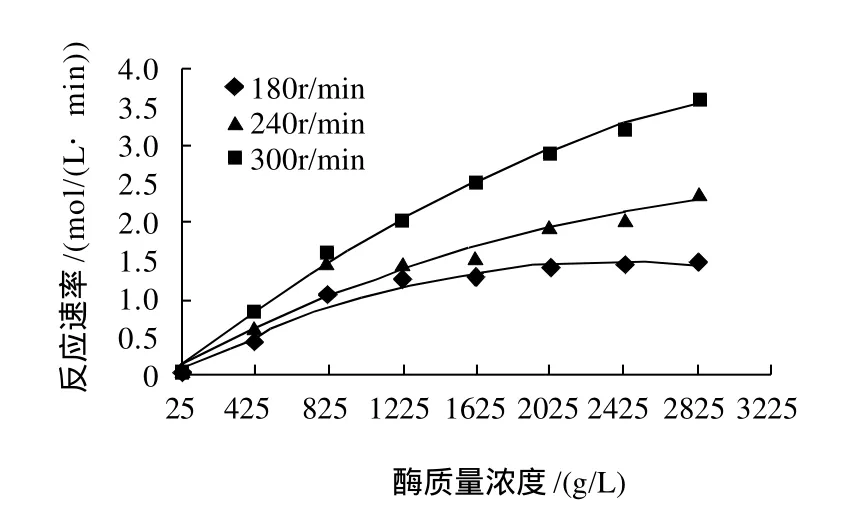
图4 酶质量浓度和搅拌速率对反应速率的影响Fig.4 Effect of enzyme concentration and agitation speed on reaction rate
由图4可知,当酶质量浓度低于825g/L时,反应速率与酶质量浓度呈线性关系;酶质量浓度高于825g/L时,随酶质量浓度的增大,反应速率增速逐渐变缓。另外,搅拌速率加快,油水界面面积增大,酶与底物接触的机会增多,则酶在油水界面上达到饱和时所需的酶量增多。
2.2.3 温度对反应速率的影响
底物浓度250mol/L,酶质量浓度250g/L,搅拌速率300r/min条件下,在温度分别为30、35、40、45、50、60、70℃时进行水解反应,温度与反应速率的关系见图5。

图5 温度对反应速率的影响Fig.5 Effect of reaction temperature on reaction rate
图5中的曲线是一条钟罩形曲线,即温度从30℃增加到50℃,反应速率增至最大,以后随着温度升高,反应速率迅速下降。

图6 lnν与1/T关系图Fig.6 Relationship between lnνand l/T
将lnν与1/T作图,得到如图6的直线,可见温度在303~323K范围内时,lnν与1/T之间呈线性关系,表明水解反应速率随温度的变化服从Arrhenius方程[7]:

式中:B为积分常数;R为气体常数/(J/(mol·K));Ea为活化能/(kJ/mol);T为热力学温度/K。
图6中直线斜率为-Ea/2.303R,由斜率可求出Ea为21.891kJ/mol。
2.3 动力学模型的建立及检验
2.3.1 动力学模型的建立[17-18]
在无有机溶剂的体系中,脂肪酶催化油脂水解反应发生在油水界面,脂肪酶催化油脂水解的过程分为3步,首先是脂肪酶通过渗透作用进入油水界面中,形成中间体E*;然后中间体E*与底物形成E*S复合物;最后分解成产物P,反应方程式见式(7)、(8):

由方程(7)和(8)推导出脂肪酶催化油脂水解的反应速率方程(9):

式中:kcat为催化速率常数/min-1;Am为酶在油水界面占的面积;S为底物浓度/(mol/L);ke为平衡常数/(mol/L);kp、kd分别为吸附和解析常数(单位为1);Et为酶质量浓度/(g/L)。
用方程(9)对图5和图6中的实验数据进行拟合,通过DPS软件分析,相关系数r为0.966,模型的参数见表1。
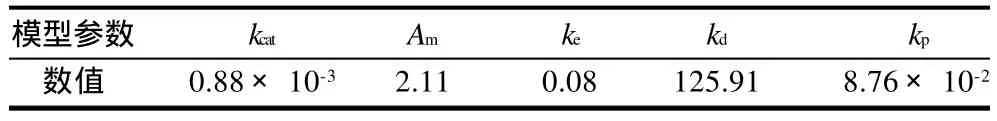
表1 模型参数Table 1 Parameters of the established hydrolysis kinetic model
将表1中参数代入方程(9),得到猪胰脂肪酶水解花椒籽油的动力学模型为:
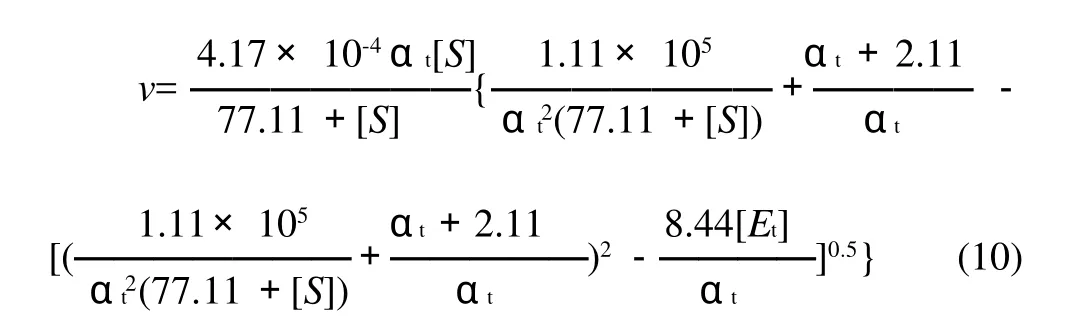
2.3.2 模型检验
取酶质量浓度500g/L和2500g/L高低两个梯度,底物浓度分别为50、100、150、200、250、300、350、400mol/L,按照1.3.1节的方法进行检验实验。图7为模型预测值与实验值的比较,模型的预测值与实验值吻合较好,因此可用该模型来描述猪胰脂肪酶水解花椒籽油的过程。

图7 模型预测值与实验值的比较Fig.7 Comparison of predicted and experimental values of hydrolysis reaction rate at different enzyme concentrations
2.4 中心组合试验优化酶解工艺条件
中心组合设计及试验结果见表2。以水解率(DH)为固定变量(Y),以温度(x1)、油质量分数(x2)、酶质量浓度(x3)为因变量,经Design-Expert7.0统计分析得到的数学模型为:

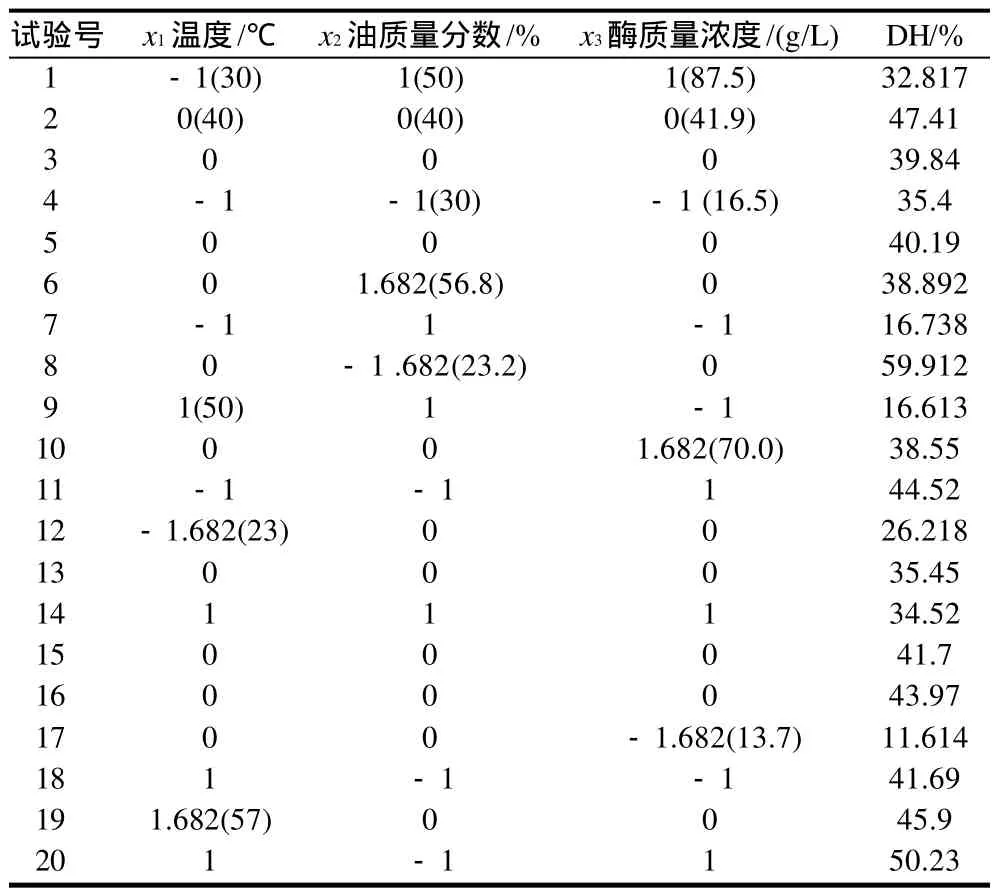
表2 中心组合试验设计及结果Table 2 Design and results of central composite experiments
2.4.1 回归模型的检验
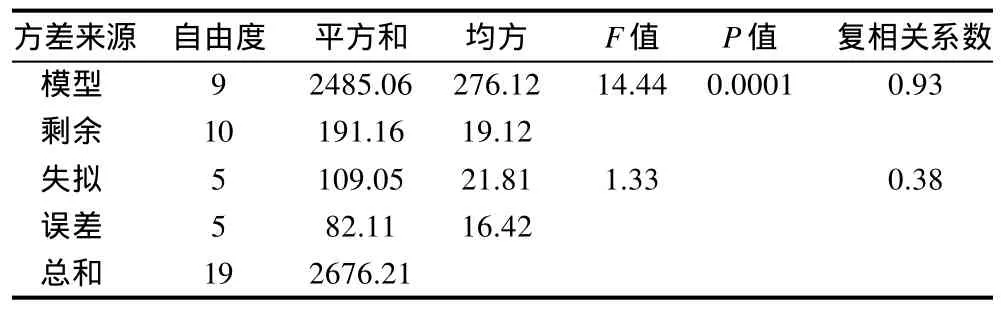
表3 回归方程显著性检验Table 3 Variance analysis for the developed regression equation
由表3回归模型的方差分析可知,回归模型的失拟性检验F=1.33<F0.05(5,5)=5.05,不显著,可以认为所选用的回归模型是适合的。模型P=0.0001<0.01,表明模型极显著,复相关系数R=0.93,说明模型的预测值与实际值吻合较好,模型具有实际意义。

表4 数学模型的回归系数及显著性检验Table 4 Regression coefficients of developed regression equation and corresponding variance analysis
由表4可知,一次项x1(P=0.01)、x2(P<0.0001)、x3(P=0.0001)和二次项x32(P=0.0003)均达到极显著水平;x12(P<0.05)、x22(P<0.05)达到显著水平。各因素对水解度的影响次序依次为x2>x3>x1,即油质量分数>酶质量浓度>温度。
2.4.2 酶解工艺参数的优化
采用Design-Expert7.0统计软件优化得到猪胰脂肪酶水解花椒籽油的最适反应条件为:温度50℃、油质量分数30%、酶质量浓度72.9g/L,在此条件下进行验证实验,反应4h水解率为57.13%,与预测值54.97%接近,拟和性好,表明了模型的有效性。
3 结 论
3.1 油水界面面积(αt)与温度(t)、搅拌速率(ω)、底物浓度(S)的关系为:αt=0.04ω0.577t1.242S(1+0.02S)。酶解反应速率随温度的变化服从Arrhenius方程,活化能Ea=21.891kJ/mol。
3.2 在米氏方程基础上,考虑αt的影响,建立的猪胰脂肪酶水解花椒籽油的动力学模型为:

此模型对实验结果预测性较好,可用于描述猪胰脂肪酶水解花椒籽油的动力学过程。
3.3 猪胰脂肪酶水解花椒籽油的二次回归数学模型为Y =41.51+3.42x1-7.8x2+7.17x3-2.43x21+2.29x22-6.31x32-1.3x1x2+0.16x1x3+2.04x2x3,适宜的酶解条件为温度50℃、油质量分数30%、酶质量浓度72.9g/L,在此条件下反应4h后水解率达57.13%,各因素对花椒籽油水解的影响顺序为:油质量分数>酶质量浓度>温度。
[1] 杨飞, 祝诗平, 邱青苗. 基于计算机视觉的花椒外观品质检测及其MATLAB实现[J]. 农业工程学报, 2008, 24 (1): 198-202.
[2] 张军华, 杨芳霞, 苏印泉, 等. 制备生物柴油用高FFA花椒籽油的酸催化降酸[J]. 中国粮油学报, 2008, 23(1): 84-87.
[3] 张氽, 阚建全, 陈宗道. 尿素包合法分离花椒籽油中的α-亚麻酸的正交试验研究[J]. 中国食品添加剂, 2004, 15(2): 28-31.
[4] 孙辉, 吕秀阳, 陈良. 不同植物油脂在近临界水中水解反应动力学的比较[J]. 化工学报, 2007, 58(4): 925-929.
[5] CHEW Y H, CHUA L S, CHENG K K, et al. Kinetic study on the hydrolysis of palm olein using immobilized lipase[J]. Biochemical Engineering Journal, 2008, 39(3): 516-520.
[6] JURADO E, CAMACHO F, LUZON G. Kinetic model for the enzymatic hydrolysis of tributyrin in O/W emulsions[J]. Chemical Engineering Science, 2006, 61(15): 5010-5020.
[7] 甘争艳, 吾满·江艾力, 夏木西卡马尔. 无溶剂体系及微乳体系中脂肪酶催化红花籽油水解的动力学[J]. 催化学报, 2006, 27(9): 810-814.
[8] 王英雄, 侯相林, 王国富, 等. 不同脂肪酶催化亚麻油水解反应性能的比较[J]. 中国油脂, 2003, 28(8): 54-56.
[9] 魏决, 罗雯, 陈玲. 酶法从紫苏子油中制取α-亚麻酸工艺研究: 脂肪酶水解工艺的探讨[J]. 食品科学, 2005, 26(1): 131-133.
[10] YAO Chuanyi, TANG Shaokun, HE Zhimin, et al. Kinetics of lipasecatalyzed hydrolysis of olive oil in AOT/isooctane[J]. Journal of Molecular Catalysis B: Emzymatic, 2005, 35(4): 108-112.
[11] OKADA T, MORRISSEY M T. Production of n-3 polyunsaturated fatty acid concentrate from sardine oil by lipase-catalyzed hydrolysis[J]. Food Chemistry, 2008, 73(7): 1411-1419.
[12] SULAIMAN A Z, MASITAH H, RAMACHANDRAN K B. Unsteadystate kinetics of lipolytic hydrolysis of palm oil in a stirred bioreactor[J].Biochemical Engineering Journal, 2004, 19(1): 81-86.
[13] 陈良, 吕秀阳. 近临界水中大豆油无催化水解反应动力学研究[J]. 农业工程学报, 2006, 22(4): 230-233.
[14] RAMACHANDRAN K B, SULAIMAN A Z, FONG C S, et al. Kinetic study on hydrolysis of oils by lipase with ultrasonic emulsification[J].Biochemical Engineering Journal, 2006, 32(1): 19-24.
[15] SULAIMAN A Z, HASAN M, RAMACHANDRAN K B. High enzyme concentration model for the kinetics of hydrolysis of oils by lipase[J].Chemical Engineering Journal, 2004, 103(1): 7-11.
[16] CALDERBANK P H. Physical rate processes in industrial fermentation,Part I: the interfacial area in gas-liquid contacting with mechanical agitation[J]. Tans Inst Chem Eng, 1958, 36(6): 443-447.
[17] 郑毅, 郑楠, 吴克刚. 固定化脂肪酶选择性富集鱼油ω-3多不饱和脂肪酸甘油酯[J]. 化工学报, 2006, 57(2): 56-61.
[18] ALBASI C, BERTRAND N, RIBA J P. Enzymatic hydrolysis of sunflower oil in a standardized agitated tank reactor[J]. Bioprocess Engineering,1999, 20(9): 77-81.
Kinetics and Optimization of Porcine Pancreatic Lipase-catalyzed Hydrolysis of Prickly Ash Seed Oil
XU Huai-de,TANG Ju,LIU Li-fang
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
Q556.1
A
1002-6630(2010)15-0055-05
2009-10-19
陕西省农业科技攻关课题(2007K01-10-2)
徐怀德(1964—),男,副教授,本科,主要从事软饮料、果品蔬菜贮藏与加工、天然产物提取研究。E-mail:xuhuaide@yahoo.com.cn
