Anti-HIF-1α-pEGFP重组质粒的构建及表达
2010-09-11宋毓平训敖启林
宋毓平 田 训敖启林
(湖北省武汉市东湖医院皮肤科,武汉430074;1湖北省武汉市中心医院妇产科,武汉430014;2华中科技大学同济医学院附属同济医院病理研究所,同济医学院病理学系,武汉430030)
Anti-HIF-1α-pEGFP重组质粒的构建及表达
宋毓平 田 训1*敖启林2
(湖北省武汉市东湖医院皮肤科,武汉430074;1湖北省武汉市中心医院妇产科,武汉430014;2华中科技大学同济医学院附属同济医院病理研究所,同济医学院病理学系,武汉430030)
目的 构建EGFP-HIF-1α反义重组质粒,转染人宫颈癌 Hela细胞,用以探讨 HIF-1α蛋白在宫颈癌的生长、转移中的作用。方法 应用基因重组技术构建EGFP-HIF-1α反义重组质粒,通过脂质体介导将其转染入 Hela细胞,倒置荧光显微镜观察转染效果,Western blot检测HIF-1α蛋白的表达。结果 酶切鉴定结果显示含 EGFP-HIF-1α反义重组质粒构建成功,并能在Hela细胞中封闭HIF-1α蛋白的表达。结论 EGFP-HIF-1α反义重组质粒构建及转染成功,封闭Hela细胞中HIF-1α蛋白的表达,为进一步研究HIF-1α蛋白在宫颈癌的生长、转移中的作用提供试验基础。
HIF-1α基因;重组质粒;基因转染;基因表达
目前的研究表明,在已知的肿瘤中大约有90%为实体瘤[1],缺氧作为恶性实体瘤的特征之一,改变了肿瘤细胞的生物学特征,导致肿瘤细胞的遗传不稳定性及恶性选择。缺氧诱导因子(hypoxia-inducible factors-1,HIF-1)是在缺氧条件下广泛存在于人体的一种转录因子,研究证实 HIF-1在动物及人体许多肿瘤中大量表达,对肿瘤的生长、血管形成、转移、凋亡及耐药皆有影响,随着分子生物学技术的发展,人们逐渐认识到 HIF-1α基因在其中的中枢地位,进一步研究 HIF-1α的调控及其结构,以及细胞缺氧时如何调整其基因的表达,将具有重要的意义,随着 HIF-1α研究的深入,以HIF-1α为靶点的治疗可能成为肿瘤治疗和预防的重要手段之一[2]。
本文选择 HIF-1α作为研究对象,利用基因重组技术构建EGFP-HIF-1α反义重组质粒,运用脂质体将EGFP-HIF-1α反义重组质粒转染 Hela细胞进行表达封闭研究,为进一步研究 HIF-1α蛋白在恶性肿瘤的生长及转移的作用提供试验基础。
材料和方法
1.反义 HIF-1α基因片段的获取
收集Hela细胞,用 TRIZOLTM试剂一步法提取细胞总RNA。PCR引物序列如下:反义HIF-1α(800bp):Upper 5′-CGGGATCCGGTGA TTTGGATATTGAAGATGAC-3′;Lower 5′-CGGGATCCGGTGATTTGGATA TTGAAGATGAC-3′。PCR反应条件为:94℃40s,58℃(60℃) 40s,72℃1min,共30个循环。取10μl陈PCR产物经1.5%琼脂糖凝胶电泳分离,紫外灯下观察并拍照。每个样本至少重复三遍。
2.EGFP-HIF-1α反义重组质粒的构建
真核表达载体pEGFP-C1购自Clontech公司。分别利用载体和目的基因两端的BglII和EcoRI酶切位点,用BglII和 EcoRI分别将反义 HIF-1α和载体pEGFP-C1双酶切,获取反义 HIF-1α基因片段和线性载体,琼脂糖凝胶电泳显示酶切结果正确后,用玻璃奶回收试剂盒回收目的片段和线性载体。酶切的反义HIF-1α基因与pEGFP-C1载体用T4 DNA连接酶(Invitrogen)连接。连接产物转化感受态细菌DH5α,涂布在含100μg/ml氨苄青霉素的LB琼脂平板。挑取抗氨苄青霉素的克隆,质粒小量提取试剂盒提取质粒,获取的质粒用BglII和 EcoRI双酶切,根据凝胶上电泳分析,鉴别出插入有反义HIF-1α基因的重组质粒EGFP-HIF-1α反义重组质粒。
3.细胞培养
Hela细胞于含3 mmol/L、10%胎牛血清的DMEM培养基中,在37℃,5%CO2的饱和湿度条件下培养。
4.基因转染
将EGFP-HIF-1α反义重组质粒在宿主菌中大量扩增,用 Eppendorf Perfectprep Plasmid Maxi试剂盒大量提取质粒,无菌条件下提纯,以备基因转染用。根据脂质体LipoFectamine2000(Invitrogen)试剂说明书,取处于对数生长期、状态良好的细胞,调细胞密度为2×105个/ml,接种于6孔板内,培养24h,待细胞融合至50%-60%,将脂质体-DNA复合物加入,无血清培养基培养4小时后,终止转染,继续培养12h,倒置荧光显微镜观察转染效果。48h后换含不同浓度 G418的筛选培养基培养。
5.细胞化学性低氧模型的建立
取对数期增长的 Hela、EGFP-C1 Hela、EGFP-HIF-1α反义Hela三组细胞,向培养基中加入经直径为0.22μm微孔滤膜过滤后的CoCl2,按终浓度为50、100、150、200、250μm/L分组,持续培养3-5代,使细胞在该浓度CoCl2作用下稳定生长传代。
6.蛋白质免疫印迹(Western blotting)
收集低氧模型生长的 Hela、EGFP-C1 Hela、EGFP-HIF-1α反义 Hela三组细胞,提取细胞总蛋白。取50μg蛋白质样品进行SDS-PAGE电泳,并采用半干电转移仪将蛋白质转移至硝酸纤维素膜(NC膜)上;用含0.05%Tween20的 TBS缓冲液(TBST)配制5%脱脂奶,水平摇床室温振摇封闭NC膜2h;用TBST液稀释的兔抗人 HIF-1α单抗(1:500)于4℃孵育NC膜过夜;TBST液漂洗3次,各10 min,加入相应的碱磷酶标记的二抗(1:500),水平摇床室温振摇1h,TBST液再次漂洗 3次,各 10 min;用显色底物 NBT/ BCIP/buffer(1:1:50)显色。
结 果
1.EGFP-HIF-1α反义重组质粒的构建和鉴定构建的 EGFP-HIF-1α反义重组质粒用BglII和EcoRI双酶切后,电泳可见约的800bp目的片段和4362bp载体片段,酶切结果与预期结果相符。见图1。
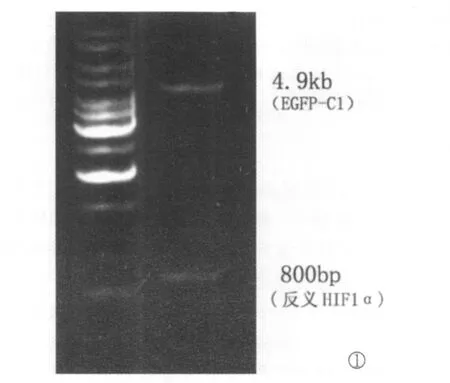
图1 反义EGFP-HIF-1α重组质粒的限制性内切酶酶切图谱分析Fig.1 The analysis of the recombinant plasmid anti-EGFP-HIF-1αdigested by restriction enzyme
2.转染结果 EGFP-HIF-1α反义重组质粒和EGFP-C1转染Hela细胞24h后加入 G418(终浓度为100-1000μg/ml),用未转染质粒的 Hela细胞作阴性对照。含 G418 1000μg/ml终浓度的DMEM培养液培养转化后,实验组部分细胞失去贴壁生长能力。更换 G418浓度降到500μg/ml,继续培养,转基因细胞多数仍贴壁生长,但增殖缓慢,而对照组(未转染)的细胞经 G418筛选已全部死亡浮起,阳性转染细胞克隆贴壁生长(图2A, 2B),表明质粒转染成功,稳定 G418浓度进行筛选出生长良好的转染重组质粒细胞和空白载体细胞,继续传代培养并冷冻保存。
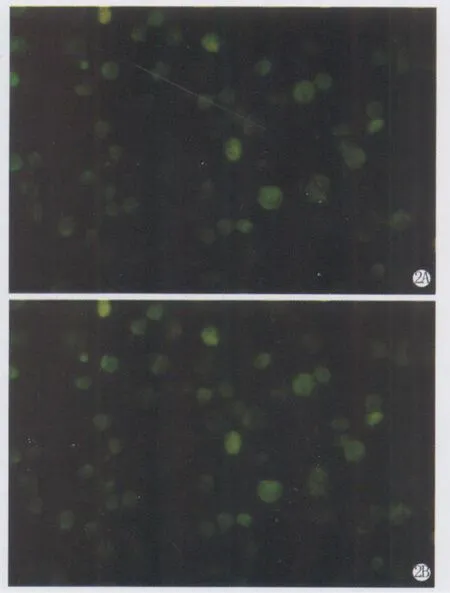
图2 含G418的DMEM培养液培养转染后的 Hela细胞.A.转染反义 EGFP-HIF-1α重组质粒的 Hela细胞;B.转染EGFP-C1的Hela细胞Fig.2 Transfected Hela cells screened by G418 in DMEM.A.Hela cells transfected with the recombinant plasmid anti-EGFP-HIF-1α;B.Hela cells transfected with EGFP-C1
3.Western blotting结果分析收集细胞,裂解后取上清液,蛋白质变性,常规SDS-PAGE电泳,转膜,封闭,按Western blot试剂盒说明操作,蛋白免疫印迹结果显示未转染重组质粒和仅转染EGFP-C1质粒的 Hela细胞中有 HIF-1α蛋白的表达条带,而经转染的Hela细胞无表达(图3)。
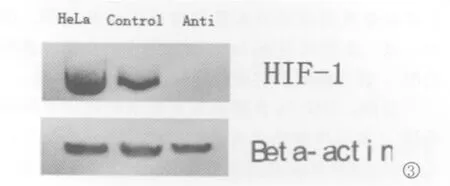
图3 Hela、EGFP-C1 Hela、EGFP-HIF-1α反义Hela三组细胞缺氧环境下的 HIF-1α蛋白表达;1.反义 EGFP-HIF-1α转染后的 Hela细胞(Anti);2.EGFP-C1转染后的 Hela细胞(control);3.Hela细胞(HeLa).Fig.3 The expressions of HIF-1αprotein in Hela cells untreated or those transfected with anti-EGFP-HIF-1αor EGFP-C1;1.Hela cells transfected with anti-EGFP-HIF-1α(Anti);2.Hela cells transfected with EGFP-C1(Control);3.Hela cells untransfected(HeLa)
讨 论
在肿瘤的发生发展中,由于肿瘤生长迅速,其增生速度超过周围血管的生长速度,导致局部缺氧,进而诱导 HIF-1的表达,可见 HIF-1不仅是调节氧动态平衡的关键因子,而且与肿瘤的演进关系密切。肿瘤细胞存在着对缺血缺氧的自身调节和适应,其机制主要通过提高葡萄糖转运、糖酵解(Warburg效应)及肿瘤血管形成。Heather等[3]从免疫组织化学资料中发现 HIF-1α在肿瘤生物学中发挥重要作用,在良性肿瘤组织中,HIF-1α处于正常水平,在许多原发性恶性肿瘤中 HIF-1α水平升高,而在转移性肿瘤,HIF-1α水平升高更加显著。随着实体瘤的增大,肿瘤内部不能得到足够血液供应,导致局部处于缺血缺氧状态。因此, HIF-1α的过表达可能在肿瘤发生、发展中发挥重要作用。
近期有学者通过免疫组化法对宫颈癌患者进行HIF-1α的检测,其阳性率高达72.1%,并发现阳性细胞大部分集中在肿瘤坏死边缘,而且与肿瘤的临床分期、大小、组织学类型、淋巴结转移情况及病理分级无关,Fujimoto[4]等认为,在宫颈癌中, HIF-1α的表达与组织学类型和淋巴结转移无关,但其水平在进展期宫颈癌患者中显著升高,徐军[5]等研究表明 HIF-1α在宫颈癌中的表达与宫颈鳞癌的肿块大小、国际妇产科协会分期、组织学分级、淋巴结转移和肿瘤坏死密切相关。HIF-1α作为细胞氧平衡和缺氧诱导基因表达的中心调节子 ,能接受多种条件的刺激 ,同时又能调节多种酶或者生长因子,促使肿瘤细胞在缺氧状态下获得更多的能量和血液供应进而促进肿瘤的生长和转移。因此,进一步研究HIF-1α在宫颈癌中的功能和调控机制 ,将可能成为宫颈癌诊断和治疗的新思路。
目前,HIF-1α在临床方面的研究还处于初级阶段 ,其与肿瘤临床病理特征的关系还不十分明了。其次HIF-1α在肿瘤治疗方面的研究仍处于实验室研究阶段,以缺氧为基础的选择性治疗方案尚未应用于临床,但显示潜在前景的治疗策略正在实验室和临床试验的研究之中,它极有可能为肿瘤的治疗提供一条新的出路。本研究采用人宫颈肿瘤Hela细胞作为细胞模型,利用带有荧光标记的真核表达载体pEGFP-C1,构建含有反义 HIF-1α的真核表达重组体反义EGFP-HIF-1α。进而将重组质粒转染到 Hela肿瘤细胞,重组质粒转染 Hela细胞后用G418筛选稳定转染细胞株,选择抗性克隆,将新的克隆细胞挑选出扩大培养。用免疫印迹法(Western Blot)检测转染细胞株表达 HIF-1α蛋白的情况,结果显示转染细胞株表达的 HIF-1α蛋白水平下降。通过本次试验可为进一步探索 HIF-1α在宫颈癌中的作用提供一理想对照试验细胞模型及试验依据。
[1]Brown JM.Exploiting the hypoxic cancer cell:mechanisms and therapeutic strategies.Mol Med Today 2000;6:157-162
[2]张俊文,王丕龙.缺氧诱导因子在恶性肿瘤中的作用.肿瘤防治研究,2004,31(2):911
[3]Ryan HE,Polini M,McNuty W,et al.Hypoxia-inducible factor-1alpha is a positive factor in solid tumor growth.Cancer Res,2000,60:4010-4015
[4]Fujimoto J,Alam SM,Jahan I.Plausible linkage of hypoxia inducible factor-1alpha in uterine cervical cancer.Cancer Sci,2006,97(9):861-867
[5]徐军,施红旗,刘庆伟,等.HIF1α、VEGF在宫颈鳞癌中的表达及临床意义.浙江实用医学,2006,11(1):628
CONSTRUCTION AN D EXPRESSIONOF RECOMBINANT PLASMID ANTI-EGFP--HIF-1αIN HE LA CE LLS
Song Yuping,Tian Xun1*,Ao Qilin2
(Department of Dermatology,Donghu Hospital of Wuhan,Wuhan430074;1Department of Obstetrics&Gynecology,The Central Hospital of Wuhan,Wuhan430014;2Institute ofPathology,Tongji Hospital,and Department ofPathology, Tongji Medical College,Huazhong University of Science and Technology,Wuhan430030,China)
Objective To construct and transfect HIF-1α(hypoxia-inducible factors)gene recombinant antisense plasmid pEGFP-HIF-1αin order to detect the function of the HIF-1αprotein.Methods Recombinant antisense pEGFP-HIF-1αwas cloned into an eukaryotic expression vector,and transfected into Hela cells by lipofectamine mediated gene transfer.The efficiency of tranfection was determined by microscopy,and the block of HIF-1αwas detected by Western blot.Results The recombinant antisense plasmid pEGFP-HIF-1αwas correctly cloned.The block of HIF-1αgene expression was detected distinctly after transfection.Conclusion The antisense pEGFP-HIF-1αwas effectively cloned and transfected,which can be used to further study the fuction of HIF-1αprotein.
Hypoxia-inducible factors;Recombinant plasmid;Gene transfection;Gene expression
R361
A
10.3870/zgzzhx.2010.04.019
2010-02-05
2010-05-20
宋毓平,女(1980年),汉族,学士。
*通讯作者(To whom correspondence should be addressed)
