血管和神经血管栓塞器械指南
2010-09-05杨丽娜奚廷斐中国药品生物制品检定所北京100050
杨丽娜 奚廷斐 中国药品生物制品检定所 (北京 100050)
血管和神经血管栓塞器械指南
杨丽娜 奚廷斐 中国药品生物制品检定所 (北京 100050)
该指导文件描述了血管和神经血管栓塞器械注册申请时的要求,通过参考国内外政策法规,指出了国内这两种器械注册申请时应注意的问题并给出了一些建议,
栓塞器械 健康风险 临床试验
Abstract:This guidance document described the requirements of an application for vascular and neurovascular embolization devices registration. By referring to domestic and international policies and regulations, the guidance pointed out some problem that the domestic application for registration of these two devices should pay attention to and gave some suggestions.
Key words:embolization devices, health risks, clinical test
0 概述
血管栓塞器械和神经血管栓塞器械都属于具有重大危险的器械,它们都是通过植入血管发挥治疗作用。血管栓塞器械是用来治疗由于某种类型的肿瘤(如肾瘤、肝癌、子宫肌瘤、动脉瘤等)以及动静脉畸形等引起的出血。神经血管栓塞器械是为了持久的阻塞脑动脉瘤血管和脑畸形血管的血流。根据《医疗器械监督管理条例》(国务院令第276号)的分类管理规定,血管栓塞器械和神经血管栓塞器械属于第三类医疗器械,它们在预期使用范围内的健康风险是一样的。这两种器械的生产者要进行产品注册时除了要满足一般器械的管理规定外,还要提供更多资料信息以满足这两种器械的特殊规定。本指南是在美国FDA相关指南的基础上,结合国内相关管理规定编写而成。
1 注册申请的内容和格式
在提交医疗器械注册申请时,需按《医疗器械注册管理办法》的要求提交一系列的注册申报资料,如产品的技术报告、性能报告、检测报告、风险分析报告,依赖标准以及器械说明书等,其中《产品技术报告》是对申请注册的医疗器械产品进行技术审评时具有重要参考价值的资料,其内容的完整与否直接影响到对产品能否做出全面、科学及正确的评价,从而影响到产品的注册效率和结果。因此,希望申请注册的企业或单位能够对申报资料的质量给予充分的重视,通过申报者和审评者的共同努力来促进审评质量和效率的提高。
(1) 产品的国内外动态分析情况
包括:国内外同类产品的上市情况与申报产品工作原理、原材料和生产工艺等相关的对比情况;是仿制产品应说明和XX公司的产品等同或差异。
(2) 产品介绍
产品名称及确定依据,产品分类及分类依据、产品用途等;不能夸大产品名称、用途等。
(3) 产品作用原理
预期与人体接触的部位(组织)、接触方式、作用时间(包括多量次产品的累积时间),可接受的最长接触时间。注明是否可降解材料,提供降解周期和降解产物的相关研究资料;
(4) 产品原材料(包括:涂层、染料等)
公认的材料化学名称、化学结构式/分子式/分子量(高分子材料)、材料理化特性等信息。商品名/材料代号、质量标准、材料成分等;若产品供货状态是在保存液中,应提供保存液的成分与含量信息几相关安全性评价资料。
(5) 产品结构(附图示)与组成
明确预期与人体接触部分的产品组成及所用材料;明确产品规格型号间的异同点(说明不同规格相好的差异特点)。
(6) 产品生产加工过程
包括加工工艺、各种加工助剂的使用,对残留单体或小分子残留物的控制情况等;
(7) 产品性能要求
指出检验方法的确定依据;提供安全性、有效性的要求;提供涉及到的研究资料、文献报道、标准文本等。
(8) 有效期和包装情况
无菌产品应提供产品有效期的确定依据,产品稳定性的验证材料;对于表明有使用寿命的产品,应提供使用寿命的确定依据和/或相关支持性资料;无有效期的应说明理由。
2 范围
6877介入器材

序号 名称 品名举例 管理类别3 栓塞器材 滤器、弹簧栓子、栓塞微球、铂金微栓 子、封堵器 III
3 器械描述
• 器械的加工用试剂和原料的标识(也就是试剂来源,纯度,化验证明书,或物质安全数据表(MSDS))和所有参与的原料应遵循的标准。
• 具有潜在毒性的任何试剂(如有机溶剂,重金属,残留于器械中的交联剂)的含量和标识。
• 器械的各组件和其整体装置的描述
• 同器械一块使用的任何附件和辅助装置的描述(如输送导管)
• 器械大小和形状范围以及器械设计
• 器械装置图样
• 工作原理描述(也就是栓塞方法和展开方法)
• 描述器械是如何供应的(如无菌、成套、一次性使用)
4 健康风险
在下面的表格里,指出了与器械的使用相关的健康风险。该文件也推荐了一些缓解这些风险的方法,详见下表。建议你在提交注册申请前自己也进行一次风险分析以确定针对你的器械的其他附加风险。例如,妇科用器械可能会呈现的其他附加风险,如对子宫壁的损伤,引起弥漫性子宫坏死,原发性卵巢功能衰竭,生殖毒性或致癌性,以及其他与化学、毒理学相关的风险,还有可能影响子宫环境中的愈合反应。
如果你选择用非传统的方法解决文件中指出的常见风险或已证实的附加风险,那么就要提供足够的细节说明来支持所用的解决风险的方法。
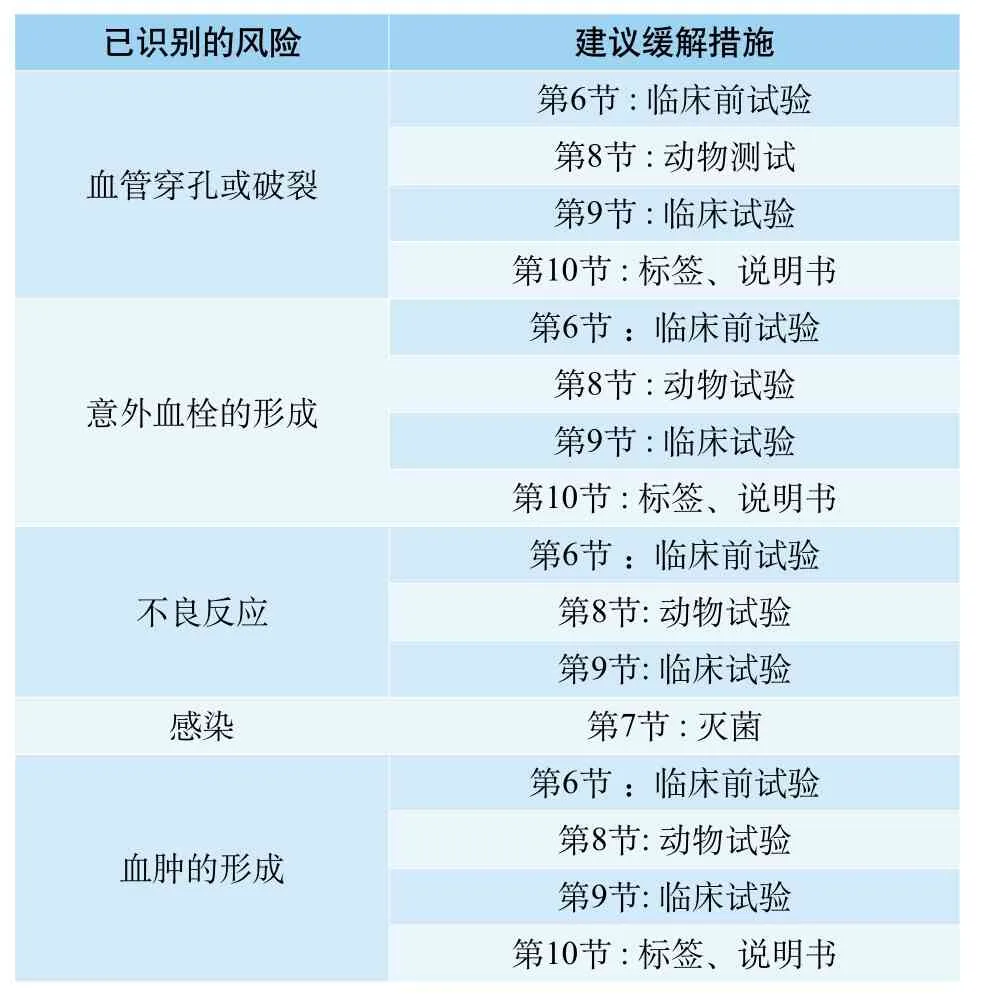
已识别的风险 建议缓解措施血管穿孔或破裂第6节 : 临床前试验第8节 : 动物测试第9节 : 临床试验第10节 : 标签、说明书意外血栓的形成第6节 :临床前试验第8节 : 动物试验第9节 : 临床试验第10节 : 标签、说明书第6节 :临床前试验第8节: 动物试验第9节: 临床试验感染 第7节 : 灭菌不良反应血肿的形成第6节 :临床前试验第8节: 动物试验第9节: 临床试验第10节 : 标签、说明书
5 临床前试验
建议实施以下临床前试验来确定器械的性能特点。
(1) PVA(聚乙烯醇)颗粒试验
• 最终消毒装置的化学分析,包括任何加工助剂、杂质等的定性和定量
• 如果可能,解释甲醛和/或其他加工原料是如何从颗粒中消除的,并用数据评估消除过程
• 颗粒粒度范围
• 评估粒度与推荐用输送导管的兼容性
• 根据标签指示,将颗粒与造影剂或其他相互作用的物质在导管内混合时,导管内悬浮液的分散均匀性评价。
(2) 可分离式球囊试验
• 各规格球囊的膨胀/压缩率
• 球囊破裂所需压强和体积以及最大膨胀压强和体积的出厂质量标准
• 体积与膨胀压强关系图
• 分离球囊所需力量
• 与推荐的对照物相比,球囊的气体透出量
• 分离机制的可靠性
(3) 弹簧栓子试验
• 弹簧栓子强度(也就是使其变形所要求的力---初级和次级直径,以及弹簧栓子的拉伸强度、扭转阻力和抗疲劳性)
• 输送的容易度,将推荐的导管置于一个模拟的弯曲度上,通过测量弹簧栓子在导管中推进或收回时的摩擦力来确定
• 对于含纤维的弹簧栓子要描述纤维的附着机制和拔力
• 分离机制描述和分离时间数据• 分离机制的可靠性
(4) 输送导管试验
• 导管的长度和外围直径
• 拉伸强度
• 导致导管爆裂/泄露所需压力
• 弹性
• 导管内溶液流速与此时导管内压力关系图
• 中心附着强度
• 扭转阻力
• 射线不透性
• 导管外表面摩擦系数
• 如果导管有涂层,要有涂层材料、涂层过程的描述,以及支持涂层目的的数据描述
• 耐腐蚀性
(5) 保存期限
针对器械实施临床前实验和包装试验这两个试验,以确定保存期限(也就是截止日期)。验证试验信息应支持加速试验的结果,并且,根据器械组成,实时测试数据也应支持加速试验结果。对于物理试验,应选用具有老化代表的样品进行临床前试验和包装试验。对于包装试验,建议对最终完成的产品包装进行试验,测试其初始完整性及完整性的保持,所用试验方法应是验证过的试验方法或标准规定的。
(6) 生物相容性
在研究医疗器械的致癌性时应该有阳性遗传毒性结果作为对照,在评估潜在的致癌性时,鉴于它们的毒性,应该考虑到器械的化学组成及相关信息。
针对神经血管栓塞器械,由于灭菌剂环氧乙烷(EO)可能会导致神经毒性,除了测量EO的残余量以外,对用于颅内植入的EO-灭菌器械提供生物相容性信息,从而评价其任何不良组织反应,或者举出其他EO-灭菌的已合法上市且实质性等同的产品。要证明器械中残留灭菌剂的浓度不会降低其使用的安全性。
(7) 热源测试
由于与灭菌后内毒素的最终含量有潜在联系,神经血管栓塞器械灭菌后内毒素含量应低于0.06EU/ml,血管栓塞器械应低于0.5 EU/ml。
6 灭菌
器械的无菌保证水平应在1x10-6。检测EO-灭菌器械时请参考上面的生物相容性部分。
7 动物实验
通常建议进行一次临床前动物模型评价来评价这些器械,以此来证明你已经充分的解决了该指导文件中指出的风险。在没有合适的替代模型时应考虑用动物模型。器械的新的设计特征(如对弹簧栓子涂层,弹簧栓子结构设计,弹簧栓子材料,颗粒材料,颗粒形状大小)有可能会影响器械本身的作用或分离机制,建议用动物研究评价:
• 输送容易度(摩擦和扭曲)
• 急性并发症(如血管破裂或穿孔)
• 血管再通/闭塞持久性
• 局部或全身的异物反应
• 器械迁移
• 栓塞的有效性
由于栓塞介质的设计和结构材料的改变可能会影响栓塞位点的愈合过程,建议以合适的频率进行重复评价,并在一定时间后评价其急性和慢性毒性。慢性毒性评价可以帮助确定机体对栓塞剂的反应已稳定或正在适应过程中。同时提供相关文献和支持性试验来解释动物模型与人体环境的相关性。
8 临床试验
根据《医疗器械监督管理条例》(国务院令第276号)和《医疗器械临床试验规定》中的要求,生产第三类医疗器械要通过临床验证。医疗器械临床试验分医疗器械临床试用和医疗器械临床验证。
对于市场上尚未出现过,安全性、有效性有待确认的医疗器械要进行临床使用,来验证该医疗器械理论原理、基本结构、性能等要素能否保证安全性有效性。对于同类产品已上市,其安全性、有效性需要进一步确认的医疗器械要进行临床验证,来验证该医疗器械与已上市产品的主要结构、性能等要素是否实质性等同,是否具有同样的安全性、有效性。
临床研究必须在《医疗器械临床试验规定》的规章管理下进行,血管和神经血管栓塞器械都属于重大危险器械,这类实验的发起人还应符合管理机构审查委员会和受试者《知情同意书》的要求。
针对器械的临床研究,建议认真考虑以下信息。
(1) 终点
建议你的临床研究方案中包括界定清除的主要和次要终点以及关于研究结果的具体的通过/失败标准,定义并报告所有的不良反应。
疗效终点应包括:通过造影术显示的血管病灶的大小变化和动脉瘤或载瘤血管的栓塞程度,也建议考虑其他终点,如栓塞的血管的再通率和/或临床受益的测定。例如,对于用作外科手术前栓塞的器械,可选择手术时间和出血量的减少作为合适的终点。
对于神经血管栓塞器械,其安全性评价应包括:
• 新的神经功能障碍发生率(暂时性的和永久性的)
• 神经术后结果评估
• 神经系统和非神经系统并发症发生率
• 特殊材料的远端迁移
要确定评价患者神经学上终点的度量工具,至少在栓塞术前、术后及以后的随访检查中,用标准的神经系统测试检测所有的病人的以下功能:
• 颅神经
• 感觉功能
• 运动及反射功能
• 步态和协调功能
• 精神活动
提供一份神经系统检查的副本作为临床医师记录结果用的病例报告表,其他评价终点的方法包括:
• 功能量表
• 患者的自我报告
• 临床医师或外科医师的自我报告(世界神经外科医师联盟-WFNS,格拉斯哥预后分级标准-(GOS),格拉斯哥昏迷评分标准(GCS),国家卫生研究院(NIH)卒中量表或巴塞尔指数)
对于任何量表的应用,试验中测试所得的分值应该是病例报告表的一部分,同时应指出量表的正常分值范围。
(2) 栓塞过程描述
在记录中应描述完整的栓塞过程,包括:
• 设备/组件装配和准备
• 抗凝药物的使用
• 抗生素的使用
• 栓塞过程中可能要用到辅助栓塞器械的境况
• 是否有分级栓塞的计划及此计划的特点
• 栓塞过程中遇到中风或其他并发症时,可及时采取的治疗方法
• 如果只是术前栓塞,那么栓塞与切除术间的时间间隔应为多久
另外,如果患者是在局麻下进行神经血管栓塞器械植入术,建议在手术中监测其神经功能情况。
(3) 成像
术前影像学检查是为了更好的治疗需要栓塞术的患者,当评价一个有新的设计特点的栓塞器械时,除了进行术前评价外还要进行术后造影和短期、长期影像学随访检查。
试验中要描述评价病变的方法(如血管造影术,MRI,MRA,CT等)以及随访时间间隔。由于血管疾病性质和具体某种器械的使用可能会决定成像检查时所要选择的成像工具,以及以后随访的最长时间和时间间隔,因此,建议为此提供理论依据和支持性文献或研究。
(4) 患者随访
规定随访期间对患者进行评价检查的频率。
9 标签、说明书
(1) 标签
注册申请应有详细的标签说明以符合《医疗器械说明书、标签和包装标识管理规定》(局令第10号)的要求。
(2) 使用说明书
血管和神经血管栓塞器械的使用说明书中应包括:
• 栓塞器械输送导管的最大和最小内经
• 器械使用时的造影剂和冲洗剂的信息
• 对于可分离式球囊,球囊的爆破压强要求以及最大膨胀压强和体积的出厂质量标准。
参考资料
[1] Guigance for Industry and FDA Staff---Class ⅡSpecial Controls Guidance Document:Vascular and Neurovascular Embolization Devices
[2] 《医疗器械监督管理条例》(国务院令第276号)
[3] 《医疗器械注册管理办法》(局令第16号)
[4] 《医疗器械临床试验规定》
[5] 《医疗器械说明书、标签和包装标识管理规定》(局令第10号)
[6] 医疗器械分类目录
The Guidance Document for Vascular and Neurovascular Embolization Devices
YANG Li-na XI Ting-fei National Insititute for the Control of Pharmaceutical and Biological Products (Beijing 100050)
1006-6586(2010)06-0035-05
R197.39
A
2010-05-04
奚廷斐,研究员,博士生导师,《中国医疗器械信息》杂志编委
