内源性超氧阴离子自由基介导的莱茵衣藻光系统Ⅱ蛋白组分损伤
2010-09-01杜立波姜玉岗陈良兵王广清杜林方
贺 曾,杜立波,姜玉岗,陈良兵,王广清,田 秋,刘 科,杜林方,刘 扬
1.四川大学生命科学学院,生物资源与生态环境教育部重点实验室,成都 610064
2.中国科学院化学研究所,分子动态与稳态结构国家重点实验室,北京 100190
内源性超氧阴离子自由基介导的莱茵衣藻光系统Ⅱ蛋白组分损伤
贺 曾1,杜立波2,姜玉岗2,陈良兵2,王广清2,田 秋2,刘 科1,杜林方1,刘 扬2
1.四川大学生命科学学院,生物资源与生态环境教育部重点实验室,成都 610064
2.中国科学院化学研究所,分子动态与稳态结构国家重点实验室,北京 100190
选取野生型莱茵衣藻CC-125和过氧化氢酶缺失突变体CC-2913为研究对象,采用spin trapping-ESR方法通过光照莱茵衣藻类囊体膜捕获到了O2·-,并且在同样条件下也检测到了来源于O2·-歧化产生的H2O2。另据类囊体膜电泳实验结果:莱茵衣藻在生长过程中添加内源SOD 抑制剂TCNE后,CC-2913类囊体膜光系统蛋白组分的损伤要比野生型CC-125更为严重。通过对上述O2·-与H2O2信号的对比分析可知,虽然O2·-不是造成类囊体膜光系统Ⅱ蛋白组分损伤的直接因素,但它可借助歧化产物H2O2造成光系统蛋白组分的损伤。
莱茵衣藻;蛋白质损伤;超氧阴离子;过氧化氢;类囊体膜
0 引 言
早在上世纪50年代,Mehler曾提出高等植物类囊体膜经光照可产生超氧阴离子自由基(O2·-)[1]。O2·-在高等植物光合作用的活性氧 (reactive oxygen species,ROS) 代谢中具有重要意义,高等植物细胞内的其它ROS往往都是由O2·-歧化或后续衍生而来,如过氧化氢(H2O2)与羟基自由基 (·OH)等[2]。 由于O2·-性质活泼,又极易转化成其它的ROS,使得对其所导致的直接生物学作用仍不甚明了。鉴于此,本实验室在前期研究工作中曾系列报道了高等植物菠菜PSⅡ中O2·-产生的位点、分子机制以及由O2·-或次生H2O2与·OH导致的PSⅡ放氧复合物 (oxygen-evolving complex,OEC)的损伤[3~6]。
另一方面,考虑到莱茵衣藻 (Chlamydomonas reinhardtii)是研究光合作用的模式生物之一,它的光系统结构与高等植物非常相近[7,8],且具有结构简单、生长迅速、生长条件严格可控、易于活体 (in vivo)实验研究且基因组测序已完成等特点[9]。作者等[10]在近期工作中也曾进行有关莱茵衣藻光系统内的超氧阴离子自由基的ESR研究,发现其O2·-表现行为与高等植物菠菜的光系统极其相近。
无论作者前期关于菠菜O2·-、H2O2与·OH损伤OEC的新分子机制探索[6],还是近年来其它有关强光下ROS损伤OEC、D1蛋白或PSII其它蛋白组分的实验研究[11~13],发现缺乏一个普遍适合于活体细胞层面分析ROS对光系统蛋白损伤作用的生物体系。然而,结合近期工作体会,作者发现过氧化氢酶缺失的莱茵衣藻突变体CC-2913是解决这一问题的绝佳材料。为此,本文通过对野生型莱茵衣藻CC-125和过氧化氢酶缺失突变体CC-2913类囊体膜在光照条件下O2·-与H2O2的产生规律,以及相关蛋白组分损伤的对比分析,初步探索了由内源性超氧阴离子自由基介导的光合蛋白组分损伤的规律。
1 材料与方法
1.1 莱茵衣藻的培养
野生型莱茵衣藻CC-125(mating type+)及突变体CC-2913(mating type+)均购自美国杜克大学衣藻研究中心,参照Harris[14]的方法,22℃恒温培养于灭菌的TAP培养液,在20 μmol·m-2·s-1白色光源下、每天按 12 小时光暗周期交替培养。
1.2 莱茵衣藻类囊体膜的制备
类囊体膜的制备参考Selman-Reimer[15]的方法:提取缓冲液为0.33 mol/L D-山梨醇、10 mmol/L Na4P2O7、3 mmol/L MgCl2(pH 6.5)。超声波破碎细胞功率为120 W,每次破碎持续20 s,间隔60 s,共4次。沉淀悬浮于含0.4 mol/L蔗糖、50 mmol/L Mes-NaOH(pH 6.5)、10 mmol/L NaCl的混合液 (SMN溶液)并储存于液氮中。所有步骤均在4℃下避光进行。叶绿素的定量采用Arnon的方法[16]。
1.3 在光照条件下类囊体膜中H2O2的定量检测
过氧化氢电极法测H2O2标准浓度曲线:首先将ISO-HPO-2型过氧化氢电极 (World Precision Instruments,Inc.USA)用pH值6.5的100 mmol/L磷酸盐缓冲液冲洗,并达到稳定状态。配制5 mmol/L H2O2母液,依次向4 ml上述磷酸盐缓冲液中加入H2O2母液8、16、24、32、40 μl,检测不同浓度H2O2的响应电流增加值ΔI(pA),拟合c(H2O2)-ΔI,得线性标准曲线:ΔI(pA)=15.47c(H2O2)(μmol/L)。
用过氧化氢电极检测悬浮于SMN溶液 (pH 6.0)中的类囊体膜 (Chl=0.5 mg/mL)在330 μmol·m-2·s-1光照条件下电流的变化值,再通过与 H2O2浓度标准曲线比对,求出光照条件下实时产生的H2O2量。
1.4 超氧阴离子自由基的ESR测定
在22℃恒温避光条件下,将类囊体膜 (叶绿素浓度调整为0.6 mg/mL)悬浮于含40 mmol/L BMPO的SMN溶液中,将其转移至石英扁平池中,在X波段电子自旋共振仪(Bruker ESP300)光照腔内经He-Ne激光器 (25 mW,663 nm,光斑直径6 mm)光照3 min后,记录捕获自由基的ESR信号。参数设置如下:调制强度0.102 mT,调制频率100 kHz,微波功率12.8 mW,放大倍数1.6×105,扫宽10 mT,扫描时间41.94 s,时间常数0.164 s。 自由基捕获探针BMPO 参照文献[17]方法合成。
1.5 类囊体膜的Urea-SDS-PAGE
电泳参照Laemmli[18]方法,分离胶浓度为15%,浓缩胶浓度为5%,尿素浓度为6 mol/L。类囊体膜样品加入2×样品处理液后,37℃水浴1 h。
2 实验结果
2.1 室温光照条件下电子传递链产生O2·-的spin trapping-ESR检测
为鉴别O2·-与H2O2两类活性氧分子对类囊体膜蛋白的损伤作用,首先需要对比分析野生型莱茵衣藻CC-125和过氧化氢酶缺失突变体CC-2913类囊体膜在光照条件下产生O2·-的规律。
正如图1中ESR实验结果显示,在22℃恒温条件下,将突变体CC-2913的类囊体膜(叶绿素浓度0.6 mg/mL)悬浮于含40 mmol/L自由基捕获探针BMPO的SMN(pH 6.5)溶液中,光照3 min后可得加合物的ESR信号(参见图1B)。该信号实测的波谱超精细耦合常数为:AN=1.36 mT,AH=1.06 mT,与文献[19]中BMPO捕获到超氧阴离子自由基所得ESR信号参数完全一致,可以相互印证;当外加1 mmol/L TCNE到图1B溶液体系后,发现ESR信号强度可增加2.5~3倍左右(图1C)。这一增强效应与作者前文[10]中采用自由基捕获探针DEPMPO分析野生型莱茵衣藻CC-125的PSⅡ光照ESR结论相同。说明TCNE作为类囊体膜PSⅡ中具有内源超氧化物歧化酶(SOD)活性的细胞色素b559(Cyt b559)的抑制剂,能够通过将具有SOD活性的高氧化还原态Cyt b559转变为不具SOD活性的低氧化还原态Cytb559来抑制其内源SOD活性[20],大大增强其ESR信号;对比而言,在暗置条件下未能检测到任何自由基的ESR信号(图1A),说明图1B~C所产生的超氧阴离子自由基皆来源于类囊体膜内光诱导电子传递反应,也验证了Mehler反应的经典观点[1]。
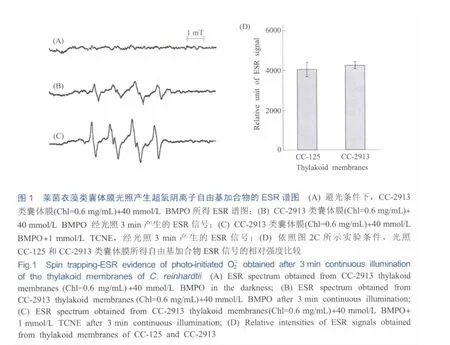
野生型莱茵衣藻CC-125和过氧化氢酶缺失突变体CC-2913类囊体膜在光照条件下产生O2·-信号强度的统计结果对比如图1D所示。虽然在等叶绿素浓度条件下CC-2913的ESR平均信号强度(4,248±180.3)较CC-125(4,054.3±355.7)略高,但t检验未见显著差异。
2.2 莱茵衣藻类囊体膜光照产生H2O2的对比检测
前期,作者对菠菜类囊体膜内PSⅡ实验研究发现光照所产生超氧阴离子自由基可经进一步歧化反应生成过氧化氢,在 3,000 μmol·m-2·s-1光强下照射 10 min,经 O2·-岐化产生H2O2的浓度可达 2.5 μmol H2O2·mg·Chl-1[6]。但考虑到 Mehler反应位点还可能发生在 PSⅠ,因而不能排除其它H2O2产生途径。
在上节实验中发现光照野生型莱茵衣藻CC-125与过氧化氢酶缺失突变体CC-2913的类囊体膜所产生的超氧阴离子信号强度基本一致。那么经此(PSⅡ内由TCNE调控Cytb559途径)O2·-歧化后产生H2O2的反应规律会如何呢?为解答这一疑问,作者直接采用过氧化氢电极实测在相同He-Ne激光(25 mW,663 nm)照射条件下,CC-125与CC-2913的类囊体膜产生的H2O2浓度。

图2 过氧化氢电极检测CC-2913和CC-125类囊体膜光照产生的H2O2Fig.2 Direct detection of H2O2generated in thylakoid membranes ofCC-2913 and CC-125 under continuous illumination by hydrogen peroxide sensor(ISO-HPO-2)
如图2所示,对野生型莱茵衣藻CC-125与过氧化氢酶缺失突变体CC-2913光照类囊体膜产生的H2O2浓度都远低于菠菜PSⅡ中的结果,其原因可解释为类囊体膜远比PSⅡ颗粒的抗氧化防护体系完整,对H2O2的内源性清除能力也更强。然而,当TCNE加入后由O2·-歧化介导的H2O2信号明显增加3倍左右。更为有趣的是,此时过氧化氢酶缺失莱茵衣藻突变体CC-2913比野生型CC-125所产生的H2O2也显著增强,说明CC-2913类囊体膜内内源过氧化氢酶(CAT)活性比CC-125更低。此外,一旦外源性CAT(终浓度100 U/mL)加入CC-125/TCNE或CC-2913/TCNE光照溶液中,可见光照产生的信号陡然消失。这进一步确凿证明电流信号的记录恰好反映H2O2浓度变化。
2.3 内源性介导的光合系统蛋白组分损伤
突变体CC-2913缺乏过氧化氢酶,导致其细胞内有较高浓度的过氧化氢。如果此时增加内源性活性氧,很可能会对CC-2913细胞内光合蛋白组分产生更大程度的损害。为检验这一效应,实验采用内源SOD抑制剂TCNE(终浓度为1 mmol/L)分别处理CC-125和CC-2913,在 50 μmol·m-2·s-1光照条件下培养 24 h 后,再依照 Selman-Reimer[15]方法提取出类囊体膜。最后分别对125、125+TCNE、2913、2913+TCNE光照培养提取物 (类囊体膜)进行Urea-SDS-PAGE,电泳结果见图3。

图3 类囊体膜的Urea-SDS-PAGE 泳道125:未经1 mmol/L TCNE处理的CC-125活体细胞提取的类囊体膜;泳道125+TCNE:经过1 mmol/L TCNE处理24 h的CC-125活体细胞提取的类囊体膜;泳道2913:未经1 mmol/L TCNE处理的CC-2913活体细胞提取的类囊体膜;泳道2913+TCNE:经1 mmol/L TCNE处理24 h的CC-2913活体细胞提取的类囊体膜;每个泳道的蛋白上样量为71.3 μg。泳道M:蛋白质分子量标准。Urea-SDS-PAGE的分离胶浓度为15%,浓缩胶浓度为5%,电泳后利用考马斯亮蓝进行凝胶的染色。类囊体膜主要的蛋白组分名称标注于凝胶左侧Fig.3 Urea-SDS-PAGE of thylakoid membranes Lane 125:Thylakoid membrane prepared from CC-125 cells without TCNE treatment;Lane 125+TCNE:Thylakoid membrane prepared from CC-125 cells treated with TCNE;Lane 2913:Thylakoid membrane prepared from CC-2913 cells without TCNE treatment;Lane 2913+TCNE:Thylakoid membrane prepared from CC-2913 cells treated with TCNE;Lane M:Protein molecular weight marker(Fermentas).Urea-SDS-PAGE was performed in a 15%(w/v)gel,after electrophoresis finished the gel was stained by coomassie brilliant blue.The major component of thylakoid membrane are marked at the left side of the gel
电泳结果显示,未添加TCNE条件下,CC-125与CC-2913的类囊体膜的电泳条带无显著差异。这表明此环境下二者的氧化应激水平都很低或发生自行修复,致使CC-2913和CC-125所受氧化损伤水平相差不大;对比而言,无论突变体CC-2913还是野生型CC-125细胞,经1 mmol/L TCNE处理后所提取的类囊体膜蛋白中的特定蛋白条带颜色会减弱。蛋白条带减弱现象主要发生在功能蛋白组分 (如放氧复合体蛋白),尤其对分子量25 kD以下的小分子量蛋白降解尤为明显;而结构蛋白受损情况相对较轻。此外,经过TCNE处理的突变体CC-2913细胞比TCNE处理过的野生型CC-125细胞所提取的类囊体膜蛋白损伤更为严重。例如:放氧复合物OEC 23 kD和OEC 17 kD蛋白降解和脱落最为严重,对应的电泳条带已经无法辨认,显示经TCNE处理后的CC-2913细胞中OEC成为自由基攻击的首要位点,这与文献报道的ROS首先造成光合系统OEC破坏的结论完全一致[11];又如通常用作高等植物光系统ROS损伤标志物的D1蛋白,经TCNE处理过后的CC-2913比CC-125样品在条带颜色上有所减弱。在莱茵衣藻细胞中,过氧化氢酶是最主要的H2O2清除酶[21]。而CC-2913缺乏过氧化氢酶,因而使得TCNE引发的H2O2损伤更为严重。遗憾的是,由于SDS-PAGE凝胶电泳分辨率有限,所得类囊体膜的D1蛋白条带不甚清晰,难以对降解情况进行更加准确的描述。这有待后续的western-blot实验进一步阐述D1蛋白的受损情况。
3 讨 论
无论高等植物还是莱茵衣藻,其光合系统经强光照射都可发生光系统功能的抑制,并且光抑制往往与ROS产生密切相关。人们最早认识的ROS诱导的光系统抑制与损伤都与单线态氧有关。单线态氧活性极高,极易造成光系统蛋白的降解与修饰[22~24];单线态氧可在PSⅡ受体侧电子传递链上获得泄漏的电子而产生超氧阴离子自由基,虽然O2·-活性也相当强,但它较单线态氧的破坏能力减弱很多[4,23,25,26],尽管如此,文献中仍有人认为O2·-也会损伤光系统蛋白[27];O2·-的另一个特点是易岐化产生H2O2,而后者虽然性质较O2·-更稳定,但对光系统蛋白的直接或间接修饰与破坏作用可能会更强[23,28]。
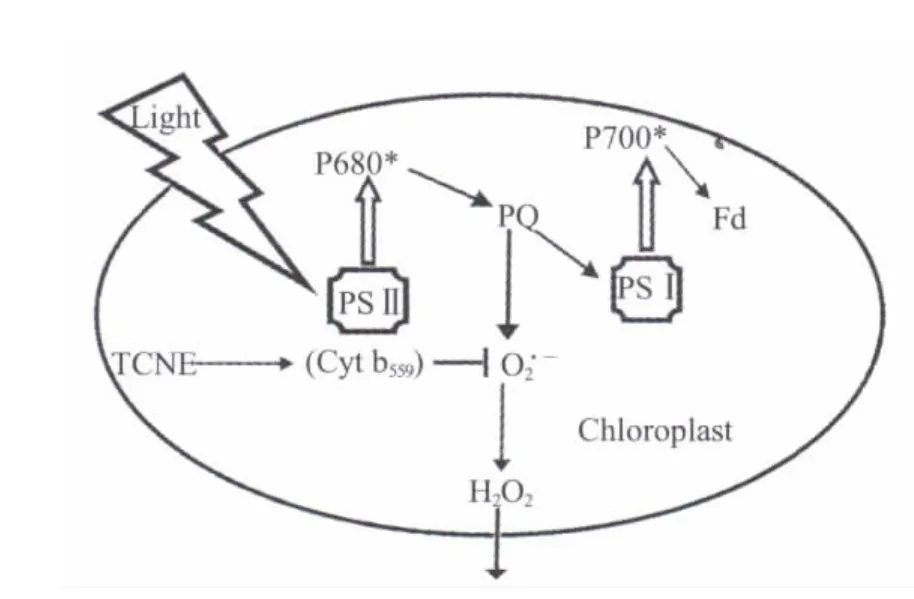
图4 衣藻叶绿体内TCNE引发的内源性超氧阴离子与过氧化氢产生示意图Fig.4 Endogenous superoxide anion and hydrogen peroxide mediated byTCNE in chloroplast ofChlamydomonas reinhardtii
本工作通过对野生型莱茵衣藻CC-125和过氧化氢酶缺失突变体CC-2913的对比研究发现:虽然两者在PSⅡ受体侧电子漏产生超氧阴离子自由基的数量没有显著性差别,但由于突变体CC-2913内缺乏过氧化氢酶活性导致生成更多的H2O2。进一步的SDS-PAGE电泳实验明确显示:由光诱导产物O2·-歧化生成的H2O2正是破坏光系统功能蛋白组分的罪魁祸首,如D1、OEC 23 kD与OEC 17 kD蛋白等。尽管文献中多数认为H2O2比O2·-对PSⅡ破坏作用更占主导地位[11,12,26],但进一步参照作者关于ROS介导的PSⅡ放氧功能抑制的分子机制研究[6]和本实验结果,可以做出一致性的合理解释:正是由于H2O2比O2·-相对性质稳定,且在膜结构的叶绿体内更易于扩散与输运,所以它(或者伴随产生的·OH自由基)对D1与OEC蛋白的破坏作用更为直接。换言之,产生于类囊体膜基质(Stroma)一侧的O2·-之自身性质使得它对PSⅡ蛋白的破坏力较弱,但它可通过歧化产物H2O2间接破坏类囊体膜另一侧(Lumen)的D1与OEC蛋白。
参考文献:
1. Mehler AH.Studies on reactions of illuminated chloroplasts.I.Mechanism of thereduction of oxygen and other Hill reagents.Arch Biochem Biophys,1951,33:650~677
2. Asada K.Production and action of active oxygen species in photosynthetic tissues.In:Foyer CH,Mullineaux PM,eds.Causes of photooxidative stress and amelioration of defense systems in plants.Boca Raton FL:CRC Press,1994.77~104
3.刘 科,孙 健,刘 扬,张启元,匡廷云.高等植物光系统II中强光照射产生超氧阴离子自由基的ESR探索.生物化学与生物物理进展,2001,28(3):372~376 Liu K,Sun J,Liu Y,Zhang QY,Kuang TY.ESR Studies on the Superoxide Radicals Generated in Photosystem Ⅱof Higher Plant. Prog Biochem Biophys,2001,28(3):372~376
4.Sun J,Song YG,Liu B,Xu YK,Zhang SX,Tian Q,Liu Y.Superoxide,hydrogen peroxide and hydroxylradicalin D1/D2/cytochrome b-559 photosystem IIreaction center complex.Photosynth Res,2004,81:41~47
5.孙 健,刘 科,徐英凯,陈中伟,刘 扬.类囊体膜光系统II中超氧阴离子生成机制的研究.高等学校化学学报,2002,23(5):979~981 Sun J,Liu K,Xu YK,Chen ZW,Liu Y.Studieson superoxide formation in photosystem II with a novel spin trap. Chemical Journal of Chinese Universities,2002,23(5):979~981
6. Song YG,Liu B,Wang LF,Li MH,Liu Y.Damage oxygen-evolving complex by superoxide anion,hydrogen peroxide and hydroxyl radicals in photoinhibition of photosystem II.Photosynth Res,2006,90:67~78
7. de Vitry C,Vallon O.Mutants of chlamydomonas:tools to study thylakoid membrane structure,function and biogenesis.Biochimie,1999,81:631~643
8.Minagawa J,Takahashi Y.Structure,function and assembly of Photosystem II and its light-harvesting proteins.Photosynth Res,2004,82:241~263
9.Merchant SS,Prochnik SE,Vallon O.The Chlamydomonas genome reveals the evolution of key animal and plant functions.Science,2007,318(245):245~251
10.袁 翰,韩 璐,杜立波,田 秋,刘 科,杜林方,刘 扬.单细胞光合生物莱茵衣藻光系统II产生超氧阴离子自由基的ESR研究.生物化学与生物物理进展,2008,35(9):1065~1069 Yuan H,Han L,Du LB,Tian Q,Liu K,Du LF,Liu Y.Spin trapping-ESR studies on the superoxide anion radical generated in photosystem IIof unicellular green alga chlamydomonas reinhardtii.Prog Biochem Biophys,2008,35(9):1065~1069
11.Henmi T,Miyao M,Yamamoto Y.Release and reactiveoxygen-mediated damageof theoxygen-evolving complex subunits of PSII during photoinhibition.Plant Cell Physiol,2004,45(2):243~250
12. Pospíšil P. Production of reactive oxygen species by photosystem II.Biochimica et Biophysica Acta,2009,1787:1151~1160
13.Miyao M,Ikeuchi M,Yamamoto N,Ono TA.Specific degradation of the D1 protein of photosystem II by treatment with hydrogen peroxide in darkness:implications for the mechanism of degradation of the D1 protein under illumination.Biochemistry,1995,34:10019~10026
14.Harris EH.The Chlamydomonas sourcebook.New York:Academic Press,1989
15.Selman-Reimer S,Merchant S,Selman BR.Isolation,purification and characterization of coupling factor 1 from Chlamydomonas reinhardtii.Biochemistry,1981,20:5476~5482
16. Arnon DI. Copperenzymes in isolated chloroplasts.Polyphenoloxidase in Beta vulgaris.Plant Physiol,1949,24(1):1~15
17. Tsai P,IchikawaK,Mailer C,PouS,Halpern HJ,Robinson BH,Nielsen R,Rosen GM.Esters of 5-carboxyl-5-methyl-1-pyrroline N-oxide:a family of spin traps for superoxide.J Org Chem,2003,68:7811~7817
18.Laemmli UK. Cleavageof structural protein during the assembly of the head of bacteriophage T4.Nature,1970,227:680~685
19.Klaus S,Natascha RU,Thomas R,Hofinger A,Kolarich D,Nohl H.Spin trapping of C-and O-centered radicals with methyl-,ethyl-,pentyl- and phenyl-substituted EMPO derivatives.Bioorg Med Chem,2006,14:3368~3376
20.Nugent JHA.Photoreducible high spin iron electron paramagnetic resonance signals in dark-adapted photosystem II:are they oxidised nonhaem iron formed from interaction of oxygen with PS II electron acceptors? Biochem BiophysActa,2001,1504:288~298
21.Takeda T,Ishikawa T,Shigeoka S.Metabolism of hydrogen peroxide by the scavenging system in Chlamydomonas reinhardtii.Physiol Plantarum,1997,99:49~55
22.Mishran P,Francke C,Vangorkom HJ,Ghanotakis DF.Destructive role of singlet oxygen during aerobic illumination of the photosystem II core complex.Biochem Biophys Acta,1994,1186(2):81~90
23.Bhattacharjee S.Reactiveoxygen speciesand oxidative burst:roles in stress,senscence and signal transduction in plants.Curr Sci,2005,89:1113~1121
24.王 强,温晓刚,张其德.光合作用光抑制的研究进展.植物学通报,2003,20:539-548 Wang Q,Wen XG,Zhang QD.Progress in studies on photoinhibition. Chinese Bulletin of Botany,2003,20:539~548
25.Lupínková L,Komenda J.Oxidative modifications of the photosystemII D1 protein by reactive oxygen species:from isolated protein to cyanobacterial cells.Photochemistry and Photobiology,2004,79(2):152~162
26.David KJA.Protein damage and degradation by oxygen radicalsI. General aspects. JBio Chem,1987,262:9895~9901
27.Kim JH,Lee CH.In vivodeleterious effects specific to reactive oxygen species on photosystem I and II after photo-oxidative treatments of rice(Oryza sativa L.)leaves.Plant Science,168(2005):1115~1125
28.Dat J,van Breusegerm,Vandenabeele S,Montagu MV,Inze D,Breusegerm FV. Active oxygen species and catalese during plant stress response.Cell Mol Life Sci,2000,57:779~786
This work was supported by a grant from The National Natural Science Foundation of China(20875093)
Damages to PSⅡComponent Proteins by Endogenous Superoxide Anion Radicals in Chlamydomonas reinhardtii
HE Zeng1,DU Libo2,JIANG Yugang2,CHEN Liangbing2,WANG Guangqing2,TIAN Qiu2,LIU Ke1,DU Linfang1,LIU Yang2
1.Key Laboratory of Bio-resources and Eco-environment,The Ministry of Education,College of Life Science,Sichuan University,Chengdu 610064,China;
2.State Key Laboratory for Structural Chemistry of Unstable and Stable Species,Institute of Chemistry,The Chinese Academy of Science,Beijing 100190,China
Mar 2,2010 Accepted:Mar 18,2010
LIU Yang,Tel:+86(10)62571074,E-mail:yliu@iccas.ac.cn;LIU Ke,Tel:+86(28)85415008,E-mail:liuke98@yahoo.com
Photoinitiated superoxide anion radical(O2·-)has been examined in thylakoid membranes isolated from Chlamydomonas reinhardtiiwild-type strains CC-125 and catalase-deficient mutant CC-2913,by spin trapping-ESR.Concentration of hydrogen peroxide(H2O2),produced from disproportionation of O2·-,was monitored by hydrogen peroxide sensor(ISO-HPO-2)under identical conditions.Urea-SDS-PAGE of thylakoid membranes further demonstrated that upon the addition of intrinsic SOD inhibitor tetracyanethylen(TCNE),ROS caused more damage to PSII components of CC-2913 than that of wild-type CC-125.It is concluded by comparing H2O2and O2·-,that although the original O2·-didn't directly cause damage to PSII components,the subsequently produced H2O2could trigger obvious damage to the PSII component proteins.
Chlamydomonasreinhardtii; Protein damage; Superoxide; Hydrogen peroxide; Thylakoid membranes
2010-03-02;接受日期:2010-03-18
国家自然科学基金项目(20875093)
刘扬,电话:(010)62571074,E-mail:yliu@iccas.ac.cn;
刘科,电话:(028)85415008,E-mail:liuke98@yahoo.com
Q947
猜你喜欢
杂志排行
Biophysics Reports的其它文章
- 咖啡酸苯乙酯衍生物抑制红细胞溶血和HL-60细胞增殖活性的构效关系研究
- 电子顺磁共振测量蛋白质分子内选定位点之间距离的方法及应用
- Hypertensive Nephropathy Treatment by Atorvastatin
——A Study of Anti-Inflammation Therapy for Target Organ Damage of Hypertension - 香青兰总黄酮对大鼠离体胸主动脉的舒张作用
- Induction of Apoptosis in HL60 Cells by Selenosulfate
——Cytotoxicity of Selenium Anion - 众志成城