咖啡酸苯乙酯衍生物抑制红细胞溶血和HL-60细胞增殖活性的构效关系研究
2010-09-01钱益平曹小燕
钱益平,王 琪,曹小燕,周 波
兰州大学功能有机分子化学国家重点实验室,甘肃兰州 730000
咖啡酸苯乙酯衍生物抑制红细胞溶血和HL-60细胞增殖活性的构效关系研究
钱益平,王 琪,曹小燕,周 波
兰州大学功能有机分子化学国家重点实验室,甘肃兰州 730000
蜂胶中的主要成分咖啡酸苯乙酯作为重要的抗氧化剂和癌预防试剂分子,引起了人们相当的兴趣。为了研究其构效关系,作者通过酰基化反应合成了6个咖啡酸苯乙酯衍生物,即:咖啡酸苯乙酯(caffeic acid phenethyl ester,CAPE)、 芥子酸苯乙酯(sinapic acid phenethyl ester,SAPE)、阿魏酸苯乙酯(ferulic acid phenethyl ester,FAPE)、4-羟基肉桂酸苯乙酯(4-hydroxycinnamic acid phenethyl ester,4-HCAPE)、3,5-二羟基肉桂酸苯乙酯(3,5-dihydroxycinnamic acid phenethyl ester,3,5-DHCAPE) 和3-羟基肉桂酸苯乙酯(3-hydroxycinnamic acid phenethyl este,3-HCAPE)。以水溶性偶氮引发剂2,2’-偶氮二(2-脒基丙烷)二盐酸盐诱导的红细胞溶血为模型,研究了它们的抗氧化活性。根据实验测得的有效抑制溶血时间,其活性顺序为:CAPE≈4-HCAPE>SAPE>FAPE>3,5-DHCAPE>3-HCAPE。其活性显著依赖于化合物的结构(羟基的数目和位置)和亲酯性。具有邻二羟基结构的CAPE和4位羟基取代的4-HCAPE具有最高的抗氧化活性。此外,它们抑制人早幼粒白血病细胞株HL-60增殖活性也通过噻唑蓝的方法评价。有趣的是,CAPE和4-HCAPE也同样具有抑制HL-60细胞增殖活性的最好能力。这些结果提供了一种基于生物抗氧化剂的癌预防药物分子设计思路。
咖啡酸苯乙酯;抗氧化剂;构效关系;红细胞;癌预防试剂
0 引 言
体内自由基的过量产生(氧化应激,Oxidative stress)可以引起细胞膜脂质、DNA和蛋白质分子的氧化性损伤,导致癌症[1,2]、衰老[3]和神经退行性疾病[4]。大量的流行病学证据表明,果蔬类和饮料等食品的摄入能降低许多慢性疾病,特别是癌症的发生率[5~10]。按照自由基生物学和医学的理论,这是因为果蔬类和饮料等食品中富含的生物抗氧化剂能够清除过量产生的自由基,抑制和修复自由基对细胞膜脂质、DNA和蛋白质分子的氧化性损伤,维持体内的氧化还原平衡,因此可预防和治疗这些疾病[11]。
享有“紫色黄金”美誉的食品——蜂胶,是蜜蜂采集植物树脂经过咀嚼加工而成的一种具有芳香气味的胶状固体物,含有数百种化学成分。其中咖啡酸苯乙酯(caffeic acidphenethyl ester,CAPE)是蜂胶中的主要活性成分,在抗肿瘤[12]、抗氧化[13]、抗炎症[14]和免疫调节[15]等方面具有重要的生物活性。它作为抗氧化药物和癌预防药物研究的明星分子,受到了人们极大的关注[12,13,16~19]。为了评价CAPE在抗氧化和癌预防活性方面的构效关系,并作为系统研究生物抗氧化剂作用机制的一部分[20~24],我们通过酰基化反应合成了6个咖啡酸苯乙酯衍生物,即:咖啡酸苯乙酯(CAPE)、阿魏酸苯乙酯(ferulic acid phenethyl ester,FAPE)、4-羟基肉桂酸苯乙酯(4-hydroxycinnamic acid phenethyl ester,4-HCAPE)、芥子酸苯乙酯(sinapic acid phenethyl ester,SAPE)、3,5-二羟基肉桂酸苯乙酯(3,5-dihydroxycinnamicacidphenethylester,3,5-DHCAPE)和 3-羟基肉桂酸苯乙酯(3-hydroxycinnamic acid phenethyl ester,3-HCAPE)(图 1)。

红细胞膜富含不饱和脂肪酸,这些不饱和脂肪酸对自由基诱导的脂质过氧化非常敏感,最终导致溶血的发生。此外,红细胞膜是一种异相介质和简单的代谢模型,通常被用于评价具有不同亲酯能力的抗氧化剂分子的活性[25]。因此,本文采用水溶性的偶氮化合物2,2′-偶氮二(2-脒基丙烷)二盐酸盐(2,2′-azobis(2-amidinopropane)hydrochloride,AAPH)作为自由基引发剂,以其在生理温度下诱导的红细胞溶血为模型,评价6个咖啡酸苯乙酯衍生物的抗氧化活性。同时,它们抑制人早幼粒白血病细胞株HL-60增殖活性的能力也通过噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)的方法评价[26]。
1 材料与方法
1.1 材料
咖啡酸苯乙酯衍生物按文献[13,14]报道的方法合成。首先将自制的酚酸(1 mmol)与过量的 SOCl2(3 equiv)在无水1,4-二氧六环溶液(10 ml)中回流3~4 h,使酚酸转化成酰氯,再在室温下滴加苯乙醇(2 mmol),继续回流3~4 h。反应进程通过薄层层析(thin-layer chromatography,TLC)监测。反应完全后,减压除去溶剂,残留物通过硅胶色谱柱分离。得到的咖啡酸苯乙酯及其类似物的结构和纯度分别经1H、13C NMR和HPLC鉴定,其结构如图1所示。AAPH和MTT购自Sigma-Aldrich公司,直接使用。RPMI 1640培养基购自GIBCO公司,小牛血清购自杭州四季青公司,人早幼粒白血病细胞株HL-60购自中科院上海生物化学与细胞生物学研究所。
1.2 人红细胞的分离
人红细胞悬浮液购自甘肃省中心血站。首先,将悬浮的红细胞2,000 r/min离心10 min,除去上层溶液和黄色的血沉淀,加入含有137 mmol/L NaCl、2.7 mmol/L KCl、8.1 mmol/L Na2HPO4·12H2O和1.5 mmol/L KH2PO4的磷酸盐缓冲液(PBS,pH=7.4),以2,000 r/min离心10 min,重复洗涤3次,最后一次洗涤时严格控制离心机的转速为2,000 r/min以得到相同紧密度的红细胞。
1.3 抑制AAPH诱导的红细胞溶血测定
将红细胞加入pH=7.4的PBS中配成浓度为5%的红细胞悬浮液,于37℃温育5 min,然后加入50 mmol/L AAPH水溶液引发溶血,温育期间反应混合液在水浴摇床上轻轻摇动。溶血程度按文献[23]的方法通过分光光度法测定。在适当的时间间隔取出适量的反应混合液,用0.15 mol/L NaCl稀释,以2,000 r/min的转速离心10 min将红细胞分离,取上层清液在紫外可见分光光度计上、波长540 nm处测其吸光值A;同样地,取出适量的反应混合液,用蒸馏水稀释,使红细胞完全溶血,同样条件下离心后在540 nm处测其吸光值B;百分溶血度等于(A/B)×100。在抗氧化实验中抗氧化剂咖啡酸苯乙酯衍生物通过二甲基亚砜(dimethyl sulfoxide,DMSO)引入,在AAPH加入以前先行加入并且温育。每次实验至少重复3次,实验误差在10%以内。
1.4 抑制HL-60细胞增殖活性
将HL-60细胞用RPM11640培养基 〔含10% 灭活小牛血清(FCS),2 mmol/L谷氨酞胺,100 IU/L青霉素和链霉素〕在37℃、5%CO2培养箱中进行培养。
取对数生长期的HL-60细胞,以5×104个/mL的密度接种于96孔培养板中,每孔90 μl,然后加入10 μl不同浓度的药物,浓度平行三个孔(总体积100 μl)。药物通过DMSO溶解引入(DMSO终浓度小于0.1%)。培养48 h之后,每孔加10 μl的MTT溶液(5 mg/mL在PBS中),继续培养4 h后,培养板以1200×g离心15 min。弃上清,加150 μl DMSO,震荡10 min后在酶联免疫测定仪(Bio-Rad 550,USA)490 nm处测定光密度(OD)。细胞存活率按以下公式计算:存活率(%)=(空白对照OD-药物组OD)/空白对照OD×100。
1.5 CLogP的计算
咖啡酸苯乙酯衍生物在辛醇-水中的分配系数(Coefficient LogP,CLogP)使用Bio-Loom软件(Biobyte Corp.version 5)计算[27,28]。
2 结果与讨论
2.1 咖啡酸苯乙酯衍生物抑制AAPH诱导的红细胞氧化性溶血
图2所示为在空气中AAPH诱导的红细胞溶血及CAPE的抗溶血活性。在不加AAPH的情况下,红细胞是稳定的,4 h之内基本没有溶血发生(图2,a线)。加入50 mmol/L AAPH,经过一定的抑制期(100 min)后,红细胞才开始快速溶血(图2,b线)。这个抑制期应该是由红细胞本身所含有的内源性生物抗氧化剂,如维生素E和泛氢醌-10[20]所造成的。将CAPE加入到红细胞中会明显增加红细胞的固有抑制期(tinh)。 其抑制期依赖于CAPE的浓度(图2)。如使用10 μmol/L的CAPE时,测得的抑制期分别为192 min(图2,e线),即它使红细胞固有的抑制期延长了92 min(有效抑制溶血时间,teff)。图3显示了10 μmol/L的咖啡酸苯乙酯衍生物抑制红细胞溶血的作用。其teff显著依赖于化合物的结构。根据teff(表1),抗溶血活性的顺序为CAPE≈4-HCAPE>SAPE>FAPE>3,5-DHCAPE>3-HCAPE。值的注意的是,尽管4-OH的衍生物(4-HCAPE)产生的teff与CAPE类似,但其抑制期后的红细胞溶血速率比CAPE快(图3中的b和c线)。这证实了CAPE在所有化合物中是活性最高的。另一方面,CAPE抑制溶血的速率在抑制期后要比红细胞本身的溶血速率慢得多,暗示着CAPE的氧化产物也具有抗氧化作用。
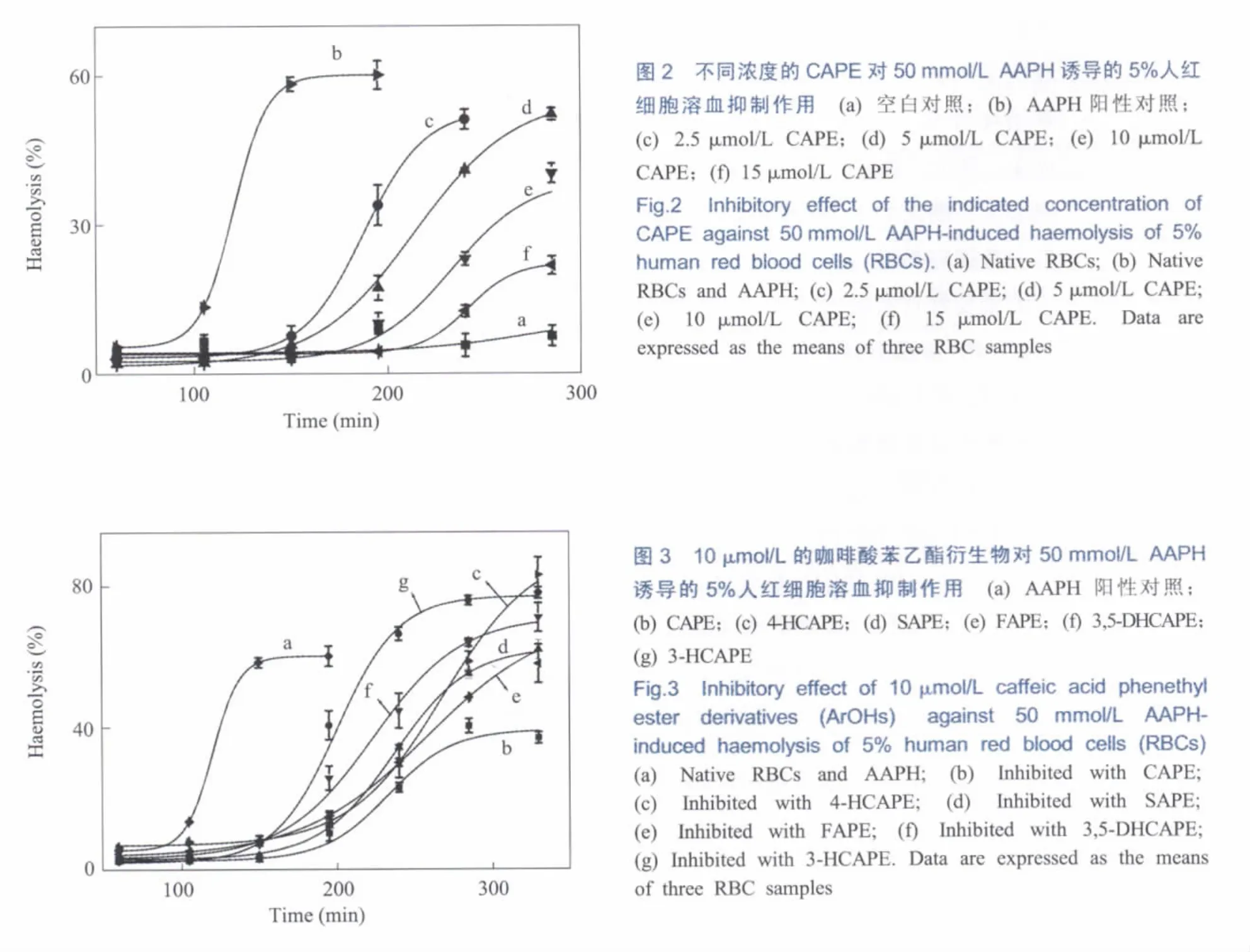

表1 咖啡酸苯乙酯衍生物的抗溶血活性和抑制HL-60细胞增殖活性Table 1 Anti-haemolysis activity and antiproliferative activity against HL-60 cells of caffeic acid phenethyl ester derivatives(ArOHs)
从上述实验结果可知,具有邻二羟基和邻羟基甲氧基结构的CAPE、SAPE和FAPE显示出比3,5-DHCAPE和3-HCAPE更强的抗氧化活性。众所皆知,酚类化合物的抗氧化活性取决于羟基中O-H键的键能[29]。因此,它们活性较好的原因应为在4-OH邻位引入推电子基团-OH和-OCH3,从而降低O-H键的键能[29]。这一结论已被光谱测定[30]和理论计算[29]所证实。理论计算表明:邻羟基酚氧自由基的O-H键键能比其母体分子邻苯二酚强4 kcal/mol,而邻苯二酚的O-H键能比苯酚和间苯二酚分别低9.1和8.8 kcal/mol[29]。此外,邻羟基酚氧自由基很容易进一步氧化生成邻醌[24]。类似的邻二羟基和邻羟基甲氧基结构在抗氧化活性中的重要性在黄酮醇[21]、姜黄素[22]和白藜芦醇类似物[24]中也被证实。值得注意的是,尽管4-HCAPE的O-H键能高于SAPE和FAPE的O-H键能[29],但其活性优于邻羟基甲氧基结构的SAPE和FAPE,这暗示着化合物的亲脂性可能是影响抗氧化剂活性的另一个重要因素。在异相介质红细胞中,亲脂性体现了化合物穿透膜的能力,从而有利于捕获链增长自由基和延长化合物的teff。因此我们使用Bio-Loom软件[27,28]计算了这些化合物在辛醇-水中的分配系数CLogP(表1)。结果显示:4-HCAPE和3-HCAPE具有最高的亲脂性(CLogP=3.9)。因此,4-HCAPE强的抗氧化活性可能与其高的亲脂能力相关。尽管3-HCAPE也具有高的亲脂能力,但在红细胞溶血实验中呈现较弱的抗氧化活性,这可能是由于其3-OH键能高于4-HCAPE中的4-OH键能。以上结果证实:在异相介质红细胞中,O-H键能和亲脂性是影响化合物抗氧化活性的重要因素。
2.2 咖啡酸苯乙酯衍生物抑制HL-60细胞增殖活性
进一步地,咖啡酸苯乙酯衍生物抑制HL-60细胞增殖活性也通过MTT的方法测定。结果采用抑制HL-60细胞增殖50%所需化合物的浓度(IC50)值表示(表1)。其中,CAPE的IC50值为14.6 μmol/L,活性最高。根据IC50值,它们的活性顺序为CAPE>4-HCAPE>SAPE≈FAPE≈3,5-DHCAPE>3-HCAPE。这个活性顺序类似于溶血中的活性顺序。有趣的是,在溶血试验中具有最高抗氧化活性的CAPE和4-HCAPE,也同样具有最好的抑制HL-60细胞增殖活性。这种相关性也暗示着简单的红细胞溶血模型的重要性,以及一种基于抗氧化剂的癌预防药物分子设计策略。
3 结 论
总之,我们合成了6个具有不同结构的咖啡酸苯乙酯衍生物,并且评价了它们的抗氧化和抗增殖活性。在两个实验中,CAPE和4-HCAPE均呈现最好的活性。此外,抗氧化活性和抗增殖活性的相关性也给我们提供了一种从抗氧化剂的角度设计癌预防药物分子的思路。
1.PerwezHS,Hofseth LJ,HarrisCC. Radical cause of cancer.Nat Rev Cancer,2003,3:276~285
2.Klaunig JE,Kamendulis LM.The role of oxidative stress in carcinogenesis.Annu Rev Pharmacol Toxicol,2004,44:239~267
3. Finkel T,Holbrook NJ.Oxidants,oxidative stress and the biology of ageing.Nature,2000,408:239-247
4. Kevin JB,Colin L,Ashley IB.Neurodegenerative diseases and oxidative stress. Nat Rev Drug Discov,2004,3:205~214
5. Chung SY,Xin W,Gang L,Sonia CP.Cancer prevention by tea:animal studies,molecular mechanisms and human relevance.Nat Rev Cancer,2009,9:429~439
6. Alan C,Jaganath IB,Clifford MN. Dietary phenolics:chemistry,bioavailability and effects on health.Nat Prod Rep,2009,26:1001~1043
7. Pan MH,Ho CT. Chemopreventive effects of natural dietary compoundson cancerdevelopment. Chem Soc Rev,2008,37:2558~2574
8.Pan MH,Ghai G,Ho CT.Food bioactives,apoptosis,and cancer.Mol Nutr Food Res,2008,52:43~52
9. Sonia R. Cancerchemoprevention and chemotherapy:dietary polyphenols and signalling pathways.Mol Nutr Food Res,2008,52:507~526
10.Milner JA.Nutrition and cancer:essential elements for a roadmap.Cancer Lett,2008,269:189~198
11.Rice-Evans CA,Diplock AT.Current status of antioxidant therapy.Free Radic Biol Med,1993,15:77~96
12.Watabe M,Hishikawa K,Takayanagi A,Shimizu N,Nakaki T. Caffeic acid phenethylesterinduces apoptosis by inhibition of NF-κB and activation of Fas in human breast cancer MCF-7 cells.J Biol Chem,2004,279:6017~6026
13.Jayaprakasam B,Vanisree M,Zhang Y,Dewitt DL,Nair MG.Impact of alkyl esters of caffeic and ferulic acids on tumor cell proliferation,cyclooxygenase enzyme,and lipid peroxidation.J Agric Food Chem,2006,54:5375~5381
14.Uwai K,Osanai Y,Imaizumi T,Kanno SI,Takeshita M,Ishikawa M. Inhibitory effect of the alkyl side chain of caffeic acid analogues on lipopolysaccharide-induced nitric oxide production in RAW264.7 macrophages.Bioorg Med Chem,2008,16:7795~7803
15. NatarajanK,Singh S,Burhe Jr TR,Grunberger D,Aggarwal BB.Caffeic acid phenethyl ester is a potent and specific inhibitor of activation of nuclear transcription factor NκB.Proc Natl Acad Sci USA,1996,93:9090-9095
16.Huang MT,Ma W,Yen P,Xie JG,Han Jk,Frenkel K,Grunberger D,Conney AH.Inhibitory effects of caffeic acid phenethyl ester(CAPE) on 12-o-tetradecanoylphorbol-13-acetate-induced tumor promotion in mouse skin and the synthesis ofDNA,RNA and protein in HeLa cells.Carcinogenesis,1996,17:761~765
17.Weyant MJ,Carothers AM,Bertagnolli ME,Bertagnolli MM.Colon cancerchemopreventive drugs modulate integrinmediated signaling pathways.Clin Cancer Res,2000,6:949~956
18.Chung TW,Moon SK,Chang YC,Ko JH,Lee YC,Cho G,Kim SH,Kim JG,Kim CH.Novel and therapeutic effect caffeic acid and caffeic acid phenyl ester on hepatocarcinoma cells:complete regression of hepatoma growth and metastasisby dual mechanism. FASEB J,2004,18:1670~1681
19.Jung JE,Kim HS,Lee CS,Park DaH,Kim YN,Lee MJ,Lee JW,Park JW,Kim MS,Ye SK,Chung MH.Caffeic acid and itssynthetic derivative CADPE suppresstumor angiogenesis by blocking STAT3-mediated VEGF expression in human renal carcinoma cells.Carcinogenesis,2007,28:1780~1787
20.Deng SL,Chen WF,Zhou B,Yang L,Liu ZL.Protective effects of curcumin and its analogues against free radical-induced oxidativehaemolysisof human red blood cells.Food Chem,2006,98:112~119
21.Zhou B,Miao Q,Yang L,Liu ZL.Antioxidative effects offlavonols and their glycosides against the free-radicalinduced peroxidation of linoleic acid in solution and in micelles.Chem Eur J,2005,11:680~691
22.Chen WF,Deng SL,Zhou B,Yang L,Liu ZL.Curcumin and its analogues as potentinhibitors oflow density lipoprotein oxidation:H-atom abstraction from the phenolic groups and possible involvement of the 4-hydroxy-3-methoxyphenyl groups.Free Radic Biol Med,2006,40:526~535
23.Shang YJ,Jin XL,Shang XL,Tang JJ,Liu GY,Dai F,Qian YP,Fan GJ,Liu Q,Zhou B.Antioxidant capacity of curcumin-directed analogues:structure-activity relationship and influence of microenvironment.Food Chem,2010,119:1435~1442
24.Shang YJ,Qian YP,Liu XD,Dai F,Shang XL,Jia WQ,Liu Q,Fang JG,Zhou B.Radical-scavenging activity and mechanism of resveratrol-oriented analogues:influence of the solvent,radical and substitution.J Org Chem,2009,74:5025~5031
25.Paiva-Martins F,Fernandes J,Rocha S,Nascimento H,Vitorino R,Amado F,Borges F,Belo L,Santos-Silva A.Effects of olive oil polyphenols on erythrocyte oxidative damage.Mol Nutr Food Res,2009,53:609~616
26.Hussain RF,Nourin AME,Oliver RTD.A new approach for measurement of cytotoxicity using colorimetric assay.Journal of Immunological Methods,1993,160:89~96
27.HanschC,LeoA.ExploringQSAR:fundamentsand applicationsin chemistry and biology. Washington,DC:American Chemical Society,1995
28.Selassie CD,Kapur,S,Verma RP,Rosario M.Cellular apoptosis and cytotoxicity of phenolic compounds: a quantitative structure-activity relationship study. J Med Chem,2005,48:7234~7242
29.Wright JS,Johnson ER,Dilabio GA.Predicting the activity of phenolic antioxidants:theoretical method,analysis of substituent effects,and application to major families of antioxidant.J Am Chem Soc,2001,123:1173~1183
30.Foti M,Ruberto G.Kinetic solvent effectson phenolic antioxidant determined by spectrophotometric measurements.J Agric Food Chem,2001,49:342~348
This work was supported by a grant from The National Natural Science Foundation of China(120972063)
Structure-Activity Relationship for Anti-Haemolysis and Cytotoxicity Against HL-60 Cells of Caffeic Acid Phenethyl Ester Derivatives
QIAN Yiping,WANG Qi,CAO Xiaoyan,ZHOU Bo
State Key Laboratory of Applied Organic Chemistry,Lanzhou University,Lanzhou 730000,China
Mar 18,2010 Accepted:Apr 13,2010
Zhou Bo,Tel:+86(931)8912500,E-mail:bozhou@lzu.edu.cn
Caffeic acid phenethyl ester hasbeen identified asan active component of propolis,and its antioxidant and cancer chemoprevention activities have attracted considerable attention.In order to reveal the structure-activity relationship of caffeic acid phenethyl ester derivatives(ArOHs),the authors synthesized six ArOHs,caffeic acid phenethyl ester(CAPE),ferulic acid phenethyl ester(FAPE),4-hydroxycinnamic acid phenethyl ester(4-HCAPE),sinapic acid phenethyl ester(SAPE),3,5-dihydroxycinnamic acid phenethyl ester(3,5-DHCAPE) and 3-hydroxycinnamic acid phenethyl ester(3-HCAPE) by preparing acyl chlorides of cinnamic acid followed by alkoxy-dehalogenation.The antioxidant capacity of theArOHsagainst AAPH-induced oxidative haemolysis of red blood cells was examined.It was found that the antioxidant activity depended significantly on molecular structure(position and number of hydroxyl groups)and lipophilicity in the order of CAPE≈4-HCAPE>SAPE>FAPE>3,5-DHCAPE>3-HCAPE.Compounds bearing o-dihydroxyl groups and 4-hydroxyl group on the aromatic ring(CAPE and 4-HCAPE)were the most active.Furthermore,their antiproliferative effect on human promyelocyticleukemia (HL-60) cellswas assessed by MTT method.Intriguingly,compounds with higher antioxidant activity(CAPE and 4-HCAPE)exhibited higher antiproliferative activity,which reinforces the idea of designing antioxidant-based cancer chemoprevention agents.
Caffeic acid phenethyl ester;Antioxidant;Structure-activity relationship;Red blood cell;Cancer chemoprevention
2010-03-18;接受日期:2010-04-13
国家自然科学基金面上项目(20972063)
周波,电话:(0931)8912500,E-mail:bozhou@lzu.edu.cn
O629