PEX基因在肿瘤细胞中的表达及其体外对微血管生成的影响
2010-08-21许传杰刘林林王贵全朱桂彬李玉林
许传杰,刘林林,王贵全,何 旭,朱桂彬,李玉林*
(1.吉林大学第二医院 病理科,吉林长春 130041;2.吉林大学第二医院 放疗科;3.吉林大学第二医院科教科;4.吉林大学病理生物学教育部重点实验室)
PEX基因在肿瘤细胞中的表达及其体外对微血管生成的影响
许传杰1,刘林林2,王贵全3,何 旭4,朱桂彬4,李玉林4*
(1.吉林大学第二医院 病理科,吉林长春 130041;2.吉林大学第二医院 放疗科;3.吉林大学第二医院科教科;4.吉林大学病理生物学教育部重点实验室)
目的探讨PEX基因在体外对微血管生成的影响。方法利用RT-PCR、人脐静脉内皮细胞(HUVEC)小管形成实验及鸡胚绒毛尿囊膜(CAM)血管形成实验,体外观察PEX基因对血管生成的影响。结果稳定筛选的细胞株BpcDNA-sPEX经RT-PCR可扩增出sPEX带;bFGF+BpcDNA-sPEX组小管数明显少于bFGF+BpcDNA、bFGF+B16F10组(P<0.01);bFGF+BpcDNA-sPEX组血管分支点数明显少于bFGF+BpcDNA、bFGF+B16F10组(P<0.01)。结论PEX基因能够抑制由bFGF诱导的CAM血管的新生、PEX基因能够阻抑bFGF对小管形成的促进作用。
PEX基因;RT-PCR;微血管生成
(Chin J Lab Diagn,2010,14:0014)
Brooks等发现MMP-2可通过C端与整合素蛋白家族成员α vβ3结合,激活自身催化活性,产生 C端类血红素结合片断PEX(Hemopexin),该片断可抑制MMP-2对ECM降解和血管的形成[1,2],提示PEX片断有可能成为抗肿瘤血管生成新的生物活性药物。目前对PEX基因的研究仅限于原核表达载体所表达的PEX融合蛋白对微血管生成的影响,因此本研究在构建了真核表达载体pcDNA3.1-sPEX的基础上,体外观察PEX基因对微血管生成的影响。
1 材料与方法
1.1 稳定筛选的细胞株BpcDNA-sPEX、BpcDNA获得见已文献[3]。B16F10细胞株购于中国科学院上海细胞生物研究所,以上三株细胞常规传代培养。
1.2 TRIzol试剂分别提取BpcDNA-sPEX、BpcDNA、B16F10细胞总RNA,经RT-PCR,观察各个细胞株sPEX的表达情况,PCR反应条件为:94℃10 s、55℃30 s、72℃50 s,30个循环,全部循环结束后,于72℃做5min终止前延伸。用GAPDH做内对照。
1.3 HUVEC小管形成实验 将Matrigel置4℃融化 ,包被于 24孔板内 ,每孔 320 μ l,37℃孵育30 min;生长状态良好的HUVEC接种于Matrigel包被的24孔板内,每孔25 000个/75 μ l;各孔内分别加入以下条件培养基:10%LSGS的M200培养液(对照组),bFGF,bFGF+BpcDNA-sPEX上清,bFGF+BpcDNA上清,bFGF+B16F10上清,各组bFGF的浓度均为30 ng/ml,37℃孵育30 min;加含10%低血清生长因子添加剂(LSGS)的 M200 培养液 150 μ l,37℃、5%CO2及饱和湿度环境下孵育6 h;PBS洗细胞2次,每次5 min,4%多聚甲醛固定15 min;在倒置显微镜下观察 、计数 。
1.4 CAM血管形成实验 取9日龄鸡胚,无菌H2O2洗净,1/4 000甲醛擦拭后,凉干;将鸡胚置检卵灯下寻找胚头,在距胚头前1cm,两条前卵黄静脉之间的卵壳投影部位,用蜡笔画出1 cm×1.5 cm长方形区;在鸡胚气室端钻约1.0 mm-2.0 mm小孔并穿透气室壳膜;在蛋壳开窗位置,用75%酒精消毒后,用小锉刀沿长方形区的边线磨切透卵壳(切勿伤及下方的卵壳膜);用眼科镊夹住长方形卵壳膜,平行上提,暴露下方的卵壳膜;注射针头循壳膜纤维方向划破直径1 mm小孔,不可伤及下方CAM;在壳膜窗上滴加无菌生理盐水少许,然后用眼科镊轻轻拨起小孔边缘卵壳膜,让液体浸入卵壳膜与CAM之间,CAM下沉后,剪除长方框内卵壳膜;将直径0.5 mm滤纸放置于CAM上无血管区,在CAM上分别加入以下物质,依照加入物质的不同而将实验分成五组,A组:无菌生理盐水;B组:30 μ g/ml bFGF;C组:30 μ g/ml bFGF+BpcDNA-sPEX 细胞上清;D组:30 μ g/ml bFGF+BpcDNA 细 胞上清 ;E 组:30 μ g/ml bFGF+B16F10细胞上清;用灭菌透明胶带封住卵窗,放入恒温箱内孵育(37℃、湿度70%);72 h后,取出鸡胚,局部滴加甲醇、丙酮等量混合固定液,室温下固定15 min;待CAM上的血管内血液凝固后,将测试区域的CAM剪下,置于盛有H2O2的碟皿中,用弯头吸管展开后,倾去皿中的H2O2,在皿底摊平CAM,翻转贴于滤纸上,记录结果。在解剖显微镜下计数滤纸区域内可见血管的分支点数量,统计学方法采用±s表示测定结果,平均数之间的比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 稳定筛选的细胞株BpcDNA-sPEX、BpcDNA及亲代细胞B16F10,经 RT-PCR,可见从BpcDNA-sPEX细胞中扩增出678 bp的 sPEX带,而在BpcDNA、B16F10细胞中未扩增出目的基因,只见GAPDH带。见图1。
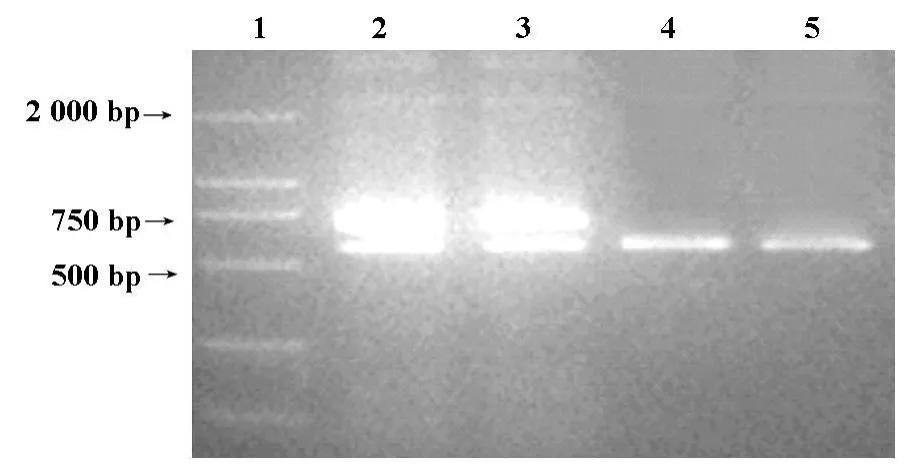
图1 BpcDNA-sPEX细胞RT-PCR结果
2.2 PEX基因对HUVEC小管形成的影响
HUVEC在Matrigel胶包被的孔板内可形成小管样结构。bFGF+PEX组小管形成的数量与bFGF+BpcDNA组、bFGF+B16F10组相比,统计学上存在着显著差异(P<0.01),bFGF+BpcDNA-sPEX组小管数明显少于 bFGF+BpcDNA、bFGF+B16F10组;bFGF+BpcDNA组与bFGF+B16组相比,小管数量没有明显差别(P>0.05)。见表1。

表1 不同组别HUVEC形成小管数量
2.3 PEX基因对CAM新生血管的抑制作用
在9日龄CAM上分别加入上述不同物质,72 h后可见:B组的血管分支点数明显高于A组,C组的血管分支点数与B组相比,统计学上有着显著性差异(P<0.01),C组的血管分支点数明显低于B组,D组和E组血管分支点数与B组相比,经统计学处理没有显著性差异(P>0.05)。结果见表2。
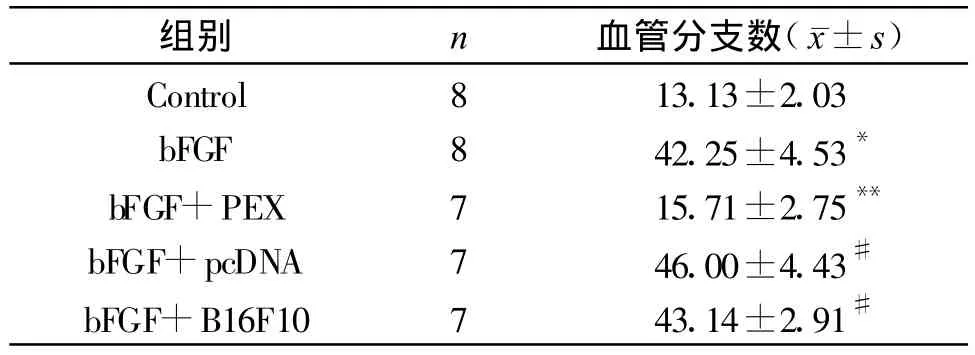
表2 不同组别CAM血管指数
3 讨论
肿瘤生长和转移是一个依赖于血管的过程,新生的血管将肿瘤细胞和微循环系统直接联系起来,不仅使肿瘤生长的物质交换得以进行,同时新生血管还可以作为肿瘤转移的通道。有实验表明[4],原发肿瘤在血管形成前,肿瘤细胞是很少进入血液循环,但在血管形成之后,入血的瘤细胞却是持续的,进入血液的肿瘤细胞数与肿瘤血管密度密切相关。
血管新生是一个多种因子调控的复杂过程,正负两类调节因子的相互作用决定了血管形成的全程,而此过程的最终结果是形成了新生的微血管。Ausprunk等人[5]曾利用电子显微镜对毛细血管的形成进行分析,发现在新的毛细管围成环状、新合成的细胞外基质成分沉积、铺垫后,血管环前端新合成的基底膜(BM)就开始了MMPs所介导的蛋白水解过程,内皮细胞浸润就从水解局部开始,形成一个新的毛细血管芽,随后又接续了一系列细胞外蛋白水解的活化与抑制的动态循环过程。为了更直接地观察MMPs对内皮细胞形态变化方面的作用,研究人员采用了体外细胞培养[6],发现当将人脐静脉内皮细胞培养于BM样物质(Matrigel)上时,内皮细胞很快排成直线,围成管状,编织成血管网。用明胶酶谱分析检测出培养上清中含有大量活化的MMP2与MMP9,额外添加这两种酶的人工抗体,或TIMP1、TIMP2,发现人工抗体与组织抑制物的作用效果相似,均可降低甚至完全阻遏Matrigel上内皮细胞管状结构的形成。为了明确PEX基因对HUVEC体外成管影响,我们设计了一组条件培养基对比实验。实验显示:单纯加入碱性成纤维细胞生长因子(bFGF)能明显促进小管的形成;bFGF+BpcDNA-sPEX上清组小管形成的数量与单纯bFGF组相比有显著统计学意义(P<0.01),bFGF+BpcDNA-sPEX上清组小管数明显少于bFGF组;bFGF+BpcDNA、bFGF+B16上清组与单纯bFGF组相比,小管形成数没有明显的统计学差异(P<0.05)。说明bFGF能提高HUVEC形成小管的能力,而PEX基因可阻断bFGF对HUVEC体外成管的促进作用。
有研究表明,在鸡胚尿囊膜和兔角膜血管生成模型中,bFGF能引起αvβ3整合素的表达上升,诱导新生血管生成,用拮抗αvβ3整合素的单克隆抗体能抑制 αvβ3整合素诱导血管生成的反应,表明 αvβ3整合素参与bFGF诱导的血管生成[7]。我们在9日龄CAM上分别加入不同的作用物质,结果显示:bFGF能促进CAM血管发生,而PEX基因能够阻滞bFGF对CAM血管发生的促进作用。说明PEX基因不仅能抑制肿瘤血管生成,还阻滞鸡胚绒毛尿囊膜血管新生。PEX是否与整合素αvβ3相互作用从而抑制了bFGF介导的鸡胚绒毛尿囊膜新生血管的形成,还有待于进一步探讨。
目前,抗血管生成治疗肿瘤的研究多是先提纯蛋白,再用于实验,但蛋白的提取、纯化等步骤较为繁琐,且条件要求很高,原核表达的蛋白较难满足实验要求,因此本实验首次在构建了pcDNA3.1-sPEX真核表达载体的基础上,体外观察了PEX基因对微血管生成的影响,为PEX片断有可能成为抗肿瘤血管生成的新生物活性药物奠定理论基础和实验依据。
[1]Brooks PC,Sillettl S,Von Schalscha TL,et al.Disruption of angiogenesi109pd by PEX,a noncatalytic metallopproteinase fragment with integrin binding activity[J].Cell,1998,92(3):391.
[2]李金萍,张光谋,柯 杨,等.基质金属蛋白酶-2 C端片段PEX的原核表达及其对血管发生的抑制作用[J].生物化学与生物物理进展,2002,29(1):120.
[3]许伟杰,李玉林,李一雷.基质金属蛋白酶-2 C端片断pex的克隆,测序及真核表达的构建[J].吉林大学学报(医学版),2003,29(5):591.
[4]Giobron MA,Cotran RS,Leapman,et al.Tumor growth and neovascularization:An experimental model using rabbit cornea[J].J Natl Cancer Inst,1974,72(5):413.
[5]Ausprunk DH,Folkman J.Migration and proliferation of endothelial cells in performed and newly formed blood vessels during tumor angiogenesis[J].Microvasc Res,1977,14:53.
[6]Goede V,Schmidt T,Kimmina S,et al.Analysis of blood vesselmaturation processes during cyclic ovarian angiogenesis[J].Lab Invest,1998,78:1385.
[7]Montgomery AM,Reisfeld RA,Cheresh DA.Integrin alpha v beta 3 rescues melanoma cells from apoptosis in three-dimensional dermal collagen[J].J Proc Natl Acad Sci USA,1994,91:8856.
expression of PEX genes in thetumor cell and effect on microvascular formation in vitro
XU Chuan-jie,LIU Lin-lin,WANG Gui-quan,et al.(Dept.of Pathology,The Second Hospital Jilin University,Changchun130041,China)
ObjectivePurpose To approach the possible effects of PEX genes on microvascular formation in vitro.MethodsUsing RT-PCR,matrigel capillary-like tube structure formation assay on human umbilical vein endothelial cells(HUVEC),and chick chorioallantoic membrane(CAM)assay methods to examine the effects of PEX genes on microvascular formation in vitro.ResultsRT-PCR results indicated that sPEX m RNA expressed in the BpcDNA-sPEX-positive cell line.with bFGF+BpcDNA or bFGF+B16F10 treatment,bFGF+BpcDNA-sPEX treatment not only induced a significantly decrease in the amount of capillary-like tube(P<0.01)but also resulted in a significantly decrease in the amount of branch vessels(P<0.01).ConclusionPEX genes can inhibit bFGF-induced CAM vascular neogenesis,and prevent bFGF-induced enhancement inmatrigel capillary-like tube structure formation.
PEX gene;RT-PCR;microvascular formation
Q78
A
1007-4287(2010)01-0014-03
*通讯作者
许传杰,40岁,女,博士,副教授,主要研究方向:肿瘤分子病理学。
2008-03-09)
