化疗所致恶心呕吐及其治疗药物的研究进展
2010-08-06朴永锋浙江省肿瘤医院药剂科杭州市310022
施 亮,王 增,朴永锋,王 磊(浙江省肿瘤医院药剂科,杭州市 310022)
化疗药物引起的恶心、呕吐(Chemotherapy-Induced Nausea and Vomiting,CINV)是化疗期间最常见的不良反应之一,发生率为70%~80%。其中10%~44%的CINV患者为预期性恶心、呕吐[1]。CINV可导致患者体质下降、电解质紊乱、食欲下降[1],严重者还会影响癌症患者的化疗进展,从而导致化疗失败。因此,有效地预防和减少CINV的发生具有重要的临床意义。本文就引起CINV的因素、机制、分类以及相关止吐药物的进展作如下综述。
1 CINV的临床评价
目前临床对CINV的评价是按照世界卫生组织(WHO)的分级标准进行,将恶心呕吐分为:0度,无恶心呕吐;Ⅰ度,恶心,无呕吐;Ⅱ度,恶心呕吐每天1~2次,不需治疗;Ⅲ度,恶心呕吐每天3~5次以上,影响进食与正常生活,需治疗;Ⅳ度,严重恶心呕吐每天5次以上,需卧床、输液治疗。止吐疗效评价:以无恶心呕吐,或轻度恶心,呕吐每天1~2次为有效。
2 CINV的易感因素及致吐药物的分类
研究发现,女性患者,年龄小于50岁,有饮酒史和化疗史的患者在化疗期间往往比较容易发生CINV,少数患晕动症或怀孕的患者也会发生CINV[2]。
根据化疗药物的致吐作用程度,分最强的致吐药物、中高度致吐药物、中度致吐药物、低致吐药物。抗肿瘤药物致吐情况见表1。

表1 抗肿瘤药物致吐情况[3]
3 CINV的机制
CINV的机制非常复杂,到目前为止尚无定论。多数学者认为CINV主要通过3个途径引发[3]:(1)化疗药物损伤消化道黏膜,导致肠嗜铬细胞释放5-羟色胺(5-Hydroxytryptamine Agonists,5-HT)等物质,刺激肠壁传入迷走神经上的5-HT3受体,兴奋延髓的呕吐中枢而导致呕吐。(2)化疗药物可作用于大脑第四脑室的催吐化学感受区(Chemoreceptor trigger zone,CTZ)而引起呕吐。(3)感觉、精神因素直接刺激大脑皮质通路导致呕吐。
4 CINV的分类
CINV可分为急性、迟发性、预期性、突发性、难治性5种类型。急性呕吐是指化疗后24 h内出现的呕吐;迟发性呕吐发生于给药24 h后,多在24~72 h出现,也可晚至化疗后4~5 d才出现的呕吐;预期性呕吐是指既往化疗时有过呕吐的患者,在受到与化疗相关事物的刺激时产生的条件反射性呕吐,发生于化疗前或化疗中;突发性呕吐是指在使用止吐剂的5 d内突然发生的呕吐;难治性呕吐是指在前期化疗中使用止吐剂治疗失败,并在后期化疗中发生的呕吐。
5 CINV的治疗指南
由2008年版美国国家综合癌症网络(NCCN)治疗指南可见:中、高度呕吐采用5-HT3受体拮抗药、地塞米松和阿瑞吡坦的三联用药方案;对于低发或者极低发呕吐通常是在化疗前给予地塞米松;对于预期性、突发性呕吐应当加强患者的心理治疗,使患者建立信心去接受化疗,有必要时可根据患者实际情况给于抗焦虑药治疗;对于难治性呕吐目前治疗的手段不多,主要则是应用大麻素类、加巴喷丁[4],具体见表2。

表2 NCCN治疗指南表
6 止吐药物
目前临床应用的止吐药物有多巴胺受体拮抗药、皮质类固醇类、5-HT受体拮抗药、神经激肽(NK)1受体拮抗药、多靶点的止吐药物奥氮平及大麻素等其它类和中药。
6.1 多巴胺受体拮抗药
多巴胺D2受体拮抗药的代表药物为甲氧氯普胺,对迟发性呕吐有一定疗效,可能与其镇静和中枢效应有关。本品作用于延髓催吐化学感应区(CTZ)中的多巴胺受体,提高CTZ的感受阈值而发挥中枢性止吐作用;此外本品可提高胃肠道括约肌的张力,加强胃和食管蠕动,促进胃排空,从而减少胆汁和胃泌素分泌,起到协同止吐的作用[5]。另外,本品对5-HT3受体亦有轻度抑制作用,与糖皮质激素联用,可增加疗效并减轻不良反应。但长期反复或大剂量使用,因阻断多巴胺受体,胆碱能受体相对亢进而发生神经中枢抑制或锥体外系反应,表现为肌震颤、发音困难、共济失调等。因此,多巴胺受体拮抗药的临床应用受到限制。
6.2 皮质激素
皮质激素的主要代表药物是地塞米松,能有效地预防CINV,常常作为预防恶心呕吐的首选药物。作用机制目前尚未明确,有研究者认为可能是通过抗炎及抗毒素的作用,减轻外周神经的损害,保持正常的胃肠动力,从而减轻迟发性呕吐[6];另有学者认为地塞米松通过外周和中枢2种途径抑制5-HT产生和释放而起到止吐作用;也可能是地塞米松改善血脑屏障对血清蛋白的通透性,降低血液中5-HT浓度,减轻脑组织水肿而起到止吐作用。
值得注意的是地塞米松在治疗轻、中度致吐性化疗导致的呕吐中会引起重度失眠、腹胀、消化不良、精神亢奋、食欲增加等不良反应,需要引起临床重视。
6.3 5-HT受体拮抗药
5-HT受体拮抗药选择性强,已逐渐发展成为治疗CINV的主流药物。该类药物通过作用于延髓第四脑室两侧闩上方的最后区、孤束核的迷走神经传入纤维末梢和胃肠道的嗜铬细胞,阻断5-HT与5-HT3受体结合,阻止信号传入呕吐中枢和CTZ从而起到止吐作用。因此,5-HT3受体拮抗药对胃肠嗜铬细胞释放5-HT所致的急性呕吐具有强有效的止吐作用。但对迟发性呕吐,由于存在其他机制,止吐效果不如急性呕吐。5-HT受体拮抗药的药理作用强弱主要与受体亲合力有关,作用持续时间则与CYP450代谢酶系和其自身的半衰期有关。由表3可知,多拉司琼与5-HT受体结合的亲合力最弱,帕洛诺司琼最强,其它5-HT受体拮抗药基本相似。在作用时间方面,帕洛诺司琼最长,其它5-HT受体拮抗药基本相似。
5-HT受体拮抗药对心脏的不良反应应引起临床关注,有心脏并发症的患者使用时应慎重,或者首选格拉司琼。恩丹司琼有明显的中枢神经系统(Central nervous system,CNS)不良反应,肝功能不全的患者对恩丹司琼的代谢会受影响,使用时应调整剂量,做到剂量个体化[7]。
目前唯一的一个第2代5-HT受体拮抗药帕洛诺司琼已获批用于预防中、高度致吐药物引起的急性CINV,以及有中度致吐作用药物引起的迟发性CINV。与第1代相比,其与受体亲合力(pKi)更高,半衰期更长(见表3),有研究报道,高度的CINV患者在接受顺铂(60 mg·m-2)化疗前预防性给予帕洛诺司琼联合地塞米松或昂丹司琼联合地塞米松,结果发现在治疗迟发性呕吐和整个化疗周期,帕洛诺司琼联合地塞米松组明显优于昂丹司琼联合地塞米松组[8]。此外临床研究表明,单独使用帕洛诺司琼治疗中度的急性或迟发性CINV比昂丹司琼和多拉司琼更有效[9,10]。然而,有资料表明,低血钾或低血镁患者、先天性QT综合征患者、服用抗心律失常药物或可能导致QT延长药物的患者,及接受过高剂量蒽环类化疗的患者应慎用此药[11]。
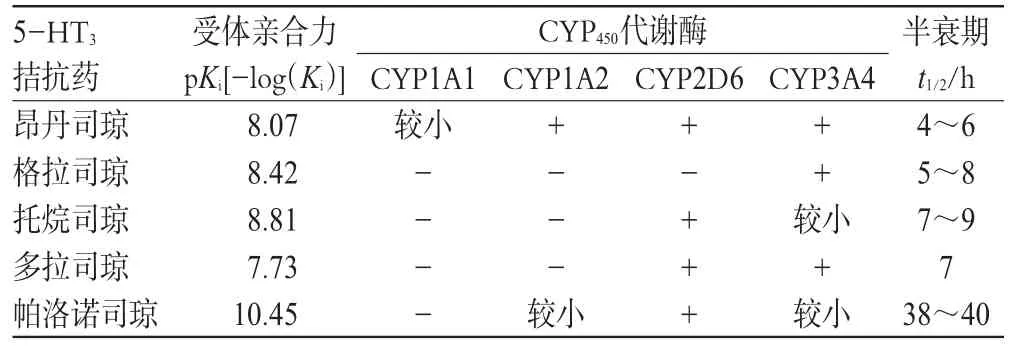
表3 5-HT受体拮抗药药理作用和代谢情况表
6.4 NK1受体拮抗药
P物质是一种速激肽,存在于胃肠嗜铬细胞、腹部迷走神经、脑干孤束核和最后区等化疗呕吐产生的关键部位[12],通过与NK1受体结合产生呕吐。NK1受体拮抗药通过与P物质竞争NK1受体而起到止吐作用。不过,NK1受体拮抗药需进入CNS才能发挥作用,具体的作用位点尚未明确,可能的区域为孤束核、呕吐中枢和迷走神经背侧运动核[3],主要代表药物有阿瑞吡坦(Aprepitant)、福沙吡坦(Fosaprepitant)、Casopitant。
6.4.1 阿瑞吡坦。阿瑞吡坦是第1个获准应用于临床的NK1受体拮抗药。获批适应证为与其它致吐药物联用以预防顺铂及/或表柔比星(HEC)等所致的急性或迟发性CINV。本品的平均绝对生物利用度为60%~65%,达峰时间约为4 h,正常进食不影响生物利用度。
单用阿瑞吡坦治疗急性呕吐效果与昂丹司琼相当,特别是对于顺铂方案所导致的迟发性呕吐更为有效[13]。多项研究表明,阿瑞吡坦联合5-HT3受体拮抗药和地塞米松使急性呕吐控制率增加20%,迟发性呕吐控制率增加30%~40%,这种改善能维持多个化疗周期[14~16]。同时在治疗中度致吐化疗方案的研究中发现,在化疗后的24 h内阿瑞吡坦、昂丹司琼、地塞米松联合方案明显优于昂丹司琼和地塞米松方案,但对恶心没有改善[17]。
阿瑞吡坦耐受性良好,未见严重不良反应报道,但是疲劳、虚弱、呃逆的发生率更高。值得注意的是本品为中等程度的CYP3A4代谢酶抑制剂,因此在与其它主要经CYP3A4途径代谢的药物(匹莫齐特、特非那定、阿司咪唑和西沙必利等)合用时,应该格外慎重。此外,长期使用本品,药物的相互作用谱可能会发生改变,因而不推荐长期持续使用。
6.4.2 福沙吡坦。福沙吡坦是阿瑞吡坦的前体药物,为阿瑞吡坦磷酸化的注射剂型,注射该药30 min后可在体内转化为具有活性的阿瑞吡坦,从而发挥药效。福沙吡坦用于不能口服的、吞咽困难的或消化功能低下的患者。其生物等效性和AUC均与阿瑞吡坦相似[13],在治疗顺铂引起的呕吐方面,福沙吡坦比昂丹司琼更有效[14]。有研究表示,福沙吡坦的耐受剂量为150 mg。
6.4.3 Casopitant。Casopitant(GW679769)是一种哌嗪类衍化物,在速激肽、P物质和其它神经激肽介导的呕吐方面有治疗潜力。该药能竞争性地和NK1受体结合,从而抑制P物质和NK1受体结合,通过拮抗NK1受体的活性起到止吐作用[18]。Casopitant及其去铁胺盐正被发展用于CINV及术后恶心、呕吐、焦虑。Casopitant可显著提高患者对地塞米松和昂丹司琼的敏感性,合用后能有效提高地塞米松和昂丹司琼对于化疗引起的中、高度呕吐反应的治疗效果[19,20]。此外,目前的Ⅱ、Ⅲ期临床研究尚未观察到Casopitant相关的严重不良反应[18]。
6.5 多靶点的止吐药物及其它止吐药物
6.5.1 奥氮平。奥氮平是美国食品药物管理局(FDA)批准的抗精神药,能阻断多巴胺神经递质D1、D2、D3受体及5-HT神经递质 5-HT2a、5-HT2c、5-HT3、5-HT6受体[21,22]、儿茶酚胺类神经递质、α1-肾上腺素受体、毒蕈碱的乙酰胆碱受体和H1组胺受体等多种神经递质,对多巴胺神经递质和5-HT神经递质的作用特别强,对控制急性和迟发性中、高度CINV也安全有效[23]。Ⅱ期实验表明,奥氮平联合地塞米松和帕洛诺司琼在控制急性和迟发性中、高度CINV也具有一定的疗效,是一种高效的止吐药[24]。
6.5.2 大麻素类。CINV相关的大麻素类药物主要是屈大麻酚和大麻隆,用于治疗突发性和难治性的CINV,疗效优于丙氯拉嗪、甲氧氯普胺、氯丙嗪、氟哌啶醇、多潘立酮、阿立必利等[25]。然而对于大麻素治疗CINV的机制尚不清楚,最近有资料表明,大麻素可以通过干预脑干的大麻受体1(CB1)受体神经元可以间接影响呕吐[26]。
6.5.3 中药。中医从扶正、健脾、解毒、降逆多方面着手治疗化疗致吐,作用日益显著。王德山等采用止呕合剂与昂丹司琼对照组止吐效果比较,无显著差异;但中药不良反应却远远小于昂丹司琼对照组。试验表明,中药在防治化疗致吐中具有一定的优势。李云华等经临床观察证实,肺癌患者在化疗时,采用昂丹司琼、胃复安和洁白胶囊联合应用,可以明显降低化疗引起的恶心、呕吐症状。
7 总结
经过30多年的临床实践,约有70%的CINV已被有效地控制,特别是NK1受体拮抗药在临床的应用使得急性CINV的控制率提高了20%,迟发性CINV的控制率提高了30%。尽管如此,在治疗CINV的过程中仍存在一些问题,主要有3方面:(1)在CINV的机制研究方面:预期性、难治性CINV的机制缺乏深入研究,使得预期性、难治性CINV目前尚未得到有效控制,这将是下一步需解决的难题。(2)在止吐药物研究方面:传统止吐药物不良反应较多,已限制了其应用。5-HT3受体拮抗药和NK1受体拮抗药虽然疗效突出,但也存在着价格昂贵、远期不良反应尚不清楚等问题。此外目前应用于临床的止吐药物虽然品种较多,但高效、多靶点的止吐药物只有奥氮平一种。(3)在治疗CINV的研究方面:目前的研究主要集中在治疗CINV止吐药物的开发上,对于如通过改良化疗药物剂型,或者制成潜药、靶向制剂从根源上降低CINV的发生的研究却鲜有报道。总之,CINV的发生原因和机制复杂多变,只针对一两个作用靶点很难达到治愈目的。我们只有在源头上解决问题,比如减少化疗药物本身的不良反应从而降低CINV的发生,同步开发低毒、有效、经济、多靶点止吐药物,扩大CINV的治疗手段才能从根本上控制各种化疗所致恶心、呕吐反应。
[1] Effective interventions for CINV:NCCNAntiemesis Clinical Practice Guidelines in Oncology[J].ONS News,2004,19(9 Suppl):17.
[2] Schwartzberg L.Chemotherapy-induced nausea and vomiting:state of the art in 2006[J].J Support Oncol,2006,4(2 Suppl 1):3.
[3] 王梅子,许建衡.化疗止吐药物的研究进展[J].汕头大学医学院学报,2008,21(2):123.
[4] Lohr L.Chemotherapy-induced nausea and vomiting[J].Cancer J,2008,14(2):85.
[5] 金有豫.药理学[M].第5版.北京:人民卫生出版社,2001:263.
[6] 张开芳.格拉司琼联合地塞米松预防含顺铂方案化疗所致恶心呕吐的疗效观察[J].中国临床医学,2004,11(2):180.
[7] Longfield V.Compatibility and stability of 5-HT3receptor antagonists:a pharmacology review[J].Oncol Nurs Forum,2002,29(10):1 469.
[8] Aapro MS,Grunberg SM,Manikhas GM,et al.A phaseⅢ,double-blind,randomized trial of palonosetron compared with ondansetron in preventing chemotherapy-induced nausea and vomiting following highly emetogenic chemotherapy[J].Ann Oncol,2006,17(9):1 441.
[9] Gralla R,Lichinitser M,Van Der Vegt S,et al.Palonosetron improves prevention of chemotherapy-induced nausea and vomiting following moderately emetogenic chemotherapy:results of a double-blind randomized phaseⅢtrial comparing single doses of palonosetron with ondansetron[J].Ann Oncol,2003,14(10):1 570.
[10] Eisenberg P,Figueroa-Vadillo J,Zamora R,et al.Improved prevention of moderately emetogenic chemotherapyinduced nausea and vomiting with palonosetron,a pharmacologically novel 5-HT3 receptor antagonist:results of a phaseⅢ,single-dose trial versus dolasetron[J].Cancer,2003,98(11):2 473.
[11] 黄海辉,王东林,梁后杰.等.国产盐酸托烷司琼治疗顺铂化疗所致恶心、呕吐的疗效与安全性评价[J].中国药房,2005,16(17):1 318.
[12] 张晓静,张 频.肿瘤化疗所致恶心呕吐的发生机制和药物治疗的研究进展[J].癌症进展,2006,4(4):348.
[13] Cocquyt V,Van Belle S,Reinhardt RR,et al.Comparison of L-758 298,a prodrug for the selective neurokinin-1 antagonist L-754 030,with ondansetron for the prevention of cisplatin-induced emesis[J].Eur J Cancer,2001,37(7):835.
[14] Van Belle S,Lichinitser MR,Navari RM,et al.Prevention of cisplatin-induced acute and delayed emesis by the selective neurokinin-1 antagonists, L-758,298 and MK-869[J].Cancer,2002,94(11):3 032.
[15] Chawla SP,Grunberg SM,Gralla RJ,et al.Establishing the dose of the oral NK-1 antagonist Aprepitant forchemotherapy-induced nausea and vomiting[J].Cancer,2003,97(9):2 290.
[16] De Wit R,Herrstedt J,Rapoport B,et al.The oral NK-1 antagonist,aprepitant,given with standard antiemetics provides protection against nausea and vomiting over multiple cycles of cisplatin-based chemotherapy:a combined analysis of two randomized,placebo-controlled phase Ⅲ clinical trials[J].Eur J Cancer,2004,40(3):403.
[17] Warr DG,Hesketh PJ,Gralla RJ,et al.Efficacy and tolerability of aprepitant for the prevention of chemotherapyinduced nausea and vomiting in patients with breast cancer after moderately emetogenic chemotherapy[J].J Clin Oncol,2005,23(12):2 822.
[18] Navari RM.Casopitant,a neurokinin-1 receptor antagonist with anti-emetic and antinausea activities[J].Curr Opin Investig Drugs,2008,9(7):774.
[19] Grunberg SM,Aziz Z,Shaharyar A,et al.PhaseⅢ results of a novel oral neurokinin-1(NK-1)receptor antagonist,casopitant:single oral and 3-day oral dosing regimens for chemotherapy-induced nausea and vomiting(CINV)in patients(pts)receiving moderately emetogen-ic chemotherapy(MEC)[J].J Clin Oncol,2008,26(20 Suppl):9 540.
[20] Strausz J,Rolski J,Aziz Z,et al.PhaseⅢ results for the novel neurokinin-1(NK-1)receptor antagonist,casopitant:3-DayⅣ/oral dosing regimen for chemotherapy-induced nausea and vomiting(CINV)in patients(Pts)receiving highly emetogenic chemotherapy(HEC)[J].J Clin Oncol,2000,26(Suppl):20 585.
[21] Bymaster FP,Calligaro D,Falcone J,et al.Radioreceptor binding profile of the atypical antipsychotic olanzapine[J].Neuropsychopharmacology,1996,14(2):87.
[22] Bymaster FP,Falcone JF,Bauzon D,et al.Potent antagonism of 5-HT3and 5-HT6receptors by olanzapine[J].Eur J Pharmacol,2001,430(2~3):341.
[23] Navari RM,Einhorn LH,Loehrer PJ,et al.A phaseⅡtrial of olanzapine for the prevention of chemotherapyinduced nausea and vomiting[J].Support Care Cancer,2005,13(7):529.
[24] Navari RM,Einhorn LH,Loehrer PJ,et al.A phaseⅡtrial of olanzapine,dexamethasone,and palonosetron for the prevention of chemotherapy-induced nausea and vomiting[J].Support Care Cancer,2007,15(11):1 285.
[25] Tramer MR,Carroll D,Campbell FA,et al.Cannabinoids for control of chemotherapy-induced nausea and vomiting:quantitative systematic review[J].BMJ,2001,323(7 303):16.
[26] Martin BR,Wiley JL.Mechanism of action of cannabinoids:how it may lead to treatment of cachexia,emesis,and pain[J].J Support Oncol,2004,2(4):305.
