尼群地平分散片人体生物等效性研究
2010-04-25田志国任进民张好曼丽张晓丽
田志国任进民张好曼丽张晓丽
(1河北赛克药业有限公司,河北 石家庄 050021;2河北医科大学附属第二医院,050000;3河北医科大学药学院,050017;4河北东海药都医药有限公司,050011)
尼群地平分散片人体生物等效性研究
田志国1任进民2张好曼丽3张晓丽4
(1河北赛克药业有限公司,河北 石家庄 050021;2河北医科大学附属第二医院,050000;3河北医科大学药学院,050017;4河北东海药都医药有限公司,050011)
目的:研究尼群地平分散片在健康人体内的药物动力学及相对生物利用度,为临床合理用药提供依据。方法:采用20名健康男性受试者双周期交叉口服单剂量20 mg尼群地平分散片(受试制剂)和资寿(尼群地平片,参比制剂),用LC-MS/MS法测定血浆中尼群地平浓度,考察两种制剂的生物等效性。结果:实验结果表明受试制剂的相对生物利用度为(106.7±25.0)%,两制剂具有生物等效性。结论:尼群地平分散片与资寿(尼群地平片)具有生物等效性。
尼群地平;液相色谱-串联质谱;相对生物利用度;生物等效性
尼群地平(nitrendipine)是第二代二氢吡啶类钙通道拮抗剂,具有选择性松弛血管平滑肌,扩张外周血管,降低血压疗效,其特点是作用温和,维持药效时间长,不良反应轻。目前国内上市的该药制剂主要为尼群地平片,是临床上较为理想的口服抗高血压药物[1-2]。但普通片剂有溶出速度慢、首过效应强、半衰期短、生物利用度低等缺点,且由于尼群地平难溶于水,服用剂量小,导致药物溶出缓慢而影响药物被充分吸收,降压作用只能维持6~8小时,每天需要服用2~3次,远远达不到尼群地平制剂的应有水平。尼群地平分散片较一般胶囊、片剂有明显的优越性,不仅服用方便,而且崩解与溶出快速,药效持久,特别适用于老年人和吞咽困难的病人。
本研究采用开放、随机分组、交叉、单剂量、两周期试验设计,筛选20名健康男性受试者按试验设计口服单剂量参比制剂或受试制剂,使用高效液相色谱-串联质谱检测法测定血浆中尼群地平浓度,用DAS软件拟合计算药代动力学参数及评价生物等效性[3-5]。现将有关尼群地平分散片人体生物利用度研究报道如下:
1 仪器与试药
3200 QTRAP型串联四极杆线性离子阱质谱仪,配有Turbo V离子源(美国AB公司),AnaLyst 1.4软件(美国AB公司)。液相色谱仪为Agilent 1200系统,配有四元泵、在线脱气机、自动进样器(美国Agilent公司)。
尼群地平分散片[受试制剂(A),河北赛克药业有限公司,规格:10 mg,批号:20090201,含量101.5%]。
尼群地平片[参比制剂(R),石药集团中诺药业(石家庄)有限公司,规格:10 mg,商标名:资寿,批号:08125044,有效期至2011年11月。批准文号:国药准字H13022629]。
尼群地平对照品,批号:100585-200602;内标为尼莫地平,批号:100270-200002,中国药品生物制品检定所。
2 方法与结果
2.1 试验设计
20名男性健康志愿者,平均年龄(22.3±1.8)a,平均体重(62.2±6.2)kg。试验前进行病史询问和体检,血、尿常规,心、肝、肾功能,血糖等检查均正常。受试前两周及试验期间未服用其他任何药物,受试者均无烟酒嗜好,自愿签署知情同意书,试验方案经伦理委员会批准通过。
采用双周期交叉试验设计,20名受试者随机分为2组。试验前一日晚8时起禁食,次日晨7时空腹口服药物A或R制剂20 mg,用200 mL温开水送服,2 h内禁水,4 h后统一进标准餐一次,8 h后进标准餐一次。试验期间保持日常轻微活动,不允许长时间卧床,并避免剧烈活动。分别在给药前取空白血样,于给药后0.25、0.5、0.75、1、1.5、2、3、4、6、8、11、14、24 h各个时刻自上肢静脉取血4 mL,注入肝素化管中,混匀后离心,转速3 000 rpm,时间10 min,血浆样品于-80℃冰箱保存待测。1周后交叉给药,重复试验。
2.2 血浆样品检测
2.2.1 色谱、质谱条件
色谱柱:Eclipse C18,5 mm,150×4.6 m(Agilent公司);流动相为乙腈∶水梯度洗脱。梯度洗脱程序:0~0.5 min,乙腈∶水比例70/30(v/v)→95/5;0.5~5.0 min,乙腈∶水比例维持95/5;5.0~5.1 min,乙腈∶水比例95/5→70/30;每次进样前预平衡3 min。流速:0.7 mL/min,进样体积为5 μL,柱温为室温。
质谱条件:离子源为电喷雾离子化源(ESI);源喷射电压(IS)为-4500V;雾化温度为600℃;雾化气(GS1,N2)压力为60 psi;辅助气(GS2,N2)压力为60 psi;气帘气(N2)压力为30 psi;负离子方式检测;扫描方式为多反应监测(MRM);用于定量分析的离子反应分别为:m/z 359.2→m/z 121.9(尼群地平),解簇电压(DP)为-41 V,碰撞能量(CE)-25 eV;m/z 417.3→m/z 122.0(内标,尼莫地平),解簇电压(DP)为-45 V,碰撞能量(CE)-30 eV;驻留时间均为200 ms。
2.2.2 样品处理
取血浆样品1 mL,加入50 μL内标溶液(85.2 μg/mL尼莫地平的乙腈溶液),涡流混合30 s,加入乙醚3 mL,涡流混旋2 min,离心(4 000 rpm)5 min,-20℃冷冻30 min,取上清液至5 mL离心管中,40℃氮气流下吹干。加入100 μL 70%乙腈溶液,涡流混旋1 min,溶液转移至2 mL离心管中,离心(12 000 rpm)5 min,取上清液70 μL至自动进样小瓶,进样5 μL进行LC-MS/MS分析,记录主峰和内标峰面积,用标准曲线法计算出血浆样品的尼群地平浓度(ng/mL)。
2.2.3 标准曲线和方法学研究
取空白血浆1 mL置离心试管中,加入50 μL含尼群地平系列标准溶液,配制成相当于尼群地平浓度为0.100,0.250,0.501,2.50,5.01,10.0,25.0,50.1 ng/mL的标准血浆样品。按血浆样品处理方法“2.2.2”项下方法操作处理后进行测定。以尼群地平与内标峰峰面积比(Y)对尼群地平浓度(X)作加权回归(1/C2),得回归方程Y=0.806 5X +0.012 70,r=0.998 5(n=8)。表明尼群地平的血浆浓度在0.100~ 50.1 ng/mL范围内线性关系良好。定量限为0.100 ng/mL。低、中、高3个浓度(0.250、5.01、40.1 ng/mL)血浆样品,日内精密度RSD≤5.9%、日间精密度RSD≤14.0%,RE≤6.9%。提取回收率分别为84.1%,94.1%和87.0%(n=18)。内标的提取回收率为 85.2%,RSD为10.7%(n=9)。
2.3 药动学参数和生物等效性评价
20名健康受试者口服单剂量20 mg受试制剂A和参比制剂R后的平均药-时曲线见图1。由DAS 2.0统计软件,计算各药代动力学参数,并进行生物等效性统计分析。

图1 平均药-时曲线(n=20)
用受试者的血药浓度-时间数据作曲线拟合,求得个体参数后计算平均值。tmax、Cmax取实测值,药时曲线下面积(AUC)由梯形法求得,消除半衰期按t1/2=-0.693/Zeta计算,相对生物利用度F=AUCA/AUCR×100%。(AUCA:受试制剂的AUC值;AUCR:参比制剂的AUC值。)采用DAS 2.0统计软件对各制剂所得的主要药代动力学参数,Cmax及AUC值经对数转换后作方差分析,双单侧t检验和90%置信区间检验,tmax用非参数法分析,评价两制剂的生物等效性。受试制剂和参比制剂生物等效性统计分析结果分别见表1~4。
非参数秩和检验结果表明,A和R制剂tmax无显著性差异(P>0.05)。方差分析结果显示,A制剂和R制剂Cmax及AUC值均无显著性差异(P>0.05)。双单侧t检验结果表明,A制剂的AUC 90%置信区间落在R制剂的80.0% ~125.0%之间,Cmax落在70.0%~143.0%之间,证明受试制剂尼群地平分散片与市售参比制剂资寿(尼群地平片)具有生物等效性,A制剂相对于R制剂的相对生物利用度为(106.7±25.0)%。

表1 20名健康受试者口服单剂量受试制剂和参比制剂20 mg后尼群地平主要药动学参数方差分析结果

表2 20名健康受试者口服单剂量受试制剂和参比制剂20 mg后尼群地平主要药动学参数双向单侧t检验结果(α=0.05)

表3 20名健康受试者口服单剂量受试制剂和参比制剂10 mg后尼群地平 tmax非参数检验结果 (α=0.05)
表4 主要药动学参数结果(±s,n=20)
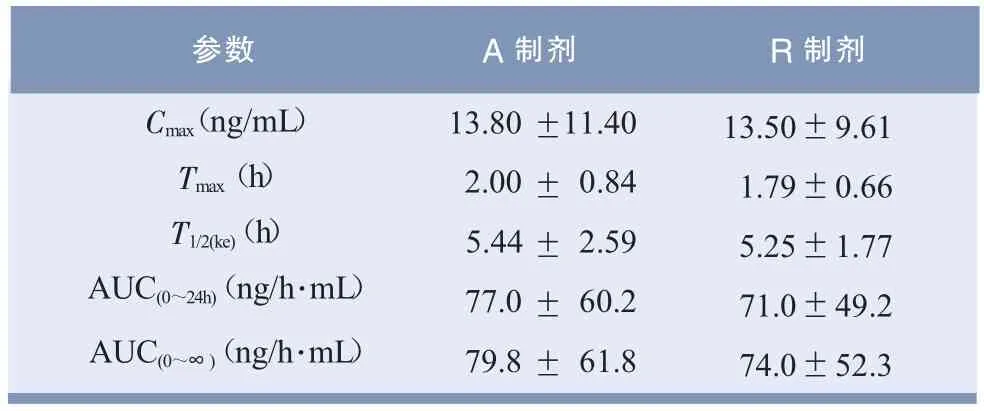
表4 主要药动学参数结果(±s,n=20)
参数 A制剂 R制剂Cmax(ng/mL)Tmax(h)T1/2(ke)(h)AUC(0~24h)(ng/h·mL)AUC(0~∞)(ng/h·mL)13.80 11.40 2.00 0.84 5.44 2.59 77.0 60.2 79.8 61.8±±±±± 13.50±9.61 1.79±0.66 5.25±1.77 71.0±49.2 74.0±52.3
3 讨论
本试验建立的色谱条件分离较好,回收率高,精密度好,方法简便、快捷,适用于尼群地平制剂的人体药动学和尼群地平片(R)的双交叉试验,证明两制剂具有生物等效性;A制剂吸收速度相对较快,与两制剂的剂型不同有关;分散片遇水后可迅速崩解形成均匀的黏性混合液,崩解时间在3min内[6],崩解、吸收、起效均比普通片剂快,可吞服或在水中分散后口服,尤其适合儿童、老年人和吞服困难的患者。
[1] 路西明,王学廷,李丽.尼群地平的药理与临床应用[J].洛阳医专学报,1994,13(3):186-188.
[2]常锦荣.尼莫地平、尼群地平、尼卡地平临床应用与评价[J].药学实践杂志,1996,14(5):271-272.
[3]党爱民,杜江波,明广华,等.中国资寿尼群地平和德国拜尔-尼群地平药代、药效学交叉比较研究[J].中国心血管杂志,1998,3(5):308-311.
[4]林振礼,赵香兰.尼群地平在正常人及肾功能不全的高血压病人的体内消除及药效学比较[J].中国临床药理学杂志,1995,11(3):146-151.
[5]Ying L,Fengguo X,Zunjian Z,et al.Quantitative determination of nitrendipine in human plasma using high-performance liquid chromatography-mass spectrometry[J].Arzneim Forsch Drug Res.2008,58(3):111
[6]崔德福.药剂学[M].5版.北京:人民卫生出版社,2004:112.
Study on Human Bioequivalence of Nitrendipine Dispersible Tablets
Tian Zhiguo1,Ren Jinmin2,Zhang Manli3,Zhang Xiaoli4(1 Hebei Saike Pharmaceutical Co.,Ltd.Shijiazhuang 050021,China;2 The Second Hospital attached Hebei Medical University,050000;3 Department of Natural Product Chemistry,School of Pharmaceutical Sciences,Hebei Medical University,050017;4 Hebei Donghai Yaodu Pharmaceuticals Co.,Ltd.,050011)
Objective:To study the pharmacokinetics and relative bioavailability of nitrendipine dispersible tablets.Methods:Nitrendipine dispersible tablets were compared with Zishou nitrendipine tablets by a randomized crossover design at a single oral dose of 20 mg in 20 healthy male volunteers.The concentration of nitrendipine was determined by LC-MS/MS.Results:The relative bioavailability of dispersible tablets was(106.7±25.0)%.Conclusion:According to the results,nitrendipine dispersible tablets and nitrendipine tablets were bioequivalent.
Nitrendipine;LC-MS/MS;Relative Bioavailability;Bioequivalence
田志国,男,工程师。主要从事药物制剂生产、开发研究工作。E-mail:hbskscb@163.com
