慢病毒载体的构建及低表达和过表达CEA EC9706细胞株的建立
2010-04-06赵国强董子明
郑 红,林 波,赵国强,董子明*
(1.河南大学医学院病理生理教研室,河南 开封 475004;2.郑州大学基础医学院,河南 郑州 450052)
慢病毒载体的构建及低表达和过表达CEA EC9706细胞株的建立
郑 红1,林 波1,赵国强2,董子明2*
(1.河南大学医学院病理生理教研室,河南 开封 475004;2.郑州大学基础医学院,河南 郑州 450052)
目的:构建人癌胚抗原(CEA)慢病毒siRNA和表达载体并包装成感染性病毒颗粒,获得稳定低表达和过表达CEA的EC9706细胞。方法:构建CEA siRNA载体:依据siRNA靶序列设计原则,针对人CEA的cDNA序列,设计并合成编码siRNA的3对寡核苷酸序列,克隆入siRNA载体(pRNA T-U6.2/Lenti)中构建3个重组体pRNAT-U6.2-SCEA。构建CEA表达载体:以人CEA的测序质粒为模板,PCR扩增CEA全长,装入pLentiGFP转移质粒,经过测序证实其序列与标准序列完全一致。然后进行重组慢病毒分别感染EC9706细胞,G418筛选得到稳定感染细胞株。分别用荧光定量Real-time RT-PCR和Western blot检测EC9706细胞中CEA基因表达抑制或增强的效果。结果:EC9706病毒感染48 h后荧光显微镜观察CEA慢病毒载体在细胞中高效表达,经过 RTPCR和Western-blot验证:得到3株稳定CEA低表达的EC9706细胞株,其中一个CEA的表达几乎得到完全抑制,1株稳定CEA过表达的EC9706细胞株(EC9706-CEA)。结论:建立了稳定低表达和过表达CEA的EC9706细胞株,成功调控食管癌EC9706细胞中CEA的表达,为进一步从分子水平探讨CEA的功能奠定了基础。
癌胚抗原;EC9706;慢病毒载体
癌胚抗原(carcinoembryonic antigen,CEA)属于非器官特异性肿瘤相关抗原,它不仅作为一种单纯的肿瘤标志物存在,而且是与肿瘤恶性化有关的一种复杂的分子。但目前对于CEA分子水平的研究主要集中在肿瘤治疗前、治疗中、治疗后CEA表达的变化及其与肿瘤诊断、治疗、预后的关系[1-3]。CEA与肿瘤的发生、发展及转移有无内在联系,对治疗过程有什么影响,文献中未见深入报道。本研究利用RNA干扰和基因重组技术,构建CEA siRNA慢病毒载体,同时构建CEA慢病毒表达载体,感染EC9706细胞,通过筛选得到低表达和过表达 CEA EC9706细胞株。旨在实现对CEA表达的调控,为进一步从分子水平探讨CEA功能及对治疗的影响打下基础。
1 材料与方法
1.1 材料
慢病毒包装细胞株293FT购自美国Invitrogen公司;pCMV-SPORT6-CEA质粒购于proteintech公司;pGEM-T Easy克隆质粒购于Promega公司;pLentiGFP慢病毒表达载体和辅助包装质粒 p△8.2、pVSV-G均由美国NIH职慧军博士惠赠;pRNAT-U6.2/Lenti siRNA表达载体购于GenScript公司;鼠抗人CEA单克隆抗体、鼠抗人β-actin多克隆抗体及酶标抗鼠IgG(辣根过氧化物酶标记的抗小鼠IgG抗体)为美国Santa Cruz公司产品。
1.2 方法
1.2.1 构建针对CEA基因的siRNA慢病毒载体设计靶向 CEA基因的寡核苷酸:利用 Takara和promega siRNA靶序列分析设计系统,扫描人CEA cDNA编码序列(NM_004363),根据siRNA靶序列设计原则,CEA基因siRNA靶序列最终确定为3个,分别是 341-359、1155-1173和 1281-1298。分别合成3对shDNA单链,两端加上BamHI和XhoI内切酶残基,由上海博尚生物公司合成。发卡DNA复性,纯化;酶切并回收双粘线性化pRNAT-U6.2/Lenti质粒;退火产物(双链发卡DNA),与双粘线性化siRNA表达载体 pRNAT-U6.2/Lenti连接;转化,转板;PCR初步筛选,阳性克隆测序鉴定。
1.2.2 构建表达CEA基因的慢病毒载体 引物设计、合成:参考GenBank的CEA基因序列设计出1对CEA全基因扩增引物,引物序列如下:上游,5′ACTCGAGATGGAGTCTCCCTCGGCCCCTCCC 3′;下游 ,5′CAAGCTTCTATATCAGAGCAACCCCAACCAGCAC 3′。重组慢病毒载体转移质粒pLentiGFP-CEA的构建、鉴定和测序:分别用 XhoL和HindⅢ双酶切pGEM-T-CEA和慢病毒载体pLentiGFP后,胶回收得到双粘片段和双粘线形载体pLentiGF;将双粘CEA片段与羟化后的双粘线形载体pLentiGFP连接得重组载体pLentiGFP-CEA;以CEA全基因引物PCR扩增,鉴定是否插入目的基因;提取质粒送测序。
1.2.3 重组慢病毒包装 制备重组体质粒(pRNAT-U6.2/Lenti-sC341、pRNAT-U6.2/Lenti-sC-1155、pRNAT-U6.2/Lenti-sC1281及 pLentiGFP-CEA)及空载体质粒,纯化产物经紫外光栅分光仪测定各质粒浓度。分别与包装质粒p△8.2、pVSV-G共转染293ET细胞;收集病毒上清,纯化后测定其病毒滴度。
1.2.4 过表达和低表达CEA EC9706细胞株的建立 复苏培养EC9706细胞,待细胞处于对数生长期时,分组分别加入包装的慢病毒,相当于每个细胞10个病毒的感染量。感染48 h后免疫荧光显微镜下观察细胞内荧光情况。G418筛选后,建立稳定表达的细胞株。
1.2.5 RT-PCR扩增鉴定 收集各组重组慢病毒感染和对照未感染的EC9706,提取RNA,逆转录得到cDNA,采用嵌合荧光检测法,根据Real time PCR试剂盒(TaKaRa公司)与扩增仪(ABI5700型)说明,配制荧光定量PCR反应体系,以CEA全基因引物进行PCR扩增。以CEA基因拷贝数与β-actin基因拷贝数比值计算其相对表达量。
1.2.6 Western-blot检测CEA表达 分别收集各组EC9706细胞,离心沉淀后作匀浆及超声破碎处理,并使蛋白变性;SDS-PAGE凝胶电泳样品,当蓝色条带消失时半干法转移凝胶至硝酸纤维素膜(NC),封闭硝酸纤维素膜;加入人CEA单克隆抗体,4℃过夜;加入酶标二抗,慢摇2 h,显影,定影;用βactin作内参照验证蛋白的含量。
2 结果
2.1 CEA mRNA表达检测结果
荧光定量RT-PCR检测,各组细胞CEA mRNA表达水平,结果及比较见表1、图1。EC9706-sCEA341、EC9706-sCEA1155和 EC9706-sCEA12813组细胞CEA mRNA表达都受到抑制,其中EC9706-sCEA1281组细胞的抑制效果最强。EC9706-CEA组细胞CEA mRNA表达明显增强,而2个对照组(EC9706-siCon和 EC9706-Con)细胞中都存在较高水平的CEA mRNA表达,与空白对照组细胞对比CEA mRNA无显著差异。
实验组1~3:感染pRNAT-U6.2/Lenti-sC341、pRNAT-U6.2/Lenti-sC1155和pRNAT-U6.2/Lenti-sC1281包装产生的慢病毒颗粒,经过G418筛选得到了3株稳定转染不同靶区段沉默CEA表达的EC9706细胞株,分别命名为 EC9706-sCEA341、EC9706-sCEA1155、EC9706-sCEA1281。实验组 4:pRNAT-U6.2/Leni空载体包装产生的慢病毒颗粒感染并筛选得到的EC9706细胞株,命名为EC9706-siCon。实验组5:pLentiGFP-CEA包装产生的慢病毒颗粒感染,并筛选得到的EC9706细胞株,命名为EC9706-CEA。实验组6:pLentiGFP空载体包装产生的慢病毒颗粒感染并筛选得到的EC9706细胞株,命名为EC9706-Con。空白对照组:未转染的正常食管癌EC9706细胞。
表1 各组中CEA mRNA的相对含量(n=6)
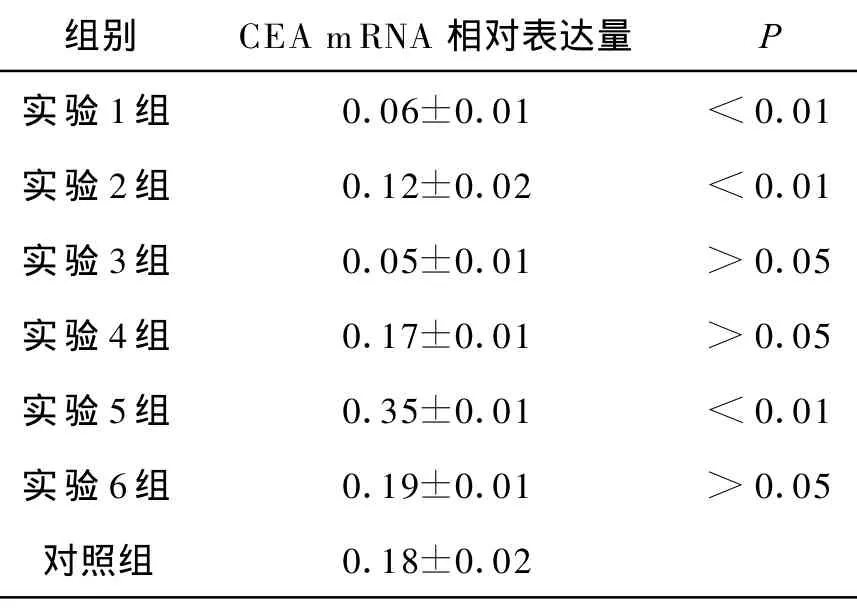
表1 各组中CEA mRNA的相对含量(n=6)
注:P为各组与空白对照组比较。
实验1组 0.06±0.01 <0.01实验2组 0.12±0.02 <0.01实验3组 0.05±0.01 >0.05实验4组 0.17±0.01 >0.05实验5组 0.35±0.01 <0.01实验6组 0.19±0.01 >0.05对照组 0.18±0.02
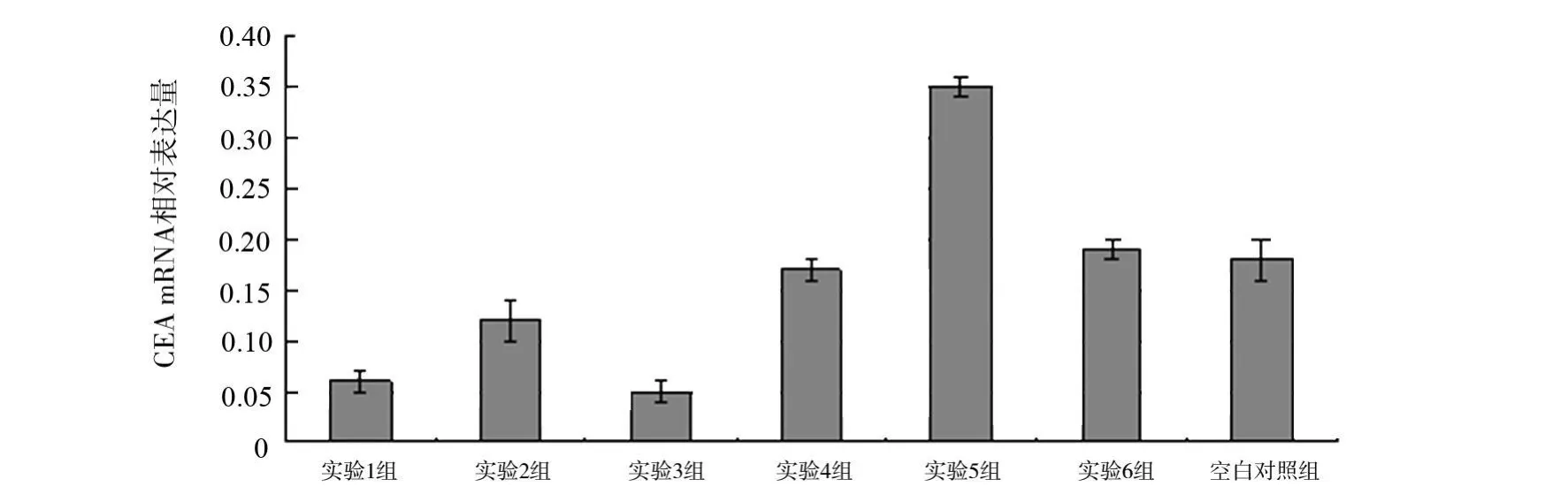
图1 慢病毒感染细胞CEAmRNA相对表达量比较

图2 各组细胞CEA Western blot结果
2.2 CEA免疫印迹(Western blot)结果
6个实验组(EC9706-sCEA341、EC9706-sCEA1155、EC9706-sCEA1281、EC9706-siCon 、EC9706-CEA 和EC9706-Con)和未感染组(EC9706)CEA蛋白印迹结果见图2。EC9706-sCEA341、EC9706-sCEA1155和EC9706-sCEA1281细胞中CEA蛋白均显示抑制,其中EC9706-sCEA1281组细胞的抑制效果最强,EC9706-siCon和EC9706-Con CEA细胞中都存在较高水平的CEA蛋白表达,与未感染组(EC9706)对比CEA蛋白无显著差异,而EC9706-CEA组细胞CEA蛋白与未感染组(EC9706)对比明显增高。所有印迹出现位置约为180kDa处,与人CEA蛋白分子量一致。
3 讨论
RNA干扰(RNA interference,RNAi)是近年发现的一种重要基因沉默技术,又称转录后基因沉默(posttranscriptional gene silencing,PTGS)[4]。RNAi技术近年来发展迅速,已成为分子生物学研究的主要技术手段之一,在功能基因组研究、信号转导研究及基因治疗方面显示出巨大的前景。实验结果表明根据CEA基因序列设计的短发卡状寡核苷酸序列能特异性快速有效地封闭CEA基因的表达。实验中设计的3个靶向siRNA寡核苷酸所达到抑制CEA表达的作用有差异,是因为依据siRNA设计原则常选择起始密码子下游第50~100个碱基以后一段cDNA序列作为靶点,研究[5]证明针对同一基因不同位置的cDNA序列所设计的siRNA对于该基因的抑制效应有着很大差别。本实验也证实了这一点,sC341、sC1281对EC9706细胞CEA均有很好的抑制作用,sC1155则抑制CEA基因的效果不好,与前两个序列有显著差异。
基因工程的最终目的是将外源基因转移到宿主细胞中高效稳定表达。本研究所采用的慢病毒载体是近年来出现的一种新的基因转移工具,多种研究[6-8]证实它可以在分裂和非分裂哺乳动物细胞中进行稳定的高水平基因表达,感染效率高,表达稳定,自身抗原性弱,可操控性强。目前,慢病毒载体经过不断改造优化,在生物安全性、病毒滴度及靶细胞嗜性范围方面均有提高,能够提供高效的基因转移和长期稳定的蛋白表达。本实验中慢病毒载体采用三质粒系统进行构建,包括转移质粒、包装质粒和包膜蛋白质粒,其中转移质粒中含有包装、逆转录及整合所需的顺式序列,保留多克隆位点,在其中插入目的基因CEA;包装质粒在CMV启动子的控制下,表达病毒复制所需的全部反式激活蛋白,但不产生病毒包膜蛋白及辅助蛋白VPU;包膜蛋白质粒编码水疱性口炎病毒-G糖蛋白(VSV-G),应用VSV-G包膜的假构型慢病毒载体一方面降低病毒自我复制能力,提高生物安全性,另一方面拓宽与靶细胞的亲合力,增加了载体的稳定性,能够允许通过高速离心对其进行浓缩,提高病毒滴度和活性,使真核转染成功率大为提高。实验中选用来源于人胚肾细胞系的293T包装细胞完成对慢病毒载体三质粒系统的包装,使其在包装过程中能反式提供产生病毒颗粒所需的蛋白,并且由于引入VSV-G包膜的假构型载体,极大地提高了细胞亲合性和稳定性。
本实验构建了CEA siRNA和表达慢病毒载体并成功地感染 EC9706细胞,经 RT-PCR扩增和Western Blot方法从mRNA和蛋白质水平检测均表明获得了稳定低表达和过表达CEA EC9706细胞株,实现了对EC9706细胞中CEA表达水平的调控,为进一步探讨CEA的作用机制奠定了基础。
[1]Suouchi K,Machinami R,Mori M,et al.Clinical impact of carcinoembryonic antigen messenger ribonucleic acid expression in tumor-draining vein blood on postoperative liver metastasis in patients with colorectal carcinoma:A prospective,cohort study[J].Dis Colon Rectum,2003,46(4):467-473.
[2]Ni XG,Bai XF,Mao YL,et al.The clinical value of serum CEA,CA19-9,and CA242 in the diagnosis and prognosis of pancreatic cancer[J].Eur J Surg Oncol,2005,31(2):164-169.
[3]Kita H,Koshiishi Y,Masui K,et al.Risk factors of recurrence in resected stage I non-small cell lung cancer[J].Kyobu Geka,2007,60(10):883-887.
[4]Agrawal N,Dasaradhi PV,Mohmmed A,et al.RNA interference:biology mechanism and applications[J].Microbiolmol Biol Rev,2003,67(4):657-685.
[5]Aronin N.Target selectivity in mRNA silencing[J].Gene Ther,2006,13(6):509-516.
[6]Buchschacher GL Jr,Wong-Staal F.Development of lentiviral vector for gene therapy for human diseases[J].Blood,2000,95(8):2499-2504.
[7]Follenzi A,Gupta S.The promise of lentiviral gene therapy for liver cancer[J].J Hepatol,2004,40(2):337-340.
[8]Wiznerowicz M,Trono D.Harnessing H IV for therapy,basic research and biotechnology[J].Trends Biotechnol,2005,23(1):42-47.
[责任编辑 姬 荷]
Construction of lentiviral vector and establishment of stable EC9706 cell lines with lower or higher CEA expression
ZHENG Hong1,LIN Bo1,ZHAO Guo-qiang2,DONG Zi-ming2*(1.Department of Pathophysiology,Medical College of Henan University,K aifeng,Henan 475004,China;2.School of Basic Medical Science,Zhengzhou University,Zhengzhou,Henan 450052,China)
Objective:To construct CEA siRNA vector and CEA expression vector,to package lentivirus particles,and to establish stable EC9706 cell lines with lower or higher CEA expression.Methods:Construction of CEA siRNA expression vector:according to the principle of designing siRNA sequence,aimed at human CEA cDNA sequence,three DNA oligonucleotides of short hairpin RNA sequence were synthesized,three hairpin DNAs were cloned into siRNA expression vector(pRNAT-U6.2/Lenti).Construction of CEA expression vector:CEA gene sequence was amplified as target gene from plasmid which contains CEA gene by PCR,ligated with lentiviral vector plasmid pLentiGFP and verified by sequencing.And then recombinated lentivirus were produced:the esophageal carcinoma EC9706 cell lines were infected respectively by lentivirus particles,the infected stable cell lines were established by G418 screening.The silencing and reinforcing expression of CEA was detected by real time RT-PCR and Western blotting.Results:The recombinant lentivirus high expression in EC9706 cells was observed through fluorescence microscope after 48h infection,verificated by real-time RT-PCR and Western-blot:Three stable EC9706 cell lines with lower CEA expression were established,among them,one was the best,its CEA expression was about completely depressed.Meanwhile EC9706 cell line with CEA overexpression was also established.Conclusion:Stable EC9706 cell lines with lower or higher CEA expression are established,CEA expression in EC9706 cells are successfully regulated.This facilitates further functional studies of CEA atmolecular level.
CEA;EC9706;Lentiviral vector
R73.3
A
1672-7606(2010)03-0160-04
2010-06-20
教育部科技创新工程重点项目(207150)
郑红(1970-),女,河南 开封 人,博士,副教授,从事肿瘤的发病机制及生物治疗的研究。
*通讯作者:董子明(1953-),男,河南宝丰人,教授,博士生导师,从事分子肿瘤学研究。
