氢氧化铝佐剂与甲型肝炎病毒抗原吸附条件的优化及吸附产物免疫原性评价
2024-01-02王艺博夏青娟王昕雷徐涵禹白鸽郑书君徐艳玲
王艺博,夏青娟,王昕雷,徐涵禹,白鸽,郑书君,徐艳玲
长春生物制品研究所有限责任公司疫苗二室,吉林 长春 130012
甲型病毒性肝炎(hepatitis A,简称甲肝),是由甲型肝炎病毒(hepatitis A virus,HAV)引起的一种以肝脏损伤为主的急性肠道传染性疾病[1]。甲肝多为自限性疾病[2],主要通过“粪-口”途径传播[3],主要临床表现为黄疸、发热、恶心、肝功能异常等症状[4]。据WHO 统计,每年约有150 万人感染HAV[5]。甲肝大规模流行与暴发将严重影响人民生命健康和生活水平,预防和控制甲肝流行的最有效手段是接种甲肝疫苗[6]。
采用以铝为基础的复合物作为佐剂增强疫苗免疫效果,已广泛应用于各类疫苗的生产制备[7]。铝佐剂通常分为3 种,包括氢氧化铝[Al(OH)₃]、磷酸铝和明矾,其中Al(OH)₃应用最广泛,已被国际公认为安全、有效的佐剂之一[8]。Al(OH)₃对抗原有吸附作用,大部分疫苗中,Al(OH)₃对抗原吸附率越高,其免疫效果越好,但也存在吸附率过高不利于抗原释放,反而影响免疫效果的情况[9-10]。本研究采用单因素筛选及正交试验对Al(OH)₃佐剂与HAV抗原吸附条件进行优化,并通过动物实验初步评价吸附产物的免疫效果。
1 材料与方法
1.1 原液 HAV 原液(经灭活、层析纯化)由长春生物制品研究所有限责任公司疫苗二室提供。
1.2 主要试剂 Al(OH)₃佐剂Alhydrogel®购自丹麦Croda Denmark 公司;磷酸氢二钠(Na2HPO4)及磷酸二氢钠(NaH2PO4·H2O)均购自湖南九典制药股份有限公司;氯化钠(NaCl)购自天津海光药业股份有限公司;HAV 抗原定量检测试剂盒(ELISA 法)及HAV抗体定性检测试剂盒(ELISA 法)均购自北京万泰生物药业股份有限公司。
1.3 实验动物 SPF 级NIH 小鼠,雌雄各半,3~4 周龄,体质量14~16 g,由长春生物制品研究所有限责任公司实验动物室提供,动物许可证号为:SCXK(吉)-2017-0005。本实验均以科研为目的进行小鼠的养殖和使用,且按照动物伦理相关规定进行。
1.4 Al(OH)₃佐剂与HAV抗原吸附条件的单因素筛选
1.4.1 缓冲盐终摩尔浓度的确定 用PBS 分别稀释Al(OH)₃溶液和HAV 原液,调节pH 为6.3。将稀释的Al(OH)₃溶液加至稀释的HAV原液中,以等体积分数混合,使铝含量终浓度为0.5 mg/mL,HAV抗原终含量为1∶1 024,NaCl终摩尔浓度为0.15 mol/L,缓冲盐终摩尔浓度分别为0.01、0.02 和0.04 mol/L。将样品充分振荡,2~8 ℃吸附24 h(间歇振荡),检测吸附效果。试验重复3次。
1.4.2 pH的确定 按1.4.1项方法制备及检测样品,其中样品缓冲盐终摩尔浓度为0.01 mol/L,pH 分别设为5.5、6.0、6.5、7.0、7.5、8.0。
1.4.3 NaCl 终摩尔浓度的确定 按1.4.1 项方法制备及检测样品,其中样品缓冲盐终摩尔浓度为0.01 mol/L,NaCl 终摩尔浓度分别设为0.075、0.13、0.15、0.17、0.45、0.75、1.0 mol/L。
1.4.4 混合方式的确定 共制备2组样品(A和B组),A组的混合方法同1.4.1项;B组样品用HAV 原液直接稀释Al(OH)₃溶液,其他过程同1.4.1 项。2 组样品缓冲盐终摩尔浓度均为0.01 mol/L。
1.4.5 滴加顺序的确定 共制备2组样品(A和B组),A组为HAV原液滴加至Al(OH)₃溶液中;B组为Al(OH)₃溶液滴加至HAV原液中。其他过程同1.4.1项。2 组样品缓冲盐终摩尔浓度为0.01 mol/L。
1.5 Al(OH)₃佐剂与HAV抗原吸附条件的正交试验设计 基于单因素筛选结果,以pH 及缓冲盐和NaCl 终摩尔浓度为影响因素,Al(OH)₃吸附率为评价指标,进行3 因素3 水平正交试验设计,见表1,共设计9 组试验,见表2。同1.4.1 项方法配制正交试验样品,混合方式及滴加顺序为将HAV 原液滴加至Al(OH)₃溶液中。
1.6 吸附效果的检测 根据《中国药典》三部(2020版)甲肝灭活疫苗半成品检定方法进行铝吸附效果测定[11]。吸附样品经400×g离心3 min,取上清液,采用HAV 抗原定量检测试剂盒(ELISA 法)检测上清中抗原浓度,并按下式计算Al(OH)₃吸附率,吸附率应>95%。

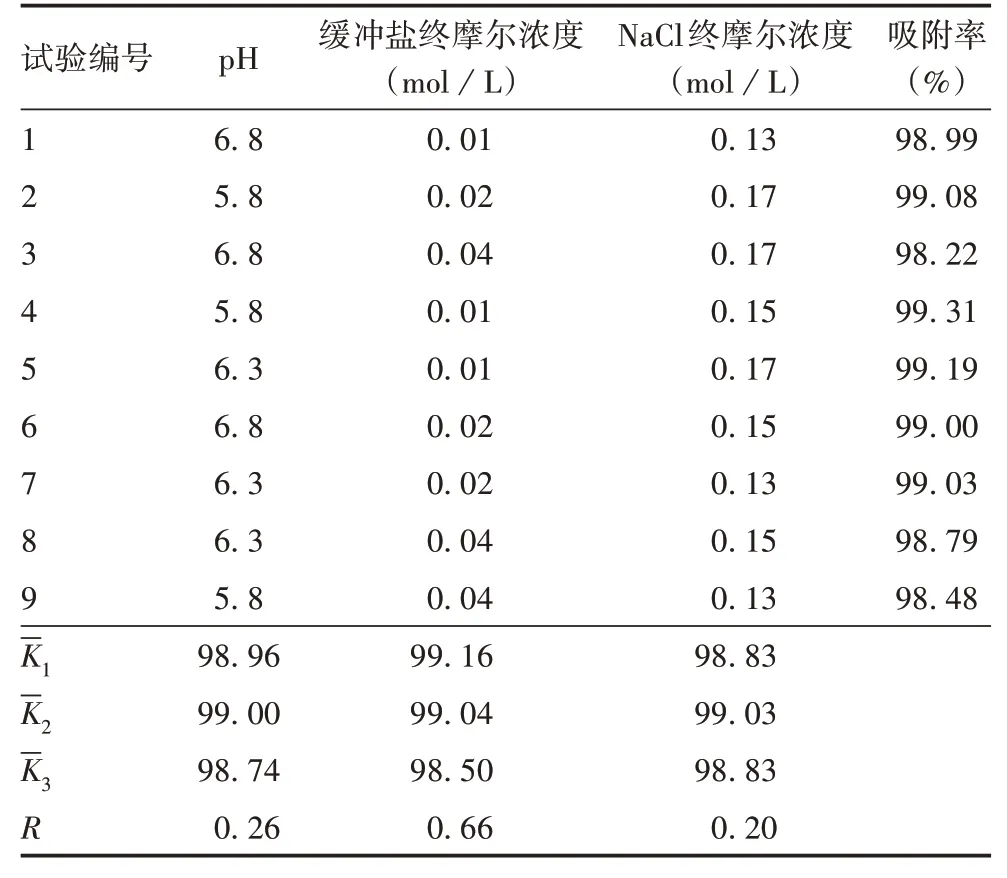
1.7 免疫原性的检测 采用最优和次优组合制备吸附样品,分别经腹腔免疫NIH 小鼠,0.5 mL/只,同时设阴性对照组[仅免疫Al(OH)₃溶液]及空白对照组(不免疫),每组10 只,雌雄各半。于免疫后28 d,经眼球或心脏采血,分离血清,采用HAV 抗体定性检测试剂盒(ELISA 法)检测HAV 抗体水平。以样品A450/630 1.8 统计学分析 应用SPSS 26.0软件进行统计学分析,组间比较采用单因素方差分析、LSD多重比较及独立样本t检验,以P< 0.05 为差异有统计学意义。正交试验结果采用方差分析方法,以F和P(F越大,P越小,表明因子对结果影响力越大)结合极差R(R值越大表明因子对结果影响力越大)判断因子对吸附效果的影响,再根据K(K最大值为最优水平)筛选出最优和次优组合。 2.1 Al(OH)₃佐剂与HAV 抗原吸附条件的单因素筛选 2.1.1 缓冲盐终摩尔浓度的确定 0.01、0.02 和0.04 mol/L组样品的Al(OH)₃吸附率分别为99.51%、99.37%和98.70%,均>95%。经单因素方差分析,3组间Al(OH)₃吸附率差异有统计学意义(F= 6.582,P=0.031);经LSD多重比较,0.02 和0.01 mol/L组Al(OH)₃吸附率明显高于0.04 mol/L 组(P分别为0.015 和0.031),0.01 与0.02 mol/L 组间差异无统计学意义(P= 0.579)。表明缓冲盐终浓度为0.01和0.02 mol/L时吸附效果较好。 2.1.2 pH的确定 pH 5.5、6.0、6.5、7.0、7.5、8.0组Al(OH)₃吸附率分别为99.04%、99.32%、99.32%、99.27%、98.66%和98.36%,均>95%。经单因素方差分析,6 组间Al(OH)₃吸附率差异有统计学意义(F=14.007,P=0.001);经LSD多重比较,pH 5.5、6.0、6.5和7.0组间差异均无统计学意义(P=0.083~0.983),pH 7.5 和8.0 组间差异无统计学意义(P= 0.066),pH 5.5~7.0组均明显高于pH 7.5~8.0组(P=0.01~0.30)。表明Al(OH)₃吸附HAV 抗原的最适pH 为5.5~7.0。 2.1.3 NaCl 终摩尔浓度的确定 NaCl 终摩尔浓度0.075、0.13、0.15、0.17、0.45、0.75、1.0 mol/L 组的Al(OH)₃吸附率分别为98.68%、99.04%、99.35%、99.21%、98.66%、91.85%和94.03%,其中0.13、0.15、0.17 mol/L组均>99%。经单因素方差分析,7组间Al(OH)₃吸附率差异有统计学意义(F= 8.612,P=0.001);经LSD多重比较,NaCl终摩尔浓度0.075、0.13、0.15、0.17 和0.45 mol/L 组间差异均无统计学意义(P= 0.652 ~ 0.991),0.75 与1.0 mol/L 组差异无统计学意义(P= 0.158),0.075、0.13、0.15、0.17 和0.45 mol/L 组明显高于0.75 和1.0 mol/L 组(P=0.001~0.007)。表明Al(OH)₃吸附HAV抗原的最适NaCl终摩尔浓度为0.13~0.17 mol/L。 2.1.4 混合方式的确定 A和B组的Al(OH)₃吸附率分别为99.15%和99.25%,均>99%,两组差异无统计学意义(t=-0.696,P=0.525)。表明两种混合方式对Al(OH)₃佐剂吸附HAV抗原的效果无影响。 2.1.5 滴加顺序的确定 A和B组的Al(OH)₃吸附率分别为99.02%和98.67%,两组差异无统计学意义(t=1.153,P=0.313)。表明不同滴加顺序对Al(OH)₃佐剂吸附HAV抗原的效果无影响。 2.2 正交试验结果 9 组试验的Al(OH)₃吸附率均>95%,其中1、3、8和9组<99%,其他组均>99%。对正交试验结果进行方差分析,各因子主体间效应检验中仅有缓冲盐终摩尔浓度对Al(OH)₃吸附率影响显著(F=48.978,P=0.02),pH 和NaCl 终摩尔浓度结果不显著(F分别为7.925和5.298,P分别为0.112和0.159),确定3因素影响Al(OH)₃吸附率大小依次为:缓冲盐终摩尔浓度> pH > NaCl 终摩尔浓度,与极差R值反应结果一致。根据K值得出最优组合为:pH 6.3+缓冲盐终摩尔浓度0.01 mol/L+NaCl终摩尔浓度0.15 mol/L,次最优组合为:pH 5.8 +缓冲盐终摩尔浓度0.02 mol/L + NaCl 终摩尔浓度0.17 mol/L。见表3。 表3 正交试验结果Tab.3 Results of orthogonal tests 2.3 小鼠血清的抗体水平 Cutoff值参考品的A450/630为1.166。最优和次优组合组小鼠血清抗体A450/630均<1.166,全部阳转(各10 只),阳转率均为100%;阴性对照组和空白对照组小鼠血清抗体A450/360均≥1.166,阳转数量及阳转率均为0。表明优化条件制备的吸附样品具有良好的免疫原性。 铝盐或Al(OH)₃自确定可作为佐剂以来[12],已广泛应用于人用疫苗,包括细菌类疫苗(百白破疫苗)及病毒类疫苗(甲型肝炎疫苗、乙型肝炎疫苗、森林脑炎疫苗、出血热疫苗和新型冠状病毒疫苗等)[13],且安全性良好[14-15]。虽然铝佐剂在抗原提呈细胞中的佐剂效应机制尚未明确[16],但其增强疫苗免疫效果的能力是明确的。铝佐剂应用范围涵盖传统疫苗及基因工程类疫苗,包括近年已上市和研发的新型冠状病毒疫苗。Al(OH)₃佐剂吸附抗原的方式主要有静电吸引、疏水作用和配基交换[17],不同吸附方式的吸附效果不同。有文献报道,Al(OH)₃佐剂吸附效果对其发挥免疫增强作用具有重要影响[18]。影响Al(OH)₃疫苗吸附能力的因素主要有抗原含量、pH、缓冲液离子浓度等。理论上,将Al(OH)₃与抗原在其最适吸附条件下进行混合,可增强疫苗的免疫效果。 目前,国内外甲肝灭活疫苗,除了瑞士Crucell Switzerland AG 研制的爱巴苏®使用脂质体佐剂[免疫增强性重组流感病毒体(immunopotentiating reconstituted influenza virosomes,IRIVs)]以外,其他均使用铝佐剂。本研究以HAV原液为基础,为优化Al(OH)₃与HAV 抗原的最适吸附条件,选取缓冲盐终摩尔浓度、pH、NaCl 终摩尔浓度、混合方式及滴加顺序等因素进行单因素筛选,以Al(OH)₃吸附HAV 抗原的吸附效果为指标进行评价,再通过正交试验对筛选出的因素进行优化,并采用最优及次优组合条件制备吸附样品,检测其在小鼠体内的免疫原性。单因素筛选结果表明,缓冲盐终摩尔浓度、pH、NaCl终摩尔浓度对Al(OH)₃吸附HAV 抗原影响较大,最适吸附条件分别为:缓冲盐终摩尔浓度为0.01 和0.02 mol/L、pH 为5.5~7.0、NaCl 终摩尔浓度为0.13~0.17 mol/L。混合方式和滴加顺序对吸附效果无影响。正交试验结果显示,影响Al(OH)₃吸附率大小的因素依次为:缓冲盐终摩尔浓度>pH > NaCl 终摩尔浓度,根据K得到Al(OH)₃吸附HAV 抗原最优组合为:pH 6.3+缓冲盐终摩尔浓度0.01 mol/L + NaCl 终摩尔浓度0.15 mol/L,次优组合为:pH 5.8+缓冲盐终摩尔浓度0.02 mol/L+NaCl 终摩尔浓度0.17 mol/L。最优及次优组合组小鼠血清抗体阳转率均为100%,表明吸附样品具有良好的免疫原性。 本研究初步优化了Al(OH)₃佐剂与HAV 抗原的吸附条件,且吸附产物具有良好的免疫原性。本研究为甲肝灭活疫苗的研究提供了参考,后续还将在抗体含量及是否产生细胞免疫等方面进行深入研究。2 结果
3 讨论
