G蛋白耦联受体激酶2在MPTP诱导的PD模型小鼠纹状体中的作用机制
2023-10-10周畅王埮许叶赵振强张海英马媛媛陈志斌
周畅 王埮 许叶 赵振强 张海英 马媛媛 陈志斌
(1海南医学院第一附属医院神经内科,海南 海口 570102;2海南医学院;3海南热带脑科学研究与转化重点实验室)
帕金森病(PD)是由于中脑黑质区多巴胺能神经元的丢失导致分泌至纹状体区多巴胺不足所引起的一系列症状的中枢神经系统退行性疾病〔1〕。目前主要的治疗药物是外源性补充多巴胺或通过激活多巴胺受体来改善PD症状,多巴胺主要通过作用于纹状体的中棘神经元的多巴胺受体参与运动功能的调控,其中表达多巴胺2受体(D2R)的神经元所介导的间接通路对运动功能调节十分重要〔2〕。D2R下游通路调节存在功能选择偏向性,其功能和调节机制非常复杂。大多数条件下D2R激动后通过G蛋白介导的信号通路引起下级信号级联反应,但当G蛋白耦联受体激酶(GRK)2升高时D2R偏向于通过与β-抑制蛋白结合介导信号传递〔3〕。GRK2在多种组织中表达,并参与许多细胞和生理过程。GRK2参与线粒体介导的细胞凋亡和细胞存活机制调节,其上调或下调与多种疾病的发病机制密切相关,如心血管疾病、糖尿病、肿瘤〔4~7〕。但是截至目前,GRK2在PD发病过程中扮演何种角色尚不清楚,本文使用1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)制备慢性PD小鼠模型,探究纹状体D2R和GRK2蛋白表达情况,为进一步探讨GRK2在PD发病中的作用机制奠定理论基础。
1 材料与方法
1.1实验小鼠 20只雄性SPF级C57BL/6小鼠,体质量(20.75±0.86)g,约8周龄,由长沙市天勤生物技术有限公司提供。在室温(22±2)℃和相对湿度为(60±2)%的环境中饲养,12~12 h人工昼夜节律,小鼠自由饮水和取食。
1.2主要材料和仪器 MPTP购自美国Sigma公司;兔抗酪氨酸羟化酶(TH)抗体、兔抗磷酸甘油醛脱氢酶(GAPDH)抗体、山羊抗兔抗体购自英国Abcam公司;兔抗D2R抗体购自美国博士德生物公司;兔抗GRK2购自美国GeneTex 公司;苯甲基磺氟(PMSF)、RIPA蛋白裂解液、磷酸酶抑制剂、电化学发光(ECL)底物试剂盒购自中国biosharp公司;Millipore的聚偏氟乙烯(PVDF)膜;全自动凝胶图像分析系统使用上海tanon科技有限公司;小鼠旷场实验轨迹分析仪器购自上海欣软信息科技有限公司;自制小鼠爬杆实验器材。
1.3分组和模型制备 20只雄性小鼠适应性喂养1 w后随机分为两组,每组10只,PD模型组小鼠腹腔注射MPTP 30 mg/kg(MPTP配成3 mg/ml浓度溶液备用),对照组腹腔注射0.2 ml等体积生理盐水,2次/w,共5 w,共10次。MPTP腹腔注射给药结束后,对所有小鼠进行行为学检测,评估运动功能和焦虑行为。
1.4旷场实验 将小鼠单独放置在场地中央由白色亚克力板构成的露天场地(45 cm×45 cm×40 cm),正上方放置摄像机使用视频跟踪软件(Smart3.0)分析记录,分析仪自动分析小鼠行为轨迹,包括活动总距离、穿越中心格次数和距离,每只小鼠观察5 min。为消除前只小鼠残留气味的影响,两次实验间用 75%酒精和水清洁。
1.5爬杆实验 自制长50 cm、直径1 cm的木杆顶端放置直径2.5 cm泡沫小球,木杆表面用纱布缠绕。正式实验开始前对小鼠进行为期3 d的适应性训练,将小鼠头朝上放在球顶端,记录小鼠双前肢接触平台的时间。重复3次,取平均值,每次实验间隔大于1 min。若本次实验小鼠中途停顿或调转方向则此次结果不计。
1.6酶联免疫吸附试验(ELISA)和Western印迹检测 小鼠麻醉后眼球取血,冰上取黑质和纹状体,液氮速冻后放-80 ℃保存。精确称取脑组织后按比例放入PMSF、RIPA后匀浆器研磨、超声裂解,冰上摇床15 min,4 ℃离心15 min,提取上清液,得到总蛋白。二喹啉甲酸(BCA)试剂盒测蛋白浓度(中国碧云天)。取血清和中脑黑质蛋白提取物进行ELISA检测,具体步骤参照试剂盒(购自英国Abcam公司)。纹状体提取总蛋白按比例加入上样蛋白缓冲液,煮沸4 min。每孔加入40 μg蛋白,8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),PVDF转膜90 min,常温封闭,一抗(抗TH抗体、抗GRK2抗体、抗D2R抗体)孵育过夜,次日Tris盐酸缓冲液吐温(TBST)洗膜后室温孵育二抗90 min后显影。采用ImageJ进行条带灰度值分析。
1.7免疫组化 小鼠5 %水合氯醛麻醉后冰生理盐水和多聚甲醛溶液灌注后取脑,多聚甲醛固定24 h后,石蜡包埋分别制备中脑黑质和纹状体部位蜡块。石蜡切片厚度约5 μm,经脱蜡复水、抗原修复、血清封闭等步骤后,一抗(抗TH抗体、抗GRK2抗体、抗D2R抗体)4 ℃孵育过夜,二抗常温孵育1 h,二氨基联苯胺(DAB)显色,苏木素复染,乙醇梯度脱水,二甲苯透明后封片(期间避免干片)。显微镜下观察染色情况,采用ImageJ进行平均光密度(AOD)值测量分析。
1.8统计学分析 采用SPSS20.0软件进行独立样本t检验,GraphPad prism8和Adobe illustrator软件制图。
2 结 果
2.1MPTP影响运动功能和焦虑行为 在旷场实验中,与对照组比较,模型组自发活动总距离、穿越中心格次数和距离明显减少(P<0.001)。在爬杆实验中,模型组爬杆时间比对照组明显延长(P<0.001)。见表1。

表1 两组旷场实验、爬杆实验比较
2.2MPTP降低血清和中脑TH酶含量 ELISA结果显示,与对照组(166.17±2.50、203.81±3.30)比较,模型组血清及中脑TH值(149.12±2.95、156.38±4.54)显著降低(均P<0.001)。黑质部位组化图谱可见,与对照组(0.56±0.20)相比,模型组多巴胺神经元TH染色变浅,通过ImageJ得出AOD值(0.42±0.42)显著降低(t=5.81,P= 0.003)。见图1。
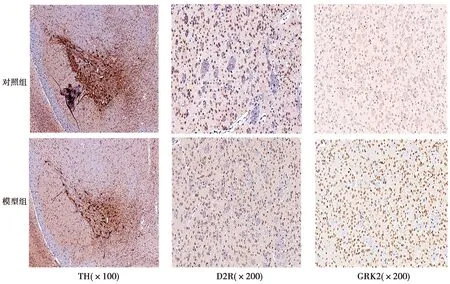
图1 两组TH、D2R及GRK2免疫组化
2.3MPTP减少小鼠纹状体D2R表达 Western印迹显示,模型组纹状体D2R表达较对照组显著减少(P<0.05);免疫组化显示,模型组纹状体D2R的AOD值较对照组显著降低(P<0.001)。见图1、图2、表2。

图2 Western印迹检测两组D2R及GRK2蛋白表达

表2 两组D2R及GRK2表达比较
2.4MPTP增加纹状体GRK2蛋白表达 Western印迹显示,模型组纹状体GRK2蛋白表达较对照组明显增高(P<0.05);免疫组化显示,模型组纹状体GRK2的AOD值较对照组明显增高(P<0.001)。见图1、图2、表2。
3 讨 论
PD是一种同时累及运动和非运动系统的慢性神经系统退行性疾病,其累及的人口数量随年龄的增加成倍增长,在 45~54 岁的人群中男性和女性的患病率均不到 1%,而在 85 岁以上的人群中男性和女性的患病率分别为4%和2%〔8〕。多巴胺能神经元的丢失是目前公认的病理标准,导致多巴胺能神经网络失衡是引起临床症状的重要原因〔9〕。研究表明,多巴胺信号主要通过D1R和D2R传递信号,其中在纹状体表达D1R的中棘神经元参与的信号传导通路又称为直接通路,促进恰当的行为、习惯;表达D2R的神经元参与调节的通路又称为间接通路,主要抑制不恰当的行为、习惯〔10~12〕。在PD状态下多巴胺对两种通路的选择是存在偏倚的〔13〕。PD的发病与多种信号通路相关,其发病机制复杂至今尚未阐明,目前的治疗主要是补充脑内多巴胺的不足及针对D2R的激动剂来改善PD患者临床症状〔14〕,因此进一步研究D2R相关通路是今后的重点。
PD多以肌强直、姿势异常、静止性震颤、运动迟缓等为主要运动功能障碍伴或不伴焦虑、抑郁、嗅觉减退等非运动症状〔15〕。研究表明,MPTP可针对性的损害多巴胺能神经元的线粒体导致出现哺乳动物出现类PD的症状,其诱导的慢性PD动物模型除运动症状外还伴随着焦虑等非运动症状,与人类PD的运动和非运动症状一致〔16,17〕。本研究使用MPTP诱导的慢性PD小鼠模型,能更好地反映PD的临床症状和信号通路的改变。
模型通过行为学和病理学两种方式来验证。行为学方面,旷场实验和爬杆实验的结果提示,模型小鼠的运动功能受损,慢性PD模型小鼠存在焦虑行为〔18,19〕。本研究发现,慢性PD模型小鼠在旷场实验中静止时间较正常组长。以上行为学发现表明,慢性MPTP腹腔注射的临床表现与PD症状相似。从病理学角度观察,中脑多巴胺能神经元的丢失是目前公认的PD病理标准,其中TH是合成多巴胺的限速酶,TH的水平与多巴胺能神经元功能密切相关内容,TH表达下降是PD模型诊断的标准〔20〕。本研究结果显示,模型小鼠血清和脑内TH表达明显减少。从临床表现和病理学两方面证实了本实验成功制备慢性PD小鼠模型。
神经递质多巴胺是通过D2R发出信号,D2R是Gi/o蛋白耦联受体,在整个大脑中广泛表达以控制一系列行为,包括运动、动机、动作选择和奖惩机制〔21〕。纹状体D2R对运动输出非常重要,间接通路中棘神经元D2R的缺失会以特定任务的方式损害运动活动,间接通路中棘神经元D2R调节神经元活动和突触传递,影响自我发起行动的能力及执行这些反应的意愿和(或)活力。D2R的丧失可能导致多巴胺信号传导受损,从而引起运动功能减退或特定自愿行为的启动受损〔2〕。以上表明中棘神经元D2R的缺失与人类PD运动症状运动功能减退、启动困难相似。D2R可通过激活G蛋白通路抑制高电压激活钙离子电泳(HVA Ca2+,在PD大鼠纹状体中表达)〔22〕、钠漏离子通道电流D2R(NALCN)〔21〕、内向整流钾电流〔23〕降低神经元兴奋性,调节运动行为。在中枢神经系统内除G蛋白信号通路外,D2R可通过招募β-抑制蛋白介导受体内化、降解,D2R与β-抑制蛋白结合是运动必需,并且D2R偏向与β-抑制蛋白结合可抑制小鼠依赖多巴胺诱导的运动〔24〕。G 蛋白和 β-抑制蛋白在D2R信号通路传导中是单独存在的,且在不同的条件下存在选择偏倚〔25〕。综上,D2R与β-抑制蛋白的结合可阻止D2R-G蛋白下游信号通路的传导进而参与运动功能的调控,而如何调控D2R通路的选择是治疗帕金森病的关键。本文通过Western印迹和免疫组化发现模型组小鼠纹状体D2R存在丢失,与既往文献〔22〕报道相符。在PD状态下纹状体多巴胺含量减少,D2R表达减少,如何更好地使多巴胺与D2R结合,更多的选择通过G蛋白传递信号而不是通过招募β-抑制蛋白传递信号传导是研究的重点。
D2R可直接招募β-抑制蛋白介导受体内化,但这种招募与GRK2水平相关,只有在高水平GRK2的情况下才能促进β-抑制蛋白的招募,而在低水平GRK2的情况下表现为抑制β-抑制蛋白的招募〔26〕。GRK2磷酸化D2R,使其偏向信号β-抑制蛋白〔27〕。在PD小鼠模型中发现纹状体内GRK2升高,而纹状体内D2R表达减少,综上推测GRK2升高使D2R偏向与β-抑制蛋白结合导致D2R表达减少,并影响D2R-G蛋白信号通路传递。对于D2R-G蛋白通路和β-抑制蛋白通路如何选择及其在PD发病机制中发挥何种作用目前尚不清楚。目前所知D2R在正常和PD状态下其数量和功能的变化至关重要,然而D2R在PD状态下的功能变化目前尚未完全清楚,针对D2R信号通路的研究是研究PD发病机制的重要,针对性靶向GRK2可能会调节D2R功能变化引起的PD运动功能障碍。
