河南地区兔腹泻源性大肠杆菌分离鉴定及其耐药性分析
2023-10-08张自强张倩文孙莹莹李梦云刘玉梅
张自强,谢 辉,张倩文,孙莹莹,李梦云,刘玉梅
(河南科技大学 动物科技学院,河南 洛阳 471000)
家兔腹泻是兔业养殖中常见的疾病之一,临床上主要由病毒、细菌和寄生虫引起,当兔舍环境卫生不达标,饲养管理不当时,也会引起本病的发生[1]。在家兔日常生产中,能引起家兔腹泻的的疾病有许多,临床上主要有兔大肠杆菌病、兔球虫病、兔魏氏梭菌病、兔沙门氏菌病和兔绿脓假单胞菌病等。不同日龄的家兔均可发生腹泻,但其中对断奶前后的幼仔兔危害最为严重。有研究表明,腹泻造成的幼兔死亡可达幼兔死亡率的70%以上,往往给养殖户带来严重的经济损失[2]。
兔大肠杆菌病又称黏液性肠炎,是由致病性大肠杆菌(Escherichiacoli)和其毒素引起的一种以腹泻为主要临床特征的急性、爆发性和高死亡率的幼兔肠道传染病[3]。不同年龄段的家兔对大肠杆菌均易感,其中1~4月龄的幼仔兔易感性最强,并且伴有较高的死亡率,同时也是造成幼兔腹泻最普遍的病因之一[4]。兔大肠杆菌病没有明显的季节性,一年四季均可发生。饲养管理不达标,卫生条件差,气候突变等均是本病的诱发因素[5]。目前,临床上用来治疗家兔大肠杆菌感染的措施主要依赖于抗生素,但养殖户频繁和不规范的大量使用抗生素往往会导致菌株多重耐药性的出现,到最后甚至会出现无药可用的困境[6-7]。大肠杆菌之间通过菌毛传递耐药质粒的特性[8],更是给家兔大肠杆菌病的防治带来极大的挑战。本研究从河南地区不同规模化兔场采集了104份腹泻病料,并对致病菌进行分离培养。通过菌落形态观察、生化试验、PCR鉴定来确定致病菌的种类,通过小鼠试验来确定大肠杆菌分离株的致病性。同时对分离出的72株大肠杆菌采用K-B纸片法进行药敏试验,以确定不同兔场大肠杆菌分离株的药物敏感性,以期为河南地区腹泻家兔大肠杆菌的感染情况和用药风险评估提供科学参考。
1 材料方法
1.1 病料来源
选取来自河南嵩县、济源、新乡、南阳、登封等地区的26家规模化兔场的104例家兔腹泻病例,使用接菌环无菌采取病兔的肠系膜、肝脏、脾脏等组织进行细菌的分离培养和鉴定。
1.2 培养基和试剂
药敏纸片、普通琼脂培养基和营养肉汤购自北京索莱宝科技有限公司,麦康凯培养基、伊红美蓝琼脂购自海博生物技术有限公司。Proteinase K、细菌基因组DNA小量提取试剂盒、DL2000 DNA Maker购自北京庄盟国际生物基因科技有限公司,Premix TaqTM(E×TaqTM Version 2.0 plus dye)购自大连TaKaRa公司,溴化乙锭溶液购自苏州天可贸易有限公司。
1.3 试验器材
电热恒温培养箱、超净无菌工作台、气浴恒温振荡器、高压蒸汽灭菌锅、台式冷冻高速离心机、普通PCR仪、电泳仪、凝胶成像仪。
1.4 致病菌的分离培养和形态观察
无菌采取腹泻病料的肠系膜、肝脏、脾脏等组织划线接种于普通琼脂培养基,37 ℃培养24 h后观察菌落的生长状况。挑取疑似大肠杆菌的优势菌落置于营养肉汤中37 ℃培养24 h,将纯化后的菌液分别划线接种于麦康凯培养基和伊红美蓝琼脂中培养,观察菌落的形态,并进行革兰染色、镜检。将纯化培养的细菌分别接入微量生化管中,37 ℃培养24~72 h,观察记录结果。
1.5 PCR鉴定和序列比对分析
根据GenBank大肠杆菌eae基因序列,经DNAStar软件对比分析后,利用 Primier 5.0 软件设计相应的大肠杆菌引物,实验引物由通用生物(安徽)股份有限公司合成。预扩增目的片段大小可见表1,长度为833 bp。将扩增后的产物送至通用生物(安徽)股份有限公司进行测序,测序结果与GenBank中登录的菌株进行同源性比对,并使用MEGA7.0软件构建系统进化树。
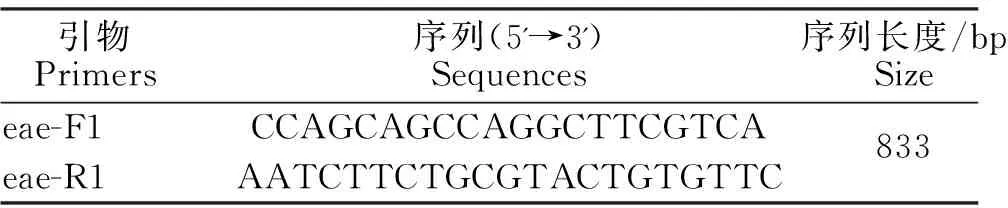
表1 引物序列Table 1 Primer sequences
1.6 动物致病性试验
挑取分离的大肠杆菌纯培养物,接种于营养肉汤中37 ℃摇菌培养16~24 h,用生理盐水将菌液浓度稀释至1×108cfu/mL。将菌液分别接种于12只质量约在 20 g的健康小鼠,随机分为对照组和试验组,试验组小鼠腹腔注射剂量为0.2 mL/只的菌液,对照组注射相同剂量灭菌PBS。观察小鼠的致病情况,并采集病料进行致病菌的分离鉴定。
1.7 药敏试验
采用K-B纸片法对红霉素、庆大霉素、新霉素、四环素、多西环素、多粘菌素B、复方新诺明、卡那霉素、丁胺卡那、环丙沙星、氨苄西林、头孢哌酮、诺氟沙星、痢特灵、氟苯尼考、恩诺沙星16种抗生素进行药敏试验,试验结果依据美国临床检验标准委员会(NCCLS)制定的标准判断(2016年版)[9]。
2 结果与分析
2.1 分离菌形态观察和生化鉴定结果
分离菌株经37 ℃恒温培养后在普通琼脂培养基上形成光滑、湿润、隆起且边缘整齐的中等大菌落(图1A);在麦康凯培养基上形成粉红色、不透明湿润且边缘整齐的菌落(图1B);在伊红美蓝琼脂中长出紫黑色,带金属光泽的菌落(图1C)。革兰染色后可在光镜下观察到两端钝圆的革兰氏阴性短小杆菌(图1D)。分离菌的生化鉴定结果如表2所示,根据分离菌株的形态观察和理化特性,可以初步判断分离菌株为大肠杆菌。

图1 分离菌形态学观察A. 分离菌在普通琼脂培养基上的菌落形态; B.分离菌在麦康凯培养基上的菌落形态 C. 分离菌在伊红美蓝培养基上的菌落形态;D. 分离菌在光镜下的形态观察Fig.1 Morphological observation of isolated bacteriaA. Colony morphology of isolated bacteria on ordinary agar medium;B. Colony morphology of isolated bacteria on McConkey medium;C. The colony morphology of the isolated bacteria on eosin methylene blue medium;D. Morphological observation of isolated bacteria under light microscope
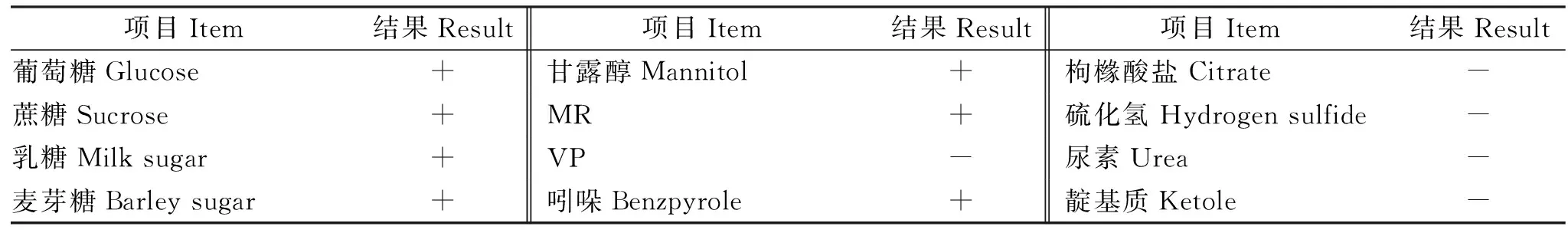
表2 分离菌株的生化试验结果Table 2 Biochemical test results of isolated strains
2.2 PCR鉴定结果和基因序列分析
采用eae引物对从分离后菌株中提取到的细菌DNA进行PCR扩增检测。使用浓度为2%的琼脂糖凝胶进行电泳后,获得833 bp基因片段,与预期结果一致(图2)。扩增产物测序后经BLAST进行对比分析,结果显示分离菌和大肠杆菌的同源性最高,采用MEGA 7.0软件构建其遗传进化树,分离菌与大肠杆菌登录号为MH111534.1,同源性为98.81%(图3)。
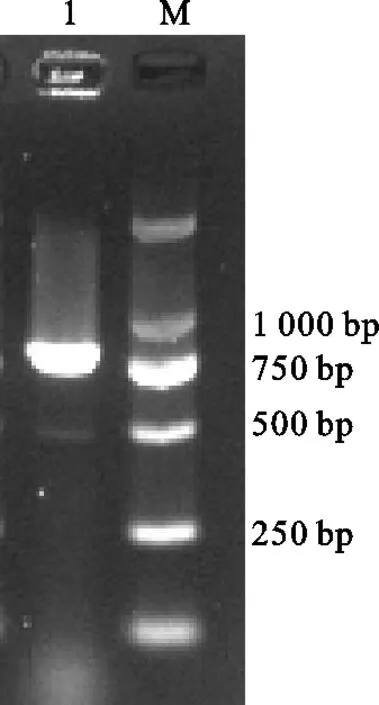
图2 分离菌PCR鉴定结果M.DL2000 Marker 1.分离菌株Fig. 2 PCR identification of isolated bacteriaM. DL2000 marker 1. isolated bacteria

图3 分离菌基因系统发育树Fig. 3 Phylogenetic tree of isolation bacteria
2.3 动物致病性试验
动物致病性试验结果显示,对照组小鼠没有发生腹泻和死亡,试验组小鼠在48 h内死亡率达到80%以上。采集死亡小鼠的肝脏、脾脏等组织病料进行病原菌的分离培养,经革兰染色镜检和分子生物学鉴定后发现能够得到与分离菌株一样的致病菌。
2.4 药敏试验结果
利用16种抗生素对分离的72株大肠杆菌进行药敏试验,试验结果见表3。由表3可知,分离菌株对16种药物均具有不同程度的耐药性,其中分离菌株对多粘菌素B最为敏感,耐药率仅为2.8%;对复方新诺明耐药性最强,耐药率为100%;分离菌株对其他14种抗生素耐药性为22.2%~94.4%,其中对丁胺卡那、头孢哌酮较为敏感,对红霉素、新霉素等耐药性较强。

表3 72株兔腹泻源性大肠杆菌对16种抗生素的耐药性Table 3 Drug resistance of 72 strains of Escherichia coli from rabbit diarrhea to 16 antibiotics
3 讨 论
兔大肠杆菌病作为家兔养殖业中最常见的消化系统疾病,感染后不仅使幼仔兔有极高的死亡率,同时也对幼兔康复后的生长带来了极大的影响,严重威胁着家兔健康和家兔养殖业发展[10]。为了探究河南地区腹泻家兔大肠杆菌的感染情况,本试验通过细菌的分离培养、染色镜检和PCR鉴定等方式对从河南不同规模化兔场的104个腹泻病料进行致病菌的分离鉴定,共分离出了72株大肠杆菌。结果与王国艳等[11]的研究相似,分离出的大肠杆菌是造成所调查兔场家兔腹泻的优势菌株。
长期以来,抗菌药物的使用一直是畜牧生产中对大肠杆菌病的主要防治措施。有研究显示,兽用抗菌药物的70%都被添加到饲料中用作饲料添加剂[12],抗菌药物的大量使用导致了耐药菌株的不断出现,耐药性越来越强,给大肠杆菌病的防治带来了极大的困难。在本试验中,通过对从河南地区不同规模化兔场中分离的大肠杆菌进行药敏试验,发现分离株对测试的药敏片均有不同程度的耐药性。其中分离的大肠杆菌对多粘菌素B最为敏感,耐药率仅为2.8%,而对复方新诺明、红霉素、新霉素、四环素、痢特灵、恩诺沙星等药物具有较强的耐药性。根据李双双等[13]的报道,从河南4个地区的兔场分离出的大肠杆菌对多粘菌素最为敏感,敏感率达到96.3%,而对其他兽用常见抗生素如氟苯尼考、阿米卡星等均具有不同程度的耐药性,其结果与本试验研究结果相似。同一地区相同源性的大肠杆菌耐药性也可能存在差异。王佳佳等[14]通过对从河南某兔场中分离的大肠杆菌进行药物敏感性测试,发现对庆大霉素、环丙沙星、头孢哌酮、氨苄西林等药物敏感,对红霉素、卡那霉素、四环素、诺氟沙星、丁胺卡那有较强抗性。在本试验中,通过耐药性测试发现大肠杆菌对丁胺卡那、头孢哌酮耐药率相对较低,对庆大霉素、环丙沙星和氨苄西林耐药性较高,其结论与王佳佳等的研究有所差异,原因可能和用药情况等因素的不同有关。大肠杆菌可因地区的不同而呈现出耐药性的差异,王国艳等[11]从山西地区分离的兔腹泻源性大肠杆菌对阿米卡星不耐药,对多粘菌素B、头孢哌酮、痢特灵等药物耐药性达到了80%以上。李科等[15]报道的大肠杆菌分离株对复方新诺明、恩诺沙星、环丙沙星等药物高度敏感。其耐药性结果均和本试验的研究结果存在较大差异。而坤清芳等[16]对从四川地区家兔养殖场中分离到的97株大肠杆菌进行了喹诺酮类药物的药敏试验,发现分离的大肠杆菌对左氧氟沙星、依诺沙星、恩诺沙星、环丙沙星、氧氟沙星和诺氟沙星具有多重耐药性,而在本试验中,同样发现分离的大肠杆菌对3种喹诺酮类药物诺氟沙星、恩诺沙星和环丙沙星具有较强的耐药性。喹诺酮类药物是治疗大肠杆菌感染的主要抗菌药物之一[17],在畜牧生产中被大量使用,不同地区大肠杆菌对喹诺酮药物耐药性的增强可能和喹诺酮类药物的过量和长期使用有关[18]。这也说明了对一种药物的大量使用会同时导致不同地区菌株的耐药性增强。
大肠杆菌广泛存在于自然界中,同时也是动物肠道内正常存在的寄生菌,一旦家兔的饲养环境改变导致家兔发生应激时,往往导致家兔大肠杆菌病的发生。从以上结果中也发现大肠杆菌的耐药性已较为严重,从多个地方分离的菌株都具有不同程度的多重耐药性。同时,从不同地域、不同源性身上分离的大肠杆菌耐药性的不同[19-22],更是给本病的防治增加了难度。细菌的耐药现象可通过质粒结合等方式在菌群中水平传播[23-25],因此应该避免盲目用药,而应根据药敏试验结果采用联合用药和轮换用药相结合的方式,尽量减少耐药菌株的产生。本次研究通过对河南地区腹泻家兔大肠杆菌的分离培养、鉴定和耐药分析,为河南地区兔大肠杆菌的感染状况和临床用药提供科学参考,同时也为不同地区大肠杆菌的耐药情况分布提供了理论依据。
4 结 论
所调查兔场中,发生腹泻病的家兔具有较高的大肠杆菌感染率,且菌株具有普遍的耐药性,但对多粘菌素B、复方新诺明等药物最为敏感,该研究结果为河南地区家兔大肠杆菌病的耐药情况、防治和临床用药提供了理论参考。
