热应激对西门塔尔种公牛血液生理生化指标和生产性能的影响
2023-10-08柳雷振王世伟高腾云刘深贺
柳雷振,郑 卓, 王世伟,高腾云,刘深贺
(河南农业大学 动物科技学院,河南省家畜营养调控与生态养殖国际联合实验室,河南 郑州 450046)
温湿度指数(Temperature-Humidity Index, THI)是衡量家畜受环境温湿度影响程度的常用指标[1],当THI>72时,牛出现热应激反应[2]。热应激影响种公牛的性欲,造成精液品质下降,受胎率下降[3]。关于缓解奶牛热应激的措施,已有较多研究报道,但关于如何减缓热应激对兼用型牛的影响的研究,报道较少[4]。本研究通过比较热应激和非热应激条件下西门塔尔种公牛的生理常值和血液生理生化指标,解析热应激影响西门塔尔种公牛精液品质的机制,并筛选出评价西门塔尔种公牛热应激程度的参考指标,为耐热公牛筛选和耐热分子机制的解析奠定理论基础。
1 材料与方法
1.1 试验时间和地点
本试验于5月和7月在位于河南省中牟县的鼎元种牛育种有限公司种牛场内开展。
1.2 试验动物
选择年龄2~5岁、体重相近、健康状况良好且正常采精的西门塔尔种公牛34头。饲喂相同的基础日粮并自由饮水。
1.3 样品采集和指标测定
距离地面1.5 m处安装温湿度仪,每间隔1 h自动测定和记录一次。
采用Ingraham[5]的公式计算THI值:
THI(%)=(1.8×T+32)-0.55×(1-RH)×(1.8×T-26)
其中T是摄氏温度,RH是相对湿度。
1.3.1 生理指标的测定 在试验期间,每天中午12:00使用兽用体温计测定公牛直肠温度;每天14:00使用计数器测定公牛呼吸频率(1次起伏记录为1次呼吸),连续记录3 min并求其平均值。
1.3.2 血液参数的测定 分别在5月份试验开展第3天和7月份试验最后1 d的上午08:00对所有试验牛进行颈静脉采血。使用真空采血管(EDTA抗凝管)采集血液样本10 mL,采集后进行离心,3000 r/min离心10 min,取上清液分装至离心管中,-20 ℃冷冻保存。采用酶联免疫分析法(ELISA试剂盒)对三碘甲状腺原氨酸(T3)、甲状腺素(T4)、睾酮(T)、皮质醇(CoR)、热休克蛋白HSP70和HSP90进行测定。
1.3.3 精液品质的检测 射精量:采用假阴道法采集鲜精,采精员将假阴道竖起,使精液充分地流入集精管内,然后取下集精管,迅速转移至精液处理室,记录射精量。
精子密度:取40 μL新鲜精液,加3 960 μL稀释液,稀释后采用全自动密度仪测定;
精子活力:取5~10 μL新鲜精液置于载玻片上,环境温度或载物台温度保持在37~38 ℃,盖上盖玻片后立即在200和400倍显微镜下观察。
1.4 数据分析
所有数据用“平均值±标准误”表示,使用SPSS 26.0软件中的配对样本T检验方法进行统计分析,并对热应激和非热应激期间生理常值、血清生化指标和精液品质指标进行Spearman相关性分析。
2 结果与分析
2.1 种公牛牛舍温湿度
分别在5月份和7月份期间连续记录牛舍温湿度18 d,结果显示,试验期间5月份THI变化范围为60.08~70.46,平均THI=66.67±0.91;7月份THI变化范围为73.18~87.71,平均THI=80.10±1.13,牛舍THI值随着时间的推移逐渐增加(表1)。表明试验牛在5月份处于非热应激状态,在7月份处于热应激环境状态。
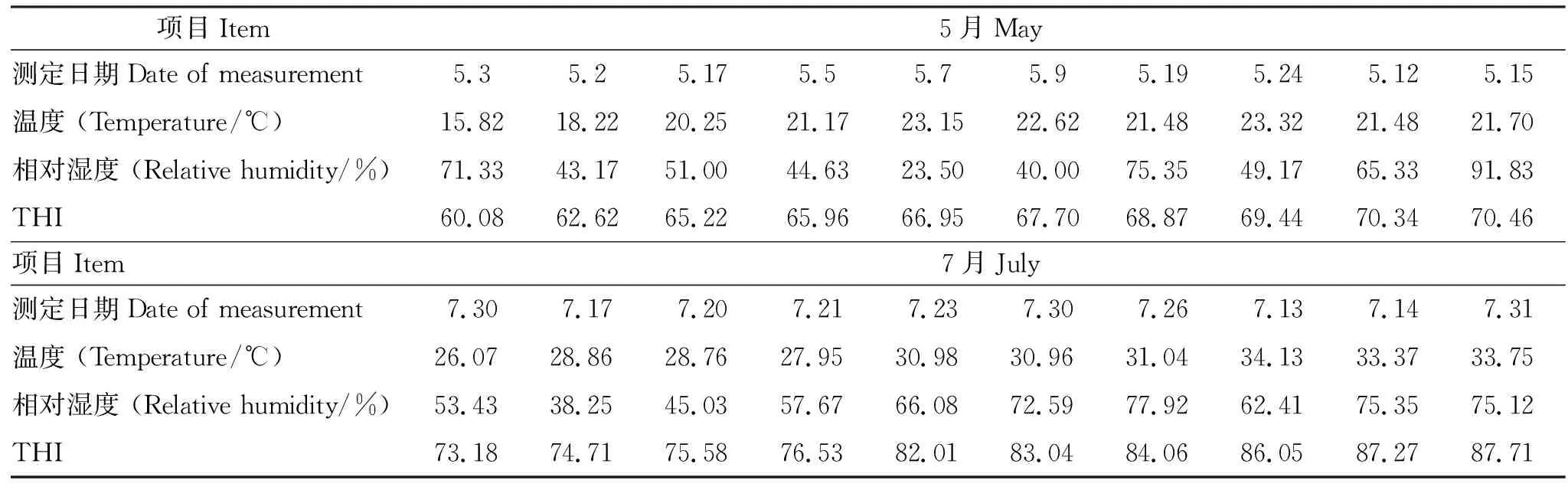
表1 牛舍5月份和7月份的温湿度Table 1 The temperature and humidity of the cattle house in May and July
2.2 热应激环境对西门塔尔种公牛生理指标的影响
与非热应激环境下试验牛的呼吸频率(34.7±0.8 breaths·min-1)和直肠温度(38.6±0.02 ℃)相比,热应激环境下试验牛的呼吸频率(43.4±1.0 breaths·min-1)和直肠温度(38.8±0.02 ℃)极显著升高(P<0.01);呼吸频率和直肠温度随着THI的升高整体有上升的趋势,非热应激环境下试验牛的呼吸频率和直肠温度随THI的升高有窄幅上升;热应激环境下试验牛的呼吸频率和直肠温度随THI的升高有大幅上升(图1和表2)。表明试验牛在7月份时处于热应激状态。
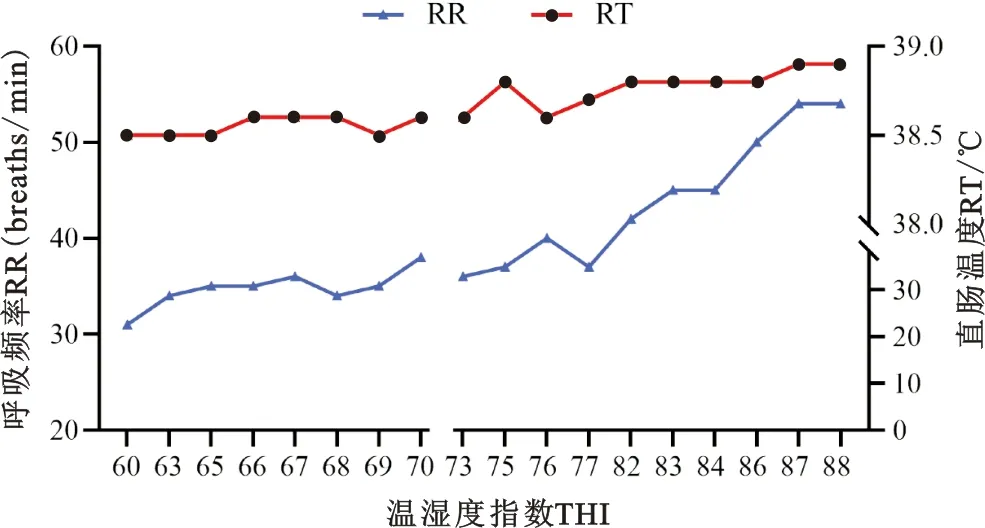
图1 呼吸频率(左)和直肠温度(右)随THI的变化趋势图Fig. 1 Respiratory rate and rectal temperature variation trend with THI

表2 种公牛在非热应激和热应激时的呼吸频率和直肠温度Table 2 Respiratory rate and rectal temperature of bulls in non-heat stress and heat stress
2.3 热应激对西门塔尔种公牛血液生化指标的影响
如表3所示,热应激时试验牛CoR、T3、T4以及HSP70含量和非热应激时相比差异极显著(P<0.01),皮质醇和HSP70含量极显著上升(P<0.01),CoR含量上升30.81%,HSP70含量上升16.41%;T3和T4含量极显著降低(P<0.01),T3含量下降了14.77%,T4含量下降了24.04%;睾酮和HSP90含量没有显著差异。
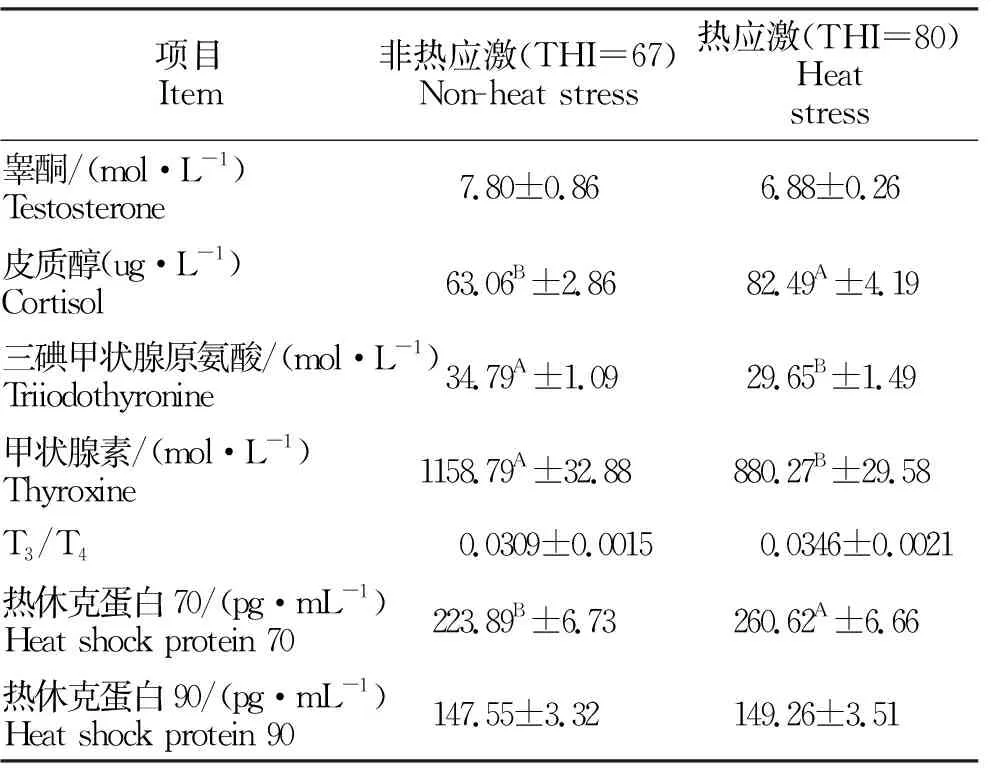
表3 种公牛在非热应激和热应激时血液参数指标的变化Table 3 Changes in blood parameters of bulls under non-heat stress and heat stress
2.4 热应激对种公牛精液品质的影响
在5月份非热应激和7月份热应激状态下,各测定了20 d试验牛的射精量、精子密度、精子活力指标,结果见表4。热应激和非热应激时相比,精子活力极显著降低(P<0.01),降低了55.6%;精子密度显著降低,每毫升下降2.01×108;射精量无显著性差异(P>0.05)。

表4 非热应激和热应激状态下精液指标的差异Table 4 Differences in semen indexes between non-heat stress and heat stress
2.5 非热应激和热应激期间各项指标间的相关性
由图2可知,RR、RT、CoR、HSP70与THI呈极显著正相关(P<0.05),T3、T4与THI呈极显著负相关(P<0.05);THI、RR、RT、CoR、HSP70与精子活力呈极显著负相关(P<0.05),T3、T4与精子活力呈极显著正相关(P<0.05);血清睾酮、射精量、精子密度和各项指标均无显著相关性(P>0.05)。
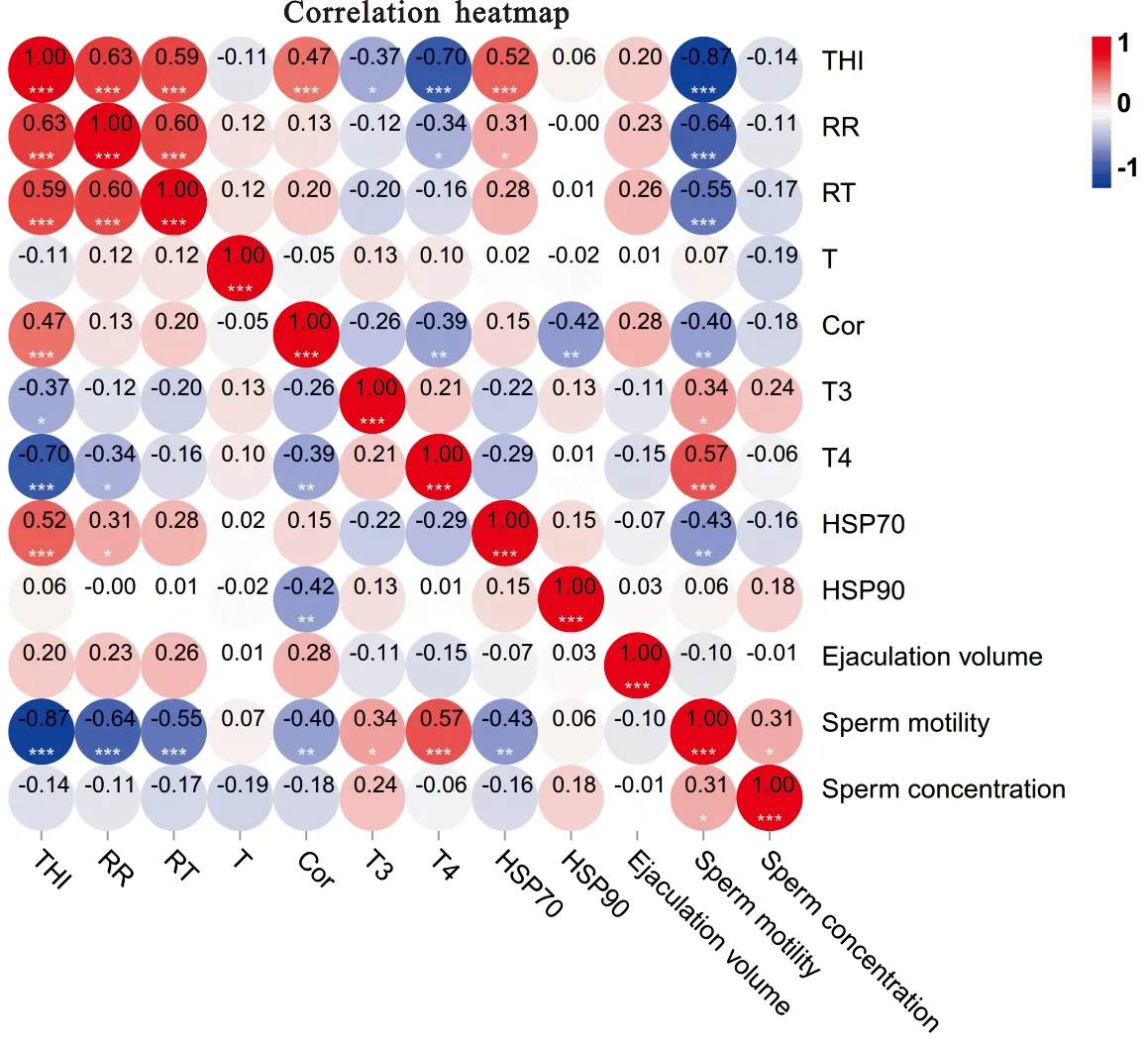
图2 非热应激和热应激期间各项指标的相关性分析*表示P<0.05,**表示P<0.01,***表示P<0.001Fig. 2 Correlation analysis of various indicators during non-heat stress and heat stress* represents P<0.05,** represents P<0.01,*** represents P<0.001
3 讨 论
3.1 热应激对生理生化指标、精液品质的影响
THI是综合环境温湿度来判断热应激状态的常用环境参数。有研究发现,当THI<72时,肉牛无应激反应;当73
动物的RR和RT被认为是评价热应激的良好指标[10]。血液在维持内环境稳态中有重要作用,机体中各种代谢反应,神经和体液调节都需要血液的参与,所以血液中的生化指标也可以反映出肉牛的热应激状态[11]。许红喜等[12]根据婆罗门公牛不同季节生理、激素和毛发特征来评估婆罗门公牛的适应性反应。使用RR、RT等生理指标,T3、T4、CoR等血清激素指标,被毛厚度等毛发指标对热应激程度进行评估。Kamal[13]研究表明, 美国荷斯坦牛和水牛在发生热应激后,血清中T3含量在72 h时降到机体最低水平。T3和T4的分泌量减少被认为是动物努力减少体热的产生和积累所导致的,对保持机体热量平衡起作用[14-15]。宋小珍等[16]报道,锦江黄牛在热应激期第20、40、60天时血清中的T3含量比非热应激时分别下降了15.65%、23.48%和37.39%。因此,种公牛为防止夏季过分产热,降低代谢率,必须通过内分泌途径减少产热,使甲状腺机能减弱,血清T3、T4水平的下降正是这种调节的表现,这与本试验的研究结果一致。Lan等[13]研究表明,将未怀孕的雌性水牛暴露在42.1 ℃的高温环境中2~3 h,其血浆CoR含量迅速上升,30 min后开始缓慢下降。本研究中试验牛热应激时CoR显著增加,CoR增加有利于修复热应激造成的组织损伤,而且CoR的增加是应激反应最重要的特征。HSP70在正常细胞内表达量较低或者不表达,但是在热应激或者其它应激源的作用下,表达量迅速增加。Liu等[17]研究表明,随着温湿度指数升高,HSP70表达量呈上升趋势,高温期奶牛的外周血淋巴细胞HSP70表达丰度极显著高于临界高温期和适温期(P<0.01),且与奶牛的耐热指标具有一定的遗传相关,表明HSP70可以作为奶牛热应激反应的候选基因。对种公牛而言,HSP70在整个精子发生过程中不仅起到保护的作用,而且参与热损伤蛋白的修复,减少热应激对精子发生的破坏作用,对精子发生至关重要。
3.2 生理常值、血液参数和精液品质的相关性
钟代彬等[18]研究了环境温湿度对种公牛健康及精液品质的影响。李俊杰等[19]研究了不同季节肉用种公牛精液品质与生理常值、血清及精清生化指标相关关系,结果表明,呼吸频率、直肠温度与血清皮质醇、三碘甲状腺原氨酸均呈显著负相关。史彬林等[20]认为可将直肠温度和呼吸频率作为评定奶牛耐热性指标。本研究对生理常值、血液参数和精液品质进行了相关性分析,表明各项指标和射精量、精子密度间均无显著相关性;呼吸频率、直肠温度与精子活力呈极显著负相关;皮质醇、HSP70与精子活力呈显著负相关;甲状腺素与精子活力呈极显著正相关;三碘甲状腺原氨酸与精子活力呈显著正相关。热应激造成机体血清T3、T4、CoR含量的降低,机体糖类吸收与利用以及脂肪的分解率降低,可能与热应激导致精液品质降低,生精过程缺失大量的营养和代谢物有关。培育抗热应激种公牛新品系,从遗传本质上解决种公牛热应激问题是最具前景的方案[21]。本研究通过热应激对生理常值、血清生化指标和精液指标造成的变化以及相关性分析,认为生理指标(RR、RT),血液生理生化指标(T3、T4、CoR、HSP70含量)的变化可作为种公牛是否发生热应激的参考指标,亦可作为筛选耐热性种公牛的参考依据。
4 结 论
在夏季高温引起的热应激条件下,西门塔尔种公牛的RR和RT升高,血清中T3、T4含量及精子密度和精子活力降低,CoR和HSP70含量增加可能是引起精液品质下降的原因。RR、RT、CoR、HSP70与精子活力呈极显著负相关,T3、T4与精子活力呈极显著正相关。生理常值RR和RT,血清生化指标T3、T4、CoR和HSP70可以作为评估西门塔尔种公牛遭受热应激的参考指标。
