适用于多种禾本科植物染色质转座酶可及性测序的提核建库方法
2023-05-11祁泽文黄铭涵张佳卉刘艺韩烈保何
祁泽文黄铭涵张佳卉刘 艺韩烈保何 航,*
1北京林业大学草业与草原学院, 北京 100083;2北京大学现代农学院, 北京 100081
真核生物的基因组DNA在细胞核中与组蛋白结合形成核小体, 核小体是构成染色质的基本单位,染色质通过紧密折叠高度压缩形成螺旋化的染色体结构[1-2]。在染色体进行复制、转录时, 需要暴露DNA与转录因子和调控元件相结合, 这些可以与转录因子和调控元件结合的DNA区域称为染色质的可及性区域, 或者染色质开放区[3-4]。对染色质可及性的测定可以帮助获取开放区域信息、核小体定位信息以及转录因子结合信息等[5]。
至今已有报道的染色质可及性测定方法主要有4种, 分别为脱氧核糖核酸酶敏感位点测序(deoxyribonuclease I hypersensitive site sequencing,DNase-seq)、微球菌核酸酶辅助分离核小体测序(micrococcal nuclease assisted isolation of nucleosomes sequencing, MNase-seq)、甲醛辅助性调控元件分离测序(formaldehyde assisted isolation of regulatory elements followed by sequencing, FAIRE-seq)和染色质转座酶可及性测序(assay for transposase accessible chromatin with high-throughput sequencing, ATACseq)[6-9]。ATAC-seq在了解生物发育分化、疾病发生等过程和基因表达调控机制的研究中占据非常重要的地位, ATAC-seq技术可通过测定染色质的开放区域直接获得染色质的可及性情况, 具有细胞核需求量少、高效灵敏、易重复等优势, 因此逐渐被科研人员广泛使用[9-11]。
目前, 虽然ATAC-seq的应用较为成熟、广泛,但该技术大部分运用在动物和疾病等方面的研究上,在植物方面的应用报道较少, 这与植物本身特性有很大关系[3,12-13]。植物细胞在结构和内含物等方面与动物细胞存在很大差异, 因此, 植物提取细胞核仍没有一个很完善的方法。植物细胞不但具有细胞壁,而且还具有胞间连丝、次生代谢物等, 这些对植物细胞核的制备增加了许多困难[14]。提取植物的细胞核时, 通常采用植物愈伤组织或幼苗等鲜嫩组织作为材料, 如已报道的玉米提核是采用幼苗和花粉组织[15-16]。在研究中本课题组发现这种针对新鲜幼嫩植物组织的提核方法很难适用于其他物种, 可能是与植物类型和植物苗龄不同有关。为应对不同的科研需求, 本课题组通过摸索、探究, 成功建立包括小麦(Triticum aestivumL.)、水稻(Oryza sativaL.)和结缕草(Zoysia japonicaSteud.)在内的非幼苗、禾本科植物及不同组织的细胞核提取方法, 该方法可为更多的植物染色质转座酶可及性测序提核及建库提供参考。
1 材料与方法
1.1 试验材料
水稻(O. sativa‘Nipponbare’)由北京大学邓兴旺实验室何航课题组提供, 结缕草(Z. japonica‘Compdare’)由北京林业大学草坪所提供, 小麦(T. aestivum‘W7984’)由中国科学院遗传与发育研究所李义文课题组提供。
1.2 试验试剂
细胞核提取缓冲液(NEB)为200 μL的MOPS溶液(1 mol L-1, pH 7.0), 80 μL的NaCl溶液(5 mol L-1),300 μL的KCl溶液(3 mol L-1), 50 μL的EDTA溶液(500 mmol L-1), 50 μL的EGTA溶液(100 mmol L-1),5 μL的精胺溶液(400 mmol L-1), 13 μL的亚精胺溶液(400 mmol L-1)和200 μL的蛋白酶抑制剂溶液,NEB溶液总体积为10 mL。
细胞器去除缓冲液(ORB)为1 mL的蔗糖溶液(2.5 mol L-1), 100 μL的Tris-HCl (1 mol L-1, pH 8.0),1 mL的MgCl2溶液(100 mmol L-1), 500 μL的Triton X-100 (20%)和200 μL的蛋白酶抑制剂溶液, ORB溶液总体积为10 mL。
蔗糖缓冲液(SCB)为6.8 mL的蔗糖溶液(2.5 mol L-1), 100 μL的Tris-HCl (1 mol L-1, pH 8.0), 200 mL的MgCl2(100 mmol L-1), 50 μL的Triton X-100 (20%)和200 μL的蛋白酶抑制剂溶液, SCB溶液总体积为10 mL。
1 μg mL-1DAPI溶液, Percoll细胞分离液(Sigma,货号 0219536925)和台盼蓝溶液(Eallbio, 货号03.13007A)。
1.3 提核方法
参考玉米幼苗提核方法[15], 在此基础优化条件,使其适用于禾本科非幼苗的提核与建库。具体试验方法如下: (1) 试验1 h前制备Percoll细胞分离液梯度缓冲液, 根据需求将ORB缓冲液与Percoll细胞分离液按体积2∶3混合制成60%的Percoll混合溶液并静置; (2) 在冰上的培养皿上放置一片5 cm×5 cm的薄膜, 用移液管将500 μL NEB移到膜上并用刀片在NEB缓冲液中切碎幼苗的叶片, 切碎的组织出现粗浆状为佳, 此过程大约需要5 mL NEB缓冲液; (3) 将浆液转移到冰上的小培养皿中, 轻轻搅动放置5 min, 在预冷玻璃漏斗上放置4层过滤布, 过滤泥浆至5 mL离心管, 用20 μm的滤池器过滤粗核悬浮液2次, 去除大的碎片; (4) 将滤液倒入5 mL离心管, 4℃ 800×g离心10 min, 轻轻去除上清液而保留沉淀; (5) 向每个试管中加入200 μL ORB溶液,静置2 min, 使沉淀稍分离, 用一把精细的尼龙刷轻轻地去除沉淀上的绿色层, 保持浅白色的底层不受干扰, 使用移液管轻轻地把绿色沉淀转移到新的试管中, 将绿色沉淀材料重新悬浮在ORB溶液中,用20 μm滤池器过滤细胞核悬浮液2次, 去除聚集的细胞核和碎片; (6) 将400 μL 60% Percoll的混合溶液(步骤3)添加到新的1.5 mL离心管的底部, 使用移液枪小心地将200 μL SCB置于Percoll层下方, 确保2层之间有清晰的界限, 在该Percoll的混合梯度缓冲液中加入约400 μL步骤5中绿色的细胞核悬浮液, 4 ℃ 1000×g离心15 min; (7) 在Percoll/SCB界面上可以观察到一层棕白色的沉积层, 它代表了核的量, 小心地将这些细胞核(约200 μL)转移到新的1.5 mL离心管中, 加入1 mL NEB细胞核悬浮液, 以500×g离心约10 min, 使细胞核成团沉淀下来; (8)将离心后的沉淀溶解在20 μL NEB溶液中得到最终的分离核溶液, 取离核溶液2 μL, 用NEB溶液稀释,用DAPI (终浓度: 0.3 μg mL-1)染色, 用台盼蓝溶液检查细胞核完整性并用血球计数板计算分离细胞核悬浮液中的细胞核数量, 计数重复3次, 细胞核的密度(个 mL-1) = 大方格(0.1 mm3, 即0.1 μL)的细胞核数×104; (9) 吸取2500~5000个细胞核转移到一个新的1.5 mL离心管中, 准备接下来的文库构建。
1.4 提核方法优化
设计试验, 确定适用于禾本科植物提核建库的方法, 每组试验设置3次重复。具体方案如下:(1) 对组织处理方法优化, 步骤2中分别采用切鲜组织, 研磨新鲜组织和液氮研磨组织的方法提核,步骤4离心速度为800×g, 步骤5使用200 μL ORB缓冲液去除细胞器; (2) 离心速度优化, 步骤2使用液氮研磨组织的方法提核, 步骤4中离心速度分别为800、1000、1200、1400和1600×g提核, 步骤5使用200 μL ORB缓冲液去除细胞器; (3) 细胞器去除优化, 步骤2使用液氮研磨组织的方法提核, 步骤4中离心速度为1200×g, 步骤5先后按照使用1次200 μL ORB缓冲液去除细胞器, 使用1次10 mL ORB缓冲液去除细胞器和使用2次且用量分别为10 mL, 200 μL ORB缓冲液去除细胞器的方式进行试验。
1.5 文库构建及库检方法
方法如下: (1) 使用Novoprotein Chromatin Profile Kit for Illumina试剂盒(货号: N248)进行细胞核片段化及终止, 按说明书配制片段化混合液40 μL重悬5 μL洗涤和裂胞过的细胞核, 用移液器轻柔吹打10次混匀细胞核, 将液体转移到200 μL的PCR管中, PCR仪上37℃反应30 min; 片段化结束后, 向片段化产物中加入10 μL Stop buffer, 移液器吹打5次混匀, 55℃反应5 min; (2) 使用Novoprotein Tagment DNA Extract Beads试剂盒(货号: N245)进行纯化片段化终止产物, 提前将Tagment DNA Extract Beads从4℃冰箱取出, 涡旋振荡混匀磁珠, 室温放置15 min后再次涡旋振荡混匀磁珠, 并向每管终止后的样品中加入其2倍体积(100 μL)的磁珠, 吹打混匀, 室温放置5 min, 将反应管短暂离心后置于磁力架上, 使磁珠与液体分离(约5 min,待溶液澄清), 小心吸去上清, 加入200 μL新鲜配制的80%乙醇漂洗磁珠, 加乙醇时不要扰动磁珠, 室温静置4 min后,小心吸去上清, 此过程仍保持反应管置于磁力架上(该步骤重复1次), 保持反应管置于磁力架上, 打开管盖, 室温晾干(4~6 min), 使乙醇充分挥发, 切记磁珠不可干燥过度, 将反应管从磁力架上取下, 每管中加入37 μL Elution buffer, 吹打混匀后室温放置3 min;通常情况下磁珠均匀的分布于水相中, 如果细胞数量比较多, 可能会出现小粒状磁珠沉积于管底, 多次吹打之后, 静置2 min, 再次吹打混匀, 将反应管置于磁力架上, 使磁珠与液体完全分离(约2 min,待溶液澄清), 小心吸取35 μL上清至新的无菌PCR管内;(3) 使用Novoprotein NovoNGS Index Kit for Illumina试剂盒(货号N239)进行PCR富集, 按说明书配制试剂与纯化后的产物混匀后快速离心, 将管盖上的液体离心至管中, 放入PCR仪中扩增, 水稻进行14个或15个循环, 小麦进行18个循环, 结缕草进行14个循环, PCR扩增设置如下: 72℃ 3 min, 98℃ 30 s后进入循环过程, 循环数为8~18次, 循环设定为98℃15 s, 60℃ 15 s, 72℃ 8 s, 循环结束后72℃ 2 min, 最后10℃保存备用; (4) 使用Novoprotein DNA Clean Beads试剂盒(货号N240)进行PCR产物纯化及文库大小分选, 具体操作如说明书所示; (5) 文库检查及测序, 用Qubit对文库进行浓度检测、安捷伦2100检测文库; 对合格文库进行测序, 根据基因组大小设计测序数据量, 水稻测序数据量为10 G, 小麦测序数据量为30 G, 结缕草测序数据量为6 G (北京诺禾致源科技股份有限公司进行此项操作)。
1.6 ATAC-seq数据初步分析
方法如下: (1) 获得 FASTQ 文件后使用Trimmomatic[17]过滤掉低质量片段, Trimmomatic的使用参数有--phred33、--LEADING:3、--TRAILING:3、--MINLEN:51; (2) 使用Bowtie 2[18]与小麦(Genome assembly IWGSC CS RefSeq v2.1)、水稻(Genome assembly IRGSP-1.0)、结缕草(为本课题组装, 数据尚未公开)的参考基因组进行比对, 随后利用Picard[19]和SAMtools[20]去除重复的、叶绿体和线粒体的数据, Bowtie 2的使用参数有--N 1、--X 2000;Picard的使用参数有--REMOVE_SEQUENCING_DUPLICATES true; SAMtools的使用参数有--h, 线粒体叶绿体可以直接用grep -v chrM命令进行去除(M代指基因组中的线粒体或叶绿体), 参考基因组下载网址: https://www.ncbi.nlm.nih.gov/; (3) 使用软件IGV[21]可对处理后的数据进行可视化处理;(4) 使用软件macs2 (version 2.1.0)寻找染色质开放区域, macs2的使用参数有--f BAMPE、--keep-dup all和--cutoff-analysis。
2 结果与分析
2.1 提核条件优化
2.1.1 组织处理方法优化 植物组织的处理方法会极大地影响细胞核的提取, 在保证初步提核离心力和ORB缓冲液使用量及使用次数不变的情况下,发现使用切新鲜组织制备细胞核的方法, 在提取小麦、水稻和结缕草细胞核的混合液中均无法获取细胞核; 采用研磨新鲜组织的方法, 只有水稻的叶片可制备极少量的细胞核和一些杂质(图1-A); 采用液氮研磨组织制备细胞核, 发现小麦、水稻和结缕草的叶片及根组织均可以制备较多的细胞核, 但杂质很多(图1-B, 以水稻为例)。

图1 光学显微镜下的细胞核Fig. 1 Nuclei under optical microscopeA: 研磨新鲜水稻叶片所提取的细胞核图(明亮的蓝色小圆点为细胞核); B: 用液氮研磨水稻叶片所提取的细胞核图(明亮的蓝色小圆点为细胞核)。A: the nuclei extracted by using the leaves of fresh rice (Bright blue dots are nuclei); B: the nuclei extracted by using the leaves of rice with liquid nitrogen (Bright blue dots are nuclei).
2.1.2 离心速度优化 离心力太小会影响细胞核的沉积, 离心力太大会造成细胞核的破碎, 因此离心力的优化是细胞核提取的重要环节。本试验采用不同的离心力测试离心力对制备细胞核的影响, 如图所示, 当离心力800×g时, 水稻、小麦和结缕草提取到的细胞核都较少, 随着离心力的变大而变多, 当离心力达到1200×g时, 提取的细胞核的数量最多, 随后因细胞核的破碎细胞核的数量又开始减少(图2)。
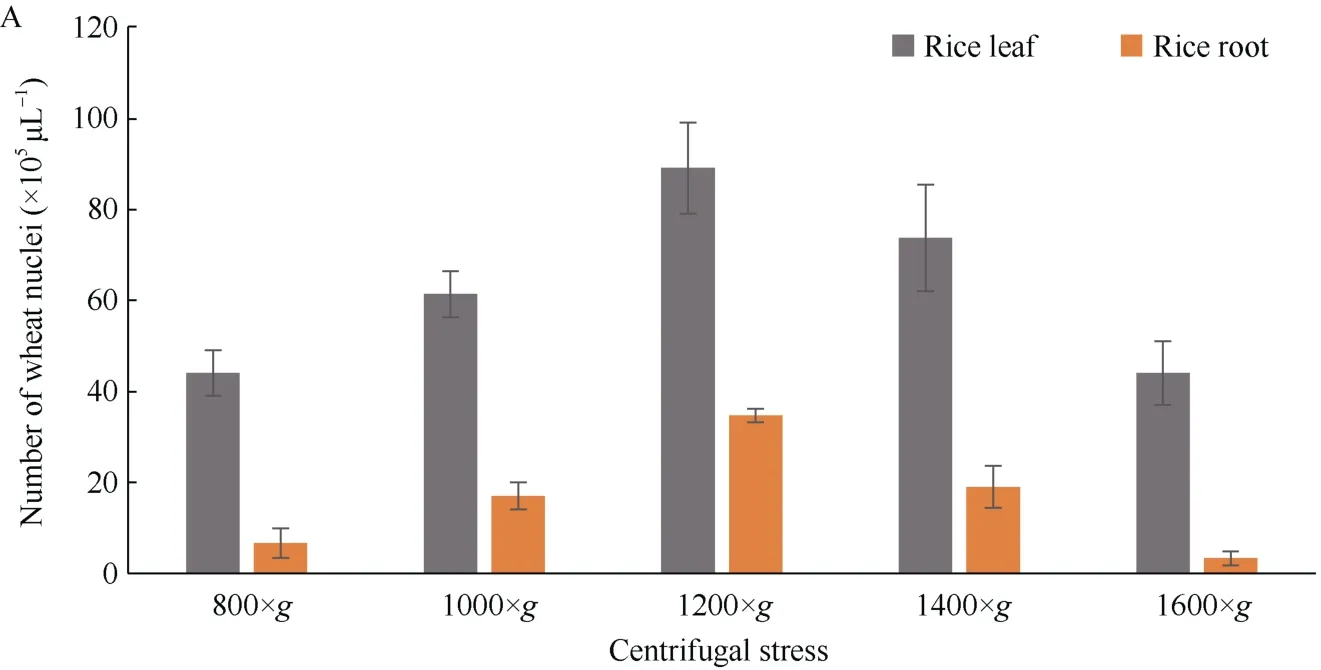
(图2)
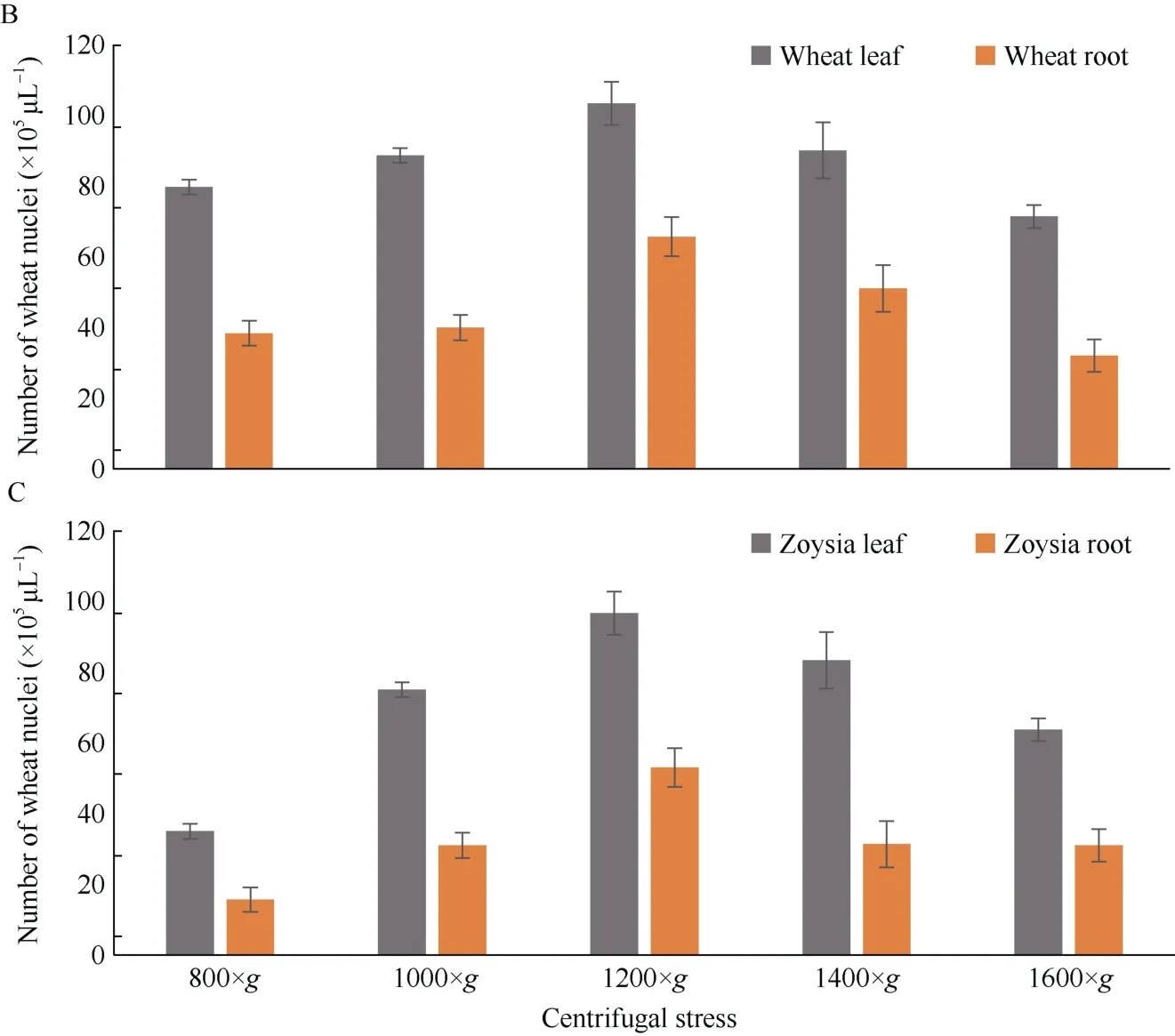
图2 不同离心力下提取的细胞核个数Fig. 2 Number of the nuclei extracted under different centrifugal fourcesA: 利用水稻组织提取的细胞核; B: 利用小麦组织提取的细胞核; C: 利用结缕草组织提取的细胞核。A: the nuclei extracted by using rice tissues; B: the nuclei extracted by using wheat tissues; C: the nuclei extracted by using zoysia tissues.
2.1.3 细胞器去除优化及文库构建 采用液氮研磨植物组织, 初步提取细胞核的离心力为1200×g,使用200 μL ORB缓冲液去除细胞器, 细胞核经提纯之后选取适量的细胞核建库, 结果发现18个样品库检的浓度及文库峰图均不合格, 所制备的细胞核不符合进一步的试验要求, 这可能和提取的核液中杂质过多有关。
获得含杂质较少的细胞核是之后试验顺利进行的必要条件, 去除细胞器和碎片等杂质显得尤为重要。本试验发现, 在处理样本方法和离心力一致的条件下, 若多次使用ORB溶液去除细胞器等杂质会提升细胞核的纯度。以使用水稻叶片提取细胞核为例, 使用单次200 μL ORB溶液去除细胞器等杂质所获得的细胞核溶液中杂质含量非常多(图3-A), 使用单次10 mL ORB溶液去除细胞器等杂质所获得的细胞核溶液中杂质含量有所减少(图3-B), 使用2次ORB溶液处理的方法可获得含杂质更少的细胞核溶液(图3-C), 经台盼蓝检测发现, 使用2次ORB溶液处理的细胞核出现破碎的情况非常少, 符合进一步试验要求(图3-D)。

图3 不同纯化方法下提取的细胞核Fig. 3 Nucleus extracted by different purification methodsA: 使用单次20 μL ORB缓冲液纯化细胞核; B: 使用单次10 mL ORB缓冲液纯化细胞核; C: 使用2次ORB缓冲液纯化细胞核; D: 台盼蓝检测破碎细胞。A: the nuclei purified with 20 μL ORB buffer; B: the nuclei purified with 10 mL ORB buffer; C: the nuclei purified with ORB buffer twice; D:the detection of broken nuclei with trypan blue.
选取适量纯化后的细胞核进行片段化及DNA提取, 经PCR扩增和文库纯化后进行文库检查, 结果表明使用2次ORB溶液去除细胞器和杂质所获得的细胞核可以成功建库。
综上所述, 通过综合分析影响细胞核提取的主要因素并进行逐一优化, 成功确定了适合于非幼苗、禾本科植物的不同组织的提核方法。选用液氮研磨植物样本, 初步提取细胞核离心力为1200×g,使用2次ORB溶液进行细胞器去除的提核方法效果最佳, 基于上述优化所得到的细胞核数量多、活性强、杂质少, 满足建库条件且构建的文库可进一步上机测序。
2.2 ATAC-seq数据分析
对测得的ATAC-seq数据初步分析发现, 叶绿体和线粒体等杂质的影响较小, 小麦叶片及根部数据所鉴定到的染色质开放区域的数目多于已发表的中国春小麦(T. aestivum‘Chinese Spring’)鉴定到的染色质开放区域[22]的数目, 染色质开放区域的位置与已发表的中国春小麦鉴定到的染色质开放区域的位置具有一定的重叠, 所获得的数据满足进一步的分析需求(图4-A, D, F); 水稻叶片和根部数据鉴定到染色质开放区域的数目多于已发表的水稻定到的染色质开放区域[23]的数目, 染色质开放区域的位置与已发表的水稻中鉴定到的染色质开放区域的位置具有一定的重叠, 所获得的数据满足进一步的分析要求(图4-B, E, F); 结缕草叶片和根部数据找到的染色质开放区域的数目及分布也满足进一步的分析要求(图4-C, F)。

(图4)
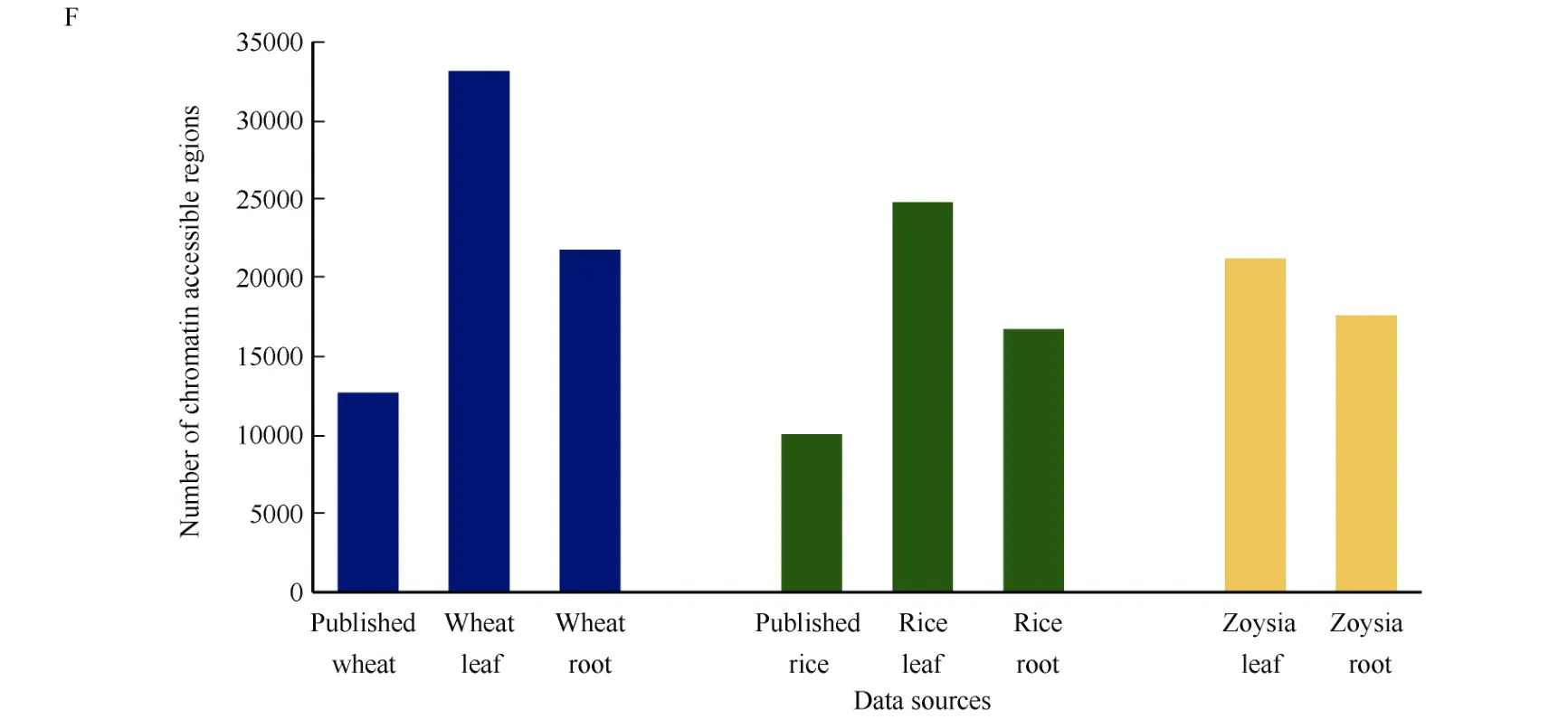
图4 染色质开放区域的数量及分布情况Fig. 4 Numbers and the distribution patterns of chromatin accessible regionsA: 小麦染色质开放区域的分布情况; B: 水稻染色质开放区域的分布情况; C: 结缕草染色质开放区域的分布情况; D: 小麦染色质开放区域的韦恩图; E: 水稻染色质开放区域的韦恩图; F: 鉴定到的染色质开放区域数目。A: the distribution patterns of chromatin accessible regions in wheat; B: the distribution patterns of chromatin accessible regions in rice; C:the distribution patterns of chromatin accessible regions in zoysia; D: Wayne diagram of chromatin accessible regions in wheat; E: Wayne diagram of chromatin accessible regions in rice; F: the number of chromatin accessible regions.
3 讨论
提取植物细胞核是进一步研究植物基因的重要基础, 在植物研究中扮演着极为重要的作用。随着测序技术的不断发展, 染色质可及性研究的重要性日益凸显, 染色质可及性测序分析对于研究表观遗传信息调控过程有重要意义[24-26]。目前, 已经有很多领域都在应用ATAC-seq技术, 如通过该技术与RNA-seq等其他技术进行联合分析, 从而从不同角度获取染色质相关信息, 各分析之间相互补充验证, 更加深入地挖掘基因转录调控的机制,但ATAC-seq的相关技术在植物上的应用报道仍旧很少[12-13,15,27-28]。
植物的各个器官如根、茎、叶及种子等都可以制备细胞核,但本试验参考的试验方法是适用于玉米幼苗的, 针对不同的研究目的应选用不同的植物组织进行提核, 此方法具有一定的局限性。另外当面临大量研究对象需要提核时, 为了保证处理及取样时间一致性, 大多科研工作者会将研究对象先保存至-80℃的条件下, 此时新鲜组织制备细胞核的方法便不如液氮研磨组织制备细胞核的方法方便、有效。因此本课题组决定建立一个适用于非幼苗、非新鲜样本及不同组织的提核体系。
本试验以水稻、小麦和结缕草为研究对象, 这3种植物在禾本科植物里具有一定的代表性, 水稻是一种非常重要的禾本科经济作物, 是我国的主要粮食作物, 种植面积比较大, 分布范围比较广, 被世界各地广泛研究[29-30]; 小麦是全球的主要经济粮食作物, 有着极为重要的研究价值, 但作为禾本科异源六倍体植物, 其庞大的基因组导致在许多方面研究都会比其他植物困难[31-32]; 结缕草是一种重要的草坪草, 因其耐性强, 耐践踏, 无汁液渗出等特性而广泛应用在高尔夫球场、足球场以及固土护坡、道路绿化等方面, 但其叶片结构特殊导致其在提取原生质体时较为困难[33]。
使用植物组织提核和建库受多因素影响, 包括处理样本的方式、所提核的状态以及溶液中杂质的数量等[14]。处理样本的方式直接决定是否能制备出细胞核, 核的状态是衡量细胞核是否可用于后续研究的重要指标, 由于ATAC-seq建库中的Tn5转座酶非常敏感, 所提核的数量不合适或核液中叶绿体、线粒体等其他杂质过多都会造成建库的失败[34]。
在试验过程中发现本方法同样适用于拟南芥等非禾本科植物提取细胞核和构建文库, 对获取其他植物染色质开放区域信息和深入研究基因表达调控方式有一定帮助作用。
4 结论
在提取多种禾本科植物细胞核的试验中发现,使用液氮研磨禾本科组织获得的细胞核状态最佳,在初步提核时使用1200×g离心力获得的细胞核数量最多, 先后分别使用10 mL、200 μL的ORB缓冲液去除细胞器所获得的细胞核溶液中杂质含量最少;对测得的ATAC-seq数据分析发现, 使用本方法获得的数据质量较高, 叶绿体和线粒体等杂质对数据影响较小, 鉴定到的染色质开放区域的数目及分布满足进一步分析要求。综上所述, 本试验所建立的细胞核提取和建库体系适用于多种禾本科植物的染色质转座酶可及性测序研究。
