热诱导转录因子ZmNF-YC13调控热胁迫应答基因提高玉米耐热性
2023-05-11梅秀鹏赵子堃贾欣瑶白洋李梅甘宇玲杨秋悦蔡一林
梅秀鹏赵子堃贾欣瑶白 洋李 梅甘宇玲杨秋悦蔡一林,*
1西南大学农学与生物科技学院, 重庆 400715;2南方山地农业教育部工程研究中心, 重庆 400715;3广西农业职业技术大学农学与园艺系, 广西南宁 530007
非生物胁迫是环境因素中对农作物影响最为广泛的胁迫因子[1-2]。统计数据表明, 1964—2007年间全球作物(水稻、玉米和小麦)产量因高温和干旱导致的损失高达9%~10%[1], 在某些区域损失更高[3]。其中, 热胁迫(heat stress)能影响作物的多个生理生化过程, 如高温条件下玉米胚芽鞘的生长发育减缓[4],叶片光合效率降低, 玉米雄穗分枝以及雌花小花密度明显减少, 籽粒产量降低[5-6], 以及玉米籽粒中淀粉、蛋白质和油脂等成分的含量下降等[7]。
为应对热胁迫, 植物形成了一系列的调控机制[8]。研究表明, 一些转录因子和功能蛋白在热胁迫应答中发挥了重要作用。其中最为重要的一类就是热激转录因子(heat shock transcription factor,Hsf)。如HsfA1s在热胁迫应答过程中扮演“主要调节因子”的角色, 在整个转录调控网络的激活过程中具有不可替代的作用[8]。在番茄和拟南芥中的研究表明, HsfA1s编码基因的单突变或多突变均能引起植株的热敏感表型和大量热胁迫响应基因表达水平的下降[9-11]。而且, HsfA1s还直接参与调节一些编码重要热胁迫应答转录因子的基因, 例如脱水响应元件结合蛋白Dehydration-Responsive Element Binding Protein 2A(DREB2A)、HsfA2、HsfA7a、HsfBs和多肽桥连因子Multiprotein bridging factor 1C(MBF1C)等[9]。热激蛋白(heat shock proteins, HSPs)是由热胁迫诱导产生的主要功能蛋白, 其编码基因也是热胁迫应答转录因子调控的重要靶基因之一,同时在由热胁迫导致的变性蛋白重折叠的质量控制过程中也发挥重要作用[12-13]。如HSP21蛋白是拟南芥在热胁迫条件下叶绿体正常发育所必需的[14]。过表达水稻HsfA2e和拟南芥HsfA2基因均能够上调HSPs相关编码基因的表达, 并且增强植株的耐热性[15-16]; 相反,HsfA2突变后增强了植株对热胁迫的敏感性, 并且下调了许多与热胁迫应答相关基因的表达[17]; 此外, HsfA2在维持HSP编码基因的表达和延长植株获得性耐热能力的持续时间方面还具有重要作用[17]。
CCAAT Binding Factor/Nuclear Factor of the Y Box (CBF/NF-Y)是一类存在于真核生物中的调控因子[18], 由NF-YA (HAP2/CBF-B)、NF-YB (HAP3/CBF-A)和NF-YC (HAP5/CBF-C) 3个亚家族组成。通常是以NF-YA、NF-YB和NF-YC三个亚基组成的异源三聚体或NF-Y复合体与其他转录因子互作的形式调控下游基因的表达[19]。已有研究表明,NF-Y转录因子在调控植物的生长发育过程中具有重要作用, 如参与种子发育、开花期调控和逆境应答调控等过程[19-22]。近些年, 在主要农作物(玉米、水稻、小麦等)中一些NF-Y编码基因在抗逆性方面的功能也不断得到解析。例如, 玉米中过表达ZmNF-YB2基因后, 转基因植株的抗旱能力显著增强, 而且在缺水条件下能显著提高植株产量[23]; 过表达玉米ZmNF-YB16基因能够增强植株的光合能力和抗氧化能力, 进而提高植株的产量和抗旱能力[24]。在良好的灌溉条件下, 过表达TaNF-YB4基因能显著增加小麦的穗数, 提高20%~30%的籽粒产量[25]。在水稻中,OsNF-YA10基因突变后可以增强水稻植株的耐旱性[26];OsNF-YA7基因受干旱胁迫诱导表达,并通过非ABA依赖途径参与干旱逆境的响应[27];以及NF-YB2通过调控Late Embryogenesis Abundant7(LEA7)和LEA76基因增强植株的耐旱能力,NF-YB3通过调控HSFA3和HSP70B基因提高植株对高温的耐受能力等[28]。在NF-YC编码基因中, 过表达OsNF-YC4能促进高温、干旱应答基因(OsHSP23.7、OsLEA3、OsRAB21等)的表达, 从而提高植株对高温干旱的抗性[29]。此外, 拟南芥AtNF-YC1 (AtHAP5A)通过调控Xyloglucan Endotransglucosylase/Hydrolase 21(AtXTH21)影响植株对冷胁迫的耐受能力, 过表达AtNF-YC1基因可显著提高植株对冷胁迫的抗性[30]。AtNF-YC10、AtNF-YA2、AtNF-YB3和DREB2A形成NF-YDREB2A复合物共同参与植株对热胁迫的调控, 在拟南芥和水稻中过表达AtNF-YC10均能显著提高植株对高温的耐受性[31-32]。这些研究结果均体现了NF-Y核因子在作物中的潜在应用价值。然而, 在玉米中关于NF-YC亚家族编码基因参与热胁迫应答调控的研究报道仍是缺乏。
实验室前期研究表明ZmNF-YC13基因受内质网胁迫诱导表达, 在玉米中超表达ZmNF-YC13可提高植株对内质网胁迫的耐受性[33]。本研究表明ZmNF-YC13还受热胁迫和渗透胁迫快速诱导表达,通过热诱导表达启动子驱动ZmNF-YC13基因可显著提高植株对高温的耐受性; 表达分析等表明ZmNF-YC13在高温条件下可能是通过增强热胁迫应答基因的表达来提高植株的耐热能力。本研究不仅丰富了NF-YC转录因子在热胁迫应答通路中的调控模式, 也为利用该位点进行耐热性辅助选择和种质资源鉴定提供了理论依据。
1 材料与方法
1.1 非生物胁迫处理及表达分析
实验室苗期玉米材料均播于Pindstrup基质中,置于光照培养箱(PERCIVAL, 美国)培养, 参数设置为温度28 ℃/ 25 ℃, 光周期16 h/8 h, 光照强度250 µmol m-2s-1, 湿度40%~60%。对ZmNF-YC13基因在高温处理下的表达模式进行分析时, 转基因受体材料播种后第10天, 保留长势一致的植株并提前一天浇足水, 将培养箱温度调为45℃, 光照强度125 µmol m-2s-1, 分别在0、0.5、1、2和5 h取第2叶相同部位组织, 液氮速冻后于超低温冰箱保存待用。对ZmNF-YC13基因在渗透胁迫处理下的表达模式进行分析时, 播种后第10 d, 保留长势一致的植株, 用10%的PEG-6000溶液彻底浇透, 分别在0、0.5、1、2和5 h取第2叶相同部位组织, 液氮速冻后于超低温冰箱保存待用。利用热敏感和耐热自交系进行表达分析时, 在播种后10 d, 保留长势一致的植株并提前一天浇足水, 将培养箱温度调为45℃,光照强度125 µmol m-2s-1, 分别在0 h和0.5 h取第2叶相同部位组织, 液氮速冻后于超低温冰箱保存待用。
玉米叶片总RNA采用天根生化科技(北京)有限公司的RNAprep pure Plant Kit提取, cDNA第一链合成采用RevertAid First Strand cDNA Synthesis Kit(Thermo Fisher Scientific, Waltham, 美国)进行。荧光定量PCR仪CFX96 Touch Cycler System (Bio-Rad,Hercules, 美国)和荧光染料SYBR Premix ExTaqII(Takara Biomedical Technology, 中国北京)用于qRT-PCR检测。每个样品设置3个技术重复,18S rRNA用作内参基因, 利用比较CT值法进行计算相对表达量(引物序列见附表1)。
1.2 玉米遗传转化及阳性鉴定
首先从拟南芥基因组中克隆热诱导表达基因AtHSP21起始密码子上游2 kb序列(HSP21Pro)[14],利用限制性内切酶EcoR I、BamH I对已构建完成的载体pCAMBIA3301-Ubi:ZmNF-YC13-myc进行线性化(同时去掉Ubi启动子序列)[34], 再借助重组连接酶ClonExpress II One Step Cloning Kit (Vazyme,中国南京)完成HSP21Pro序列和pCAMBIA3301-ZmNF-YC13-myc线性质粒的连接, 形成pCAMBIA3301-HSP21 Pro:ZmNF-YC13-myc环状质粒。最后将经测序分析确认正确的质粒转入农杆菌EHA105中, 保存备用。玉米遗传转化采用农杆菌介导浸染玉米未成熟幼胚的方法进行[35], 草铵膦(5 μg L-1)用于组织培养过程中的阳性植株筛选。T3代纯合植株在高温处理不同时间段的叶片总蛋白用于Western blot检测ZmNF-YC13-myc融合蛋白的表达情况。
1.3 荧光素酶报告基因试验
对于荧光素酶报告基因实验,ZmNF-YC13编码序列用于构建35S:ZmNF-YC13 (干扰质粒)载体,ZmHsfA2c起始密码子上游1 kb序列用于构建pGreenII 0800-ZmHsfA2cPro:LUC (报告质粒)载体(引物序列见附表 1), 载体序列连接均用ClonExpress II One Step Cloning Kit (Vazyme, 中国南京)完成。玉米叶片原生质体分离、提取和瞬时转化参照Mei等[34]描述方法完成, 质粒提取用天根无内毒素质粒小提中量试剂盒进行, 原生质体瞬时转化采用PEG-Ca2+介导转化法进行。细胞培养结束后,(1) 将细胞转移至1.5 mL离心管中, 110×g, 2 min,去上清; (2) 加入100 μL Lysis buffer至收集有原生质体的离心管中, 充分涡旋混匀; (3) 冰浴5 min,16,260×g, 30 s; (4) 根据Dual Luciferase Reporter Assay System试剂盒(Promega, 美国)说明书分别测定萤火虫荧光素酶活性值(LUC)和海肾荧光素酶活性值(REN)。
1.4 玉米苗期高温处理及表型分析
选择籽粒大小接近的野生型和ZmNF-YC13热诱导表达材料玉米种子播于Pindstrup基质中, 置于光照培养箱(PERCIVAL, 美国)培养, 温度28℃/25℃, 光周期16 h/8 h, 光照强度250 µmol m-2s-1,湿度40%~60%。播种后第10天, 保留长势一致的植株并提前一天浇足水, 将培养箱温度调为45℃, 光照强度125 µmol m-2s-1, 继续培养8 h。处理结束后将培养箱参数调至正常模式继续培养15 d, 培养过程中适时补充水分和营养。恢复培养结束后, 分别测量第5叶和第6叶(心叶)长、第5叶宽、地上部粗(地下与地上连接处以上1 cm位置, 用游标卡尺测量)和地上部分、地下部分鲜重。测干重前, 先用110℃烘6 h, 再用80℃烘干至恒重。
1.5 热诱导表达材料Western blot检测
对ZmNF-YC13热诱导表达材料在高温处理下的表达情况进行检测时, T3代纯合转基因材料播种后第10天, 保留长势一致的植株并提前一天浇足水,将培养箱温度调为45℃, 光照强度125 µmol m-2s-1,分别在0、0.5、1、2、5、12、24、36和48 h取植株相同部位叶片, 快速称量1 g组织于液氮速冻后放入超低温冰箱保存待用。提取总蛋白时, 液氮充分研磨组织后, 加入1 mL预冷蛋白提取液(50 mmol L-1Tris-HCl, 1 mmol L-1EDTA, 150 mmol L-1NaCl,10% Glyerol, 1 mmol L-1PMSF), 轻柔混匀后, 置于4℃冰箱, 颠倒摇30 min; 随后4 ℃, 16,260×g,30 min, 收集上清即为蛋白溶液。变性凝胶电泳采用Bio-Rad电泳仪和蛋白电泳槽进行, 转膜采用Bio-Rad Transblot SD半干转系统(Bio-Rad, Hercules,美国)进行。一抗1∶2000稀释, 二抗1∶5000稀释,WesternSure PREMIUM Chemiluminescent Substrate(LI-COR, 美国)用于显影, C-DiGit Blot Scanner(LI-COR, 美国)用于照相。所有操作步骤参照Mei等描述方法完成[33-34]。
1.6 下游基因表达特点分析
分析下游基因在高温处理下的表达特点时, 野生型和ZmNF-YC13热诱导表达材料培养和高温处理以及总RNA提取、反转录、和qRT-PCR检测均参照1.1中的实验方案进行。
1.7 染色质免疫共沉淀
将生长14 d的HSP21Pro:ZmNF-YC13-myc植株叶片(45℃处理2 h后)切成0.5~1.0 cm条状, 然后放入含1%甲醛的固定液中, 冰上真空(0.08 MPa)交联10 min后, 加入甘氨酸(终浓度为0.125 mol L-1), 再真空渗透10 min, 停止交联, ddH2O冲洗3次, 用滤纸快速吸干材料表面液体后放入液氮速冻。组织均一化和细胞核提取参照Cold Spring Harbor方法进行[36]。琼脂糖磁珠Binding control用于细胞裂解液预清除, GFP-Trap 琼脂糖磁珠和 Myc-Trap琼脂糖磁珠(ChromoTek GmbH,德国)用于免疫沉淀。QIAquick PCR Purification Kit (QIAGEN, 德国)用于纯化回收input和沉淀后DNA。qPCR检测分析后以GFP-Trap作为对照进行计算富集度, 分别进行3次独立实验(引物序列见附表1)。
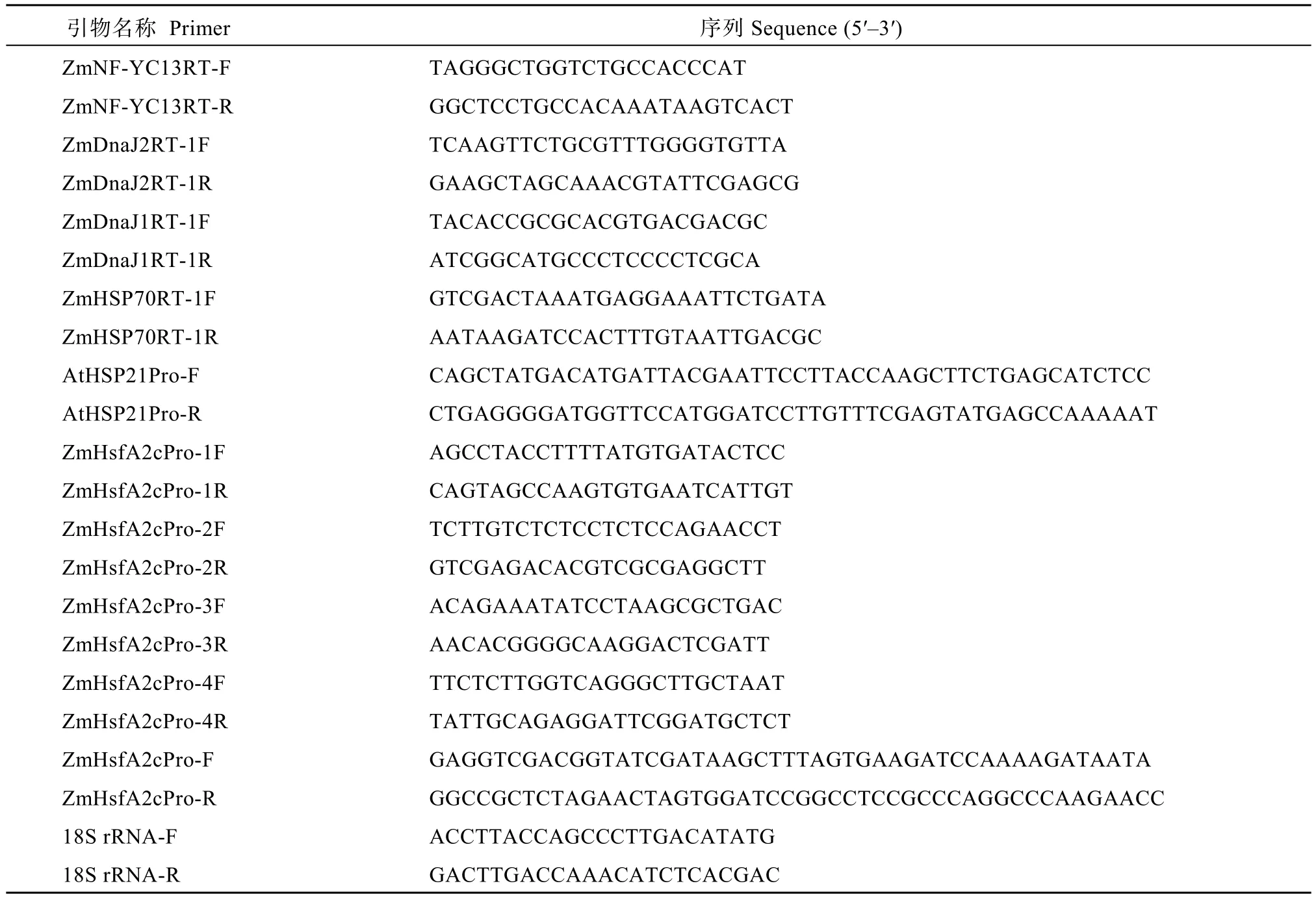
附表1 本研究中所用引物Table S1 Primers used in this study
2 结果与分析
2.1 ZmNF-YC13表达特点分析及热诱导表达材料创制
在实验室前期研究中, 筛选出了响应内质网胁迫应答调控因子ZmNF-YC13, 并证实该基因在玉米内质网胁迫应答调控过程中具有重要作用[33]。进一步对该基因在其他非生物胁迫条件下的分析表明,ZmNF-YC13基因的表达受到渗透胁迫和高温的快速诱导, 随后下降(图1-A)。为进一步分析ZmNF-YC13基因表达量与玉米耐热性的关系, 我们选取了在耐热能力上具有极端差异(耐热型和热敏感型)的玉米自交系, 并于高温胁迫处理前后分别检测了ZmNF-YC13基因的表达量。结果表明, 在正常条件下, 耐热型自交系材料中ZmNF-YC13基因的表达量均高于热敏感型自交系材料(图1-B)。45℃高温处理1 h后,ZmNF-YC13基因在各自交系材料中出现了不同程度的响应, 在耐热型自交系材料中上调水平更高, 且该基因整体的表达水平高于热敏感型自交系材料(图1-C)。上述结果说明,ZmNF-YC13基因可能参与玉米热胁迫应答调控过程。
组成型表达ZmNF-YC13虽在一定程度上提高玉米植株对非生物胁迫的抗性, 但过高的ZmNFYC13基因表达量同时也会抑制植株的生长[34]。为避免提高ZmNF-YC13基因表达量对植株生长带来的迟缓效应, 我们克隆了拟南芥热诱导表达基因AtHSP21基因启动子, 构建了利用该启动子表达ZmNF-YC13基因的玉米转基因材料(HSP21Pro:ZmNF-YC13-myc)。随后我们在高温处理前以及高温处理后不同时间段利用anti-myc抗体在蛋白水平上对T3代纯合材料HSP21Pro:ZmNF-YC13-myc检测表明, 在正常培养条件下(0 h), ZmNF-YC13-myc融合蛋白的表达量较低; 受到45℃高温处理后,ZmNF-YC13-myc的蛋白水平快速积累。该结果表明成功构建了ZmNF-YC13基因的热诱导表达玉米材料(图1-D)。
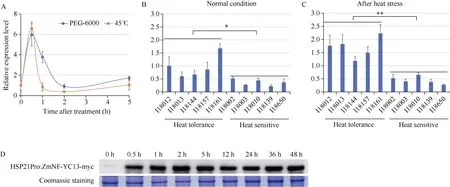
图1 ZmNF-YC13在不同条件和材料中的表达分析Fig. 1 Relative expression level ofZmNF-YC13under different conditions and inbred lines in maizeA: 高温和渗透胁迫处理条件下ZmNF-YC13基因叶片中的表达特点分析; B: 正常生长条件下耐热型和热敏感型玉米自交系植株叶片中ZmNF-YC13基因表达量分析; C: 高温胁迫处理后耐热型和热敏感型玉米自交系植株中ZmNF-YC13基因表达量分析; 每组试验均采用3次生物学重复, 数据显著性分析采用Student’st测验(双尾), *:P< 0.05, **:P< 0.01; D: HSP21Pro:ZmNF-YC13-myc植株在高温处理下ZmNF-YC13-myc融合蛋白检测。A: relative expression level ofZmNF-YC13genes in maize leaves under heat stress and osmotic conditions. B:ZmNF-YC13gene expression in heat-tolerant and heat-sensitive maize inbred plants leaves under normal condition. C:ZmNF-YC13gene expression in heat-tolerant and heat-sensitive maize inbred plants leaves after heat stress. Data are means of three biological replicates. Differences among data were tested using two-tailed Student’st-test. *:P< 0.05, **:P< 0.01. D: ZmNF-YC13-myc fused protein analysis of the HSP21Pro:ZmNF-YC13-myc plants leaves under heat stress by Western blot.
2.2 热诱导表达ZmNF-YC13基因提高玉米苗期植株的耐热能力
我们进一步对通过热诱导表达ZmNF-YC13基因是否能够提高玉米苗期植株的耐热能力进行了分析。在正常培养条件下, 野生型植株与ZmNF-YC13热诱导表达植株的长势无显著差异(图2-A)。在经过45℃高温胁迫处理8 h后, 野生型植株和ZmNF-YC13热诱导表达植株的叶片均出现了不同程度的卷曲和萎蔫现象(图2-B)。将处理后的植株在正常条件下恢复培养15 d后,ZmNF-YC13热诱导表达植株的长势均优于野生型的植株(图2-C)。同时, 我们对野生型植株和ZmNF-YC13热诱导表达植株正常培养条件下和在高温处理后的生物量进行了测定。结果表明, 在高温处理之后,ZmNF-YC13热诱导表达植株的地上部和地下部的鲜重和干重均显著高于野生型植株; 第6叶、第5叶长度和宽度以及地上部粗度(地下部和地上部连接处以上1 cm位置)均显著高于野生型植株(图2-D, E)。以上结果说明, 热诱导表达ZmNFYC13基因能够提高玉米苗期植株的耐热能力。

图2
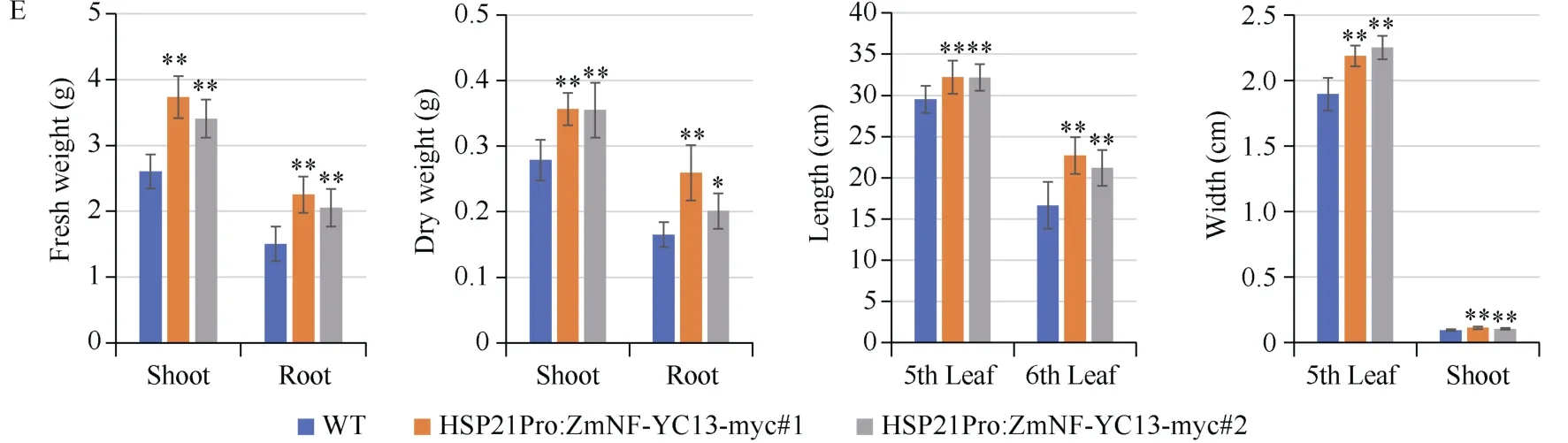
图2 野生型与ZmNF-YC13热诱导表达材料在高温处理后的表型分析Fig. 2 Phenotypic analysis of wild-type (WT) and HSP21Pro:ZmNF-YC13-myc plants under heat stressA~D: 野生型和ZmNF-YC13诱导材料在正常条件和高温处理后的植株长势形态, D图中箭头指示为第5叶, 比例尺为5 cm; E: 高温处理后野生型和ZmNF-YC13热诱导材料叶长、叶宽、地上部粗、地上部分和地下部分的鲜重和干重统计; 显著性分析采用Student’st测验(双尾),n> 20,*:P< 0.05,**:P< 0.01。A-D: Plant morphologies of wild-type (WT) and HSP21Pro:ZmNF-YC13-myc plants before and after high temperature treatment. The arrow in Fig. 2-D indicates the fifth leaf, Bar: 5 cm. E: leaf length, leaf width, shoot thickness, and biomass of the wild-type (WT) and HSP21Pro:ZmNF-YC13-myc plants after high temperature treatment. Data are means of three biological replicates. Differences among data were tested using two-tailed Student’st-test.*:P< 0.05,**:P< 0.01.
2.3 ZmNF-YC13调控热胁迫诱导表达基因的表达
由于高温胁迫是自然条件下引起内质网胁迫的主要因素之一[37]。因此我们猜测ZmNF-YC13在内质网胁迫应答通路中调控的下游基因(ZmDnaJ1、ZmDnaJ2、ZmHSP70和ZmHsfA2c等)可能同样参与了热胁迫应答调控[33,38]。为证实这一猜测, 我们首先对受ZmNF-YC13调控的下游基因在高温处理下的表达特点进行了分析。结果表明, 在45℃高温处理下,野生型玉米植株中ZmDnaJ1、ZmDnaJ2、ZmHSP70和ZmHsfA2c基因的表达量快速增加, 且在1 h左右达到高峰, 说明ZmDnaJ1、ZmDnaJ2、ZmHSP70和ZmHsfA2c基因是热胁迫应答基因。在ZmNF-YC13热诱导表达材料中,ZmDnaJ1、ZmDnaJ2、ZmHSP70和ZmHsfA2c基因受高温诱导表达的程度较野生型植株明显提高, 表明提高ZmNF-YC13基因表达量能增强热胁迫诱导表达基因的表达(图3)。

图3 高温胁迫应答基因在野生型材料和ZmNF-YC13热诱导材料中的表达模式分析Fig. 3 Relative expression patterns of heat stress responsive genes in wild-type and HSP21Pro:ZmNF-YC13-myc plants
2.4 ZmNF-YC13调控ZmHsfA2c基因表达
由于热应激转录因子在植物热胁迫应答调控中具有重要作用, 且Gu等研究表明在拟南芥中超表达HSFA2(ZmHsfA2c)可提高植株耐热能力[39], 而在本研究中发现ZmHsfA2c的表达量受ZmNF-YC13的调控。为了进一步证实ZmNF-YC13-ZmHsfA2c这一调控通路, 我们利用荧光素酶报告基因实验和ChIP-qPCR进一步进行了分析。荧光素酶报告基因实验结果表明, ZmNF-YC13蛋白可显著激活ZmHsfA2c基因的启动子(图4-A)。利用染色质免疫共沉淀并结合qPCR的方法对ZmHsfA2c基因起始密码子ATG上游1 kb范围的启动子区域分析表明, 目标蛋白在ZmHsfA2c基因的启动子区段2和区段3上有较高的富集峰(图4-B)。我们进一步对启动子区段2和区段3的序列分析发现, 在区段中存在两个典型的热胁迫应答元件(heat shock element, HSE)(图4-C)。以上结果表明, ZmNF-YC13能够调控ZmHsfA2c基因表达, 可能依赖于热胁迫应答元件。
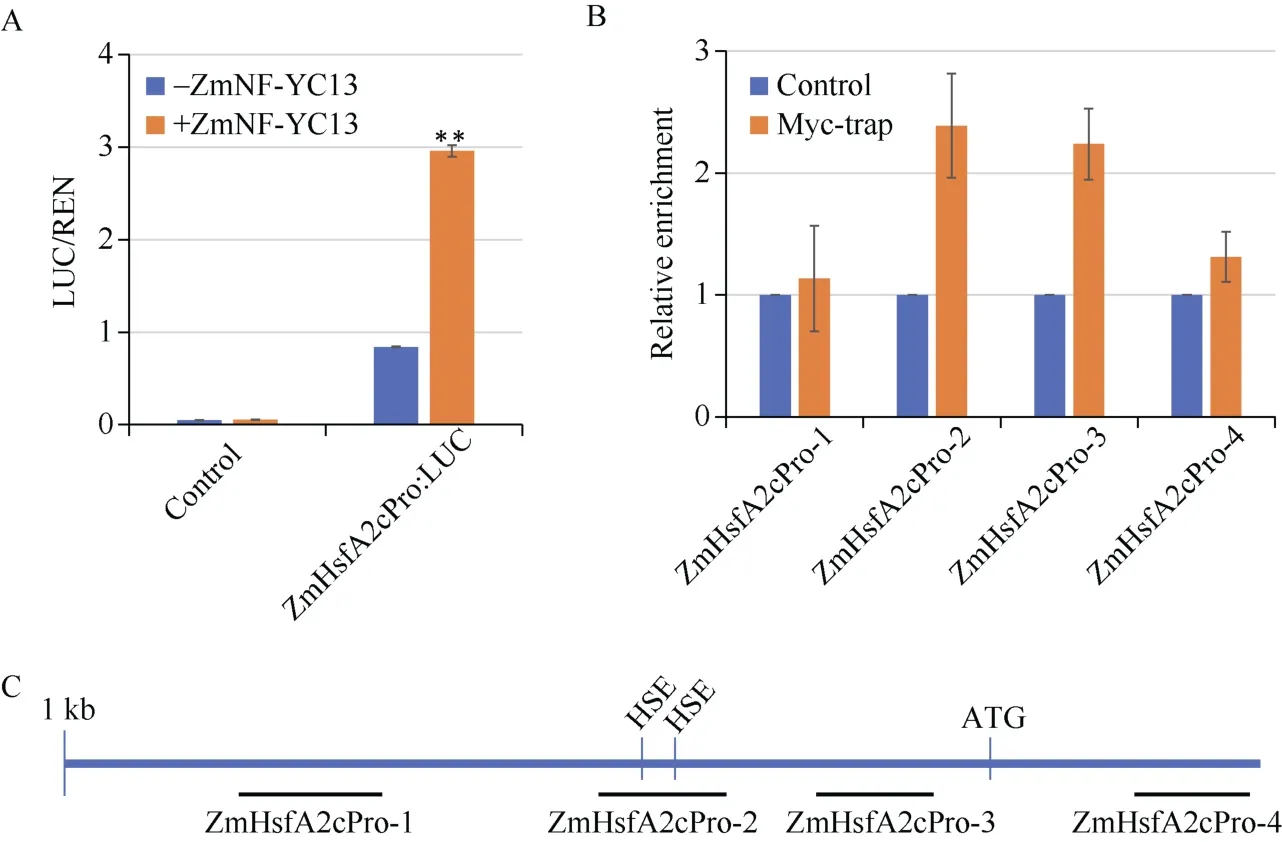
图4 ZmNF-YC13调控ZmHsfA2c基因表达Fig. 4 Relative expression levels ofZmHsfA2cgenes regulated by ZmNF-YC13A:ZmHsfA2c基因启动子和ZmNF-YC13蛋白之间的反式激活效应分析。-ZmNF-YC13表示不含有ZmNF-YC13蛋白(对照),+ZmNF-YC13表示含有ZmNF-YC13蛋白。数据为3次独立实验的平均值。**: P< 0.01。B:ZmNF-YC13基因的启动子结合位点ChIP-qPCR分析。数据为3次独立实验的平均值。C: 用于ChIP-qPCR分析的ZmHsfA2c启动子片段示意图。A: the transactivation ofZmHsfA2cpromoter and ZmNF-YC13. For the transactivation, -ZmNF-YC13 means empty effector plasmid and+ZmNF-YC13 means ZmNF-YC13-fused effector plasmid. Data are means ± SDs of three independent experiments.**: P< 0.01. B: the promoter binding site analysis ofZmNF-YC13. The experiment was performed by three independent experiments. C: the schematic diagram of theZmHsfA2cpromoter fragments using for ChIP-qPCR analysis.
3 讨论
植物作为一种固着生物, 其生长发育极易受到自然环境的影响, 如高温破坏植物细胞膜系统的稳定性、引起细胞内酶系统紊乱、籽粒过早脱水等, 从而扰乱其正常的生理阶段和进程, 使生长发育和产量形成受到严重影响[40]。植物在进化过程中从分子、细胞和生理生化层面上也形成了一系列的调节机制,以应对或缓解环境变化所带来的影响[41]。如在高温胁迫下, 植物细胞首先感知高温刺激并将信号放大传递至胞内, 进而激活一系列高温胁迫应答基因的表达以此来应对或缓解高温带来的损伤, 这一信号转导机制和转录调控网络在植物响应高温胁迫过程中至关重要, 而与热胁迫应答相关的转录因子作为调控下游靶基因表达的分子开关, 在这个过程中具有不可替代的作用[42-43]。
Mei等[33-34]研究发现ZmNF-YC13基因受内质网胁迫(用化学试剂二硫苏糖醇和衣霉素处理)诱导表达, 编码核内蛋白, 且具备一定的转录激活能力;在玉米中组成型表达ZmNF-YC13基因后能够提高植株对内质网胁迫的耐受能力[33]。在自然环境中,高温是诱导产生内质网胁迫的重要因素[37]。因此,本研究中进一步分析了ZmNF-YC13基因在高温和渗透胁迫下的表达特点。结果表明ZmNF-YC13基因受高温和渗透胁迫快速诱导表达, 说明ZmNFYC13可能是一个响应热胁迫应答的转录调控因子。然而提高ZmNF-YC13基因的表达量虽能提高植株对内质网胁迫的耐受能力, 但过高的ZmNF-YC13表达量同时也抑制植株叶片的生长[34]。为了能利用提高ZmNF-YC13基因表达量来增强植株的抗逆性, 同时又尽可能消除过高的ZmNF-YC13表达量带来的不良效应, 我们创制了利用拟南芥热胁迫应答基因AtHSP70的启动子在玉米中驱动ZmNF-YC13基因表达的转基因玉米材料。高温条件下的表型分析也证实了通过热诱导表达ZmNF-YC13基因能够增强玉米植株的耐热能力。
热激蛋白是生物体在感知到高温、干旱等不利环境因素时诱导合成的一类结构保守的应激蛋白, 是植物短暂适应或应对逆境胁迫不可或缺的成分[44]。如在玉米、水稻、小麦和甘蔗等中的研究表明, HSP70热激蛋白受热诱导并在响应热胁迫的过程中发挥重要作用[44]。DnaJ蛋白是生物体内重要的分子伴侣类因子[45], 它具有独自或协助HSP70完成蛋白质折叠、解折叠、聚合和调节蛋白复合物解聚等功能, 是植物在逆境胁迫条件下维持蛋白质或蛋白复合体稳定的重要角色[46]。如番茄的DnaJ蛋白SICDJ2可通过维持较低的蛋白水解酶活性来延缓Rubisco的降解速度, 从而缓解高温对光合作用的抑制效应[47]。拟南芥DnaJ蛋白TMS1通过与未折叠蛋白应答途径的重要因子BiP1和BiP3蛋白互作来参与未折叠蛋白再折叠和降解的调控过程, 进而在花粉管及其他组织耐热性中发挥作用[48]。在玉米ZmNF-YC13基因的组成型表达材料中,ZmDnaJ1、ZmDnaJ2和ZmHSP70等基因的表达量得到显著上调, 表明这些基因可能受ZmNF-YC13蛋白的调控; 荧光素酶报告基因实验进一步证实了ZmNF-YC13蛋白能够激活ZmDnaJ2和ZmHSP70基因的启动子活性[33]。并且在内质网胁迫条件下, ZmNF-YC13转录因子能够通过调控ZmDnaJ1、ZmDnaJ2和ZmHSP70基因的表达来缓解植株的受胁迫状态[33]。本研究中的表达分析表明,ZmDnaJ1、ZmDnaJ2和ZmHSP70等基因的表达受热胁迫快速诱导, 而且ZmNF-YC13蛋白能够在高温条件下增强上述基因的表达。
除了热激蛋白及其辅助因子外, 热激转录因子是存在于真核生物体内调控热胁迫应答的一类重要转录因子。例如,HsfA1a是番茄(Lycopersicon esculentum)中热胁迫应答的主要调节因子[11]; 在拟南芥中,HsfA1a和HsfA1b在热胁迫应答早期诱导热激蛋白编码基因的表达中起重要作用[49]。HsfA2基因的表达在番茄[50]和拟南芥[51]中受热胁迫强烈诱导,并且HsfA2在植物长期热胁迫条件下或热胁迫后恢复过程中对HSP基因的转录调控起重要作用[52], 也是拟南芥植株保持获得性耐热能力的必需基因[17]。此外, 在拟南芥中超表达玉米HSFA2(ZmHsfA2c)基因能够提高植株的耐热性[39]。在本研究中, 表达分析、荧光素酶报告基因实验以及ChIP-qPCR等实验表明ZmNF-YC13能调控ZmHsfA2c的表达, 说明ZmNF-YC13在热胁迫应答途径中是一个重要的上游调控子, 由此也反应出ZmNF-YC13可能从多个途径参与了玉米热胁迫应答的调控过程。前人的研究结果中, 水稻OsNF-YC4通过调控OsHSP23.7等基因提高植株对高温的耐受性[29], 拟南芥AtNFYC10以NF-Y-DREB2A复合物形式调控HSP17.6A、HsfA2、HsfA3和HsfA7等基因的表达来参与对热胁迫的响应[31]。本研究结果不仅表明ZmNF-YC13可通过调控HSP70和HsfA2c等基因的表达来响应热胁迫, 还揭示了 DnaJ类分子伴侣因子也是ZmNF-YC13蛋白调控的重要下游基因。因此, 本研究不仅拓展了NF-YC转录因子在热胁迫通路中调控的下游基因, 同时也证实了植物内质网胁迫应答和植物热胁迫应答在调控通路上存在交叉。
4 结论
本研究结果表明玉米核因子编码基因ZmNFYC13受高温和渗透胁迫诱导表达, 在玉米中热诱导表达ZmNF-YC13可提高玉米苗期植株的耐热能力。对野生型和转基因材料在高温条件下的表达分析表明ZmNF-YC13在热胁迫条件下可增强热胁迫应答基因的表达; 荧光素酶报告基因实验和ChIP-qPCR实验表明ZmNF-YC13还能调控热激转录因子编码基因ZmHsfA2c的表达。因此, 本研究结果表明ZmNF-YC13是玉米响应热胁迫应答过程中的重要调控因子, 热诱导表达ZmNF-YC13可能是通过增强下游热胁迫应答基因的表达来提高植株的耐热能力。
