甘蔗割手密种LRRII-RLK基因家族演化和表达分析
2023-05-11丁洪艳冯晓溪汪柏宇张积森
丁洪艳冯晓溪汪柏宇张积森,*
1广西大学农学院, 广西南宁 530004;2广西大学亚热带农业生物资源保护与利用国家重点实验室, 广西南宁 530004;3福建农林大学农学院, 福建福州 350002
植物类受体蛋白激酶(receptor-like protein kinases, RLK)是一种类似于动物受体蛋白激酶(receptor protein kinases, RPK)的丝氨酸/苏氨酸蛋白激酶, 在信号转导方面与动物十分相似。RLKs参与了植物各种各样的生物过程, 包括植物生长发育调控、激素感知、病害防御及自交不亲和性识别等[1]。RLK基因家族是植物基因家族中的一类超家族, 具有数量非常庞大的家族成员, 在拟南芥中至少有610个RLK基因[2], 水稻大约有1132个RLK基因[3]。RLK基因家族编码植物中一种非常重要的细胞识别受体, 在细胞信号转导过程中发挥着重要作用, 它是一种跨膜蛋白, 具有特定的氨基末端胞外结构域和羧基末端胞内结构域, 这些结构域涉及广泛的信号转导途径[4]。大多数RLK基因定位于细胞质膜, 也有一些既不具有胞外结构域, 也不具有跨膜结构域的成员, 定位于细胞质中, 被称为细胞质受体样激酶(receptor-like cytoplasmic kinase,RLCK)。根据RLK胞外结构域和胞内激酶结构域的特征可以将RLK家族分为几十种亚家族, 其中富含亮氨酸重复序列(leucine-rich repeat, LRR)结构域的LRR-RLK家族是其最大的亚家族, 拟南芥中含有225个该亚家族的成员, 可以再将其分为15个亚家族(LRR I-LRR XV)[5]。
LRR-RLK基因功能的研究表明, 它们有2个主要功能: 防御病原体和参与植物生长发育[6-7]。拟南芥中LRR-RLK基因家族的CLV1和BAK1在植物生长发育中发挥着重要作用, 其中CLV1具有抑制细胞增长的作用, 它通过介导CLAVATA信号通路与CLV2形成异二聚体, 然后通过胞外结构域与CLV3相互作用, 从而控制顶端分生组织细胞的大小[8];LRR-RLK基因大部分成员参与植物抵御外界的生物胁迫和非生物胁迫, 例如FLS2和EFR介导植物对细菌病原体的抗性[9-10]; 属于RLK超家族的LRR的亚家族II的基因BAK1, 通过与油菜素内酯受体BRI1体内体外相互作用而参与植物的生长发育调节, 并且通过与FLS2相互作用参与病害防御[11-12]。新发现的植物另一种病毒防御机制依赖于跨膜免疫受体核穿梭蛋白(nuclear shuttle protein, NSP)-相互作用激酶1 (NSP-interacting kinase 1, NIK1)介导的宿主翻译抑制,NIK1在防御病毒侵染表现出的活性,被认为是双生病毒NSPs的毒力靶标, 它在病毒侵染期间与双生病毒的核穿梭蛋白相互作用[13-14]。拟南芥中NIK的3个旁系同源基因(AtNIK1、AtNIK2、AtNIK3)也有报道与NSP相互作用, 参与病毒防御[15-16], NIK结构类似于SERK, NIK基因和SERK基因都是LRRII-RLK亚家族的成员。
甘蔗(Saccharumspp.)是经济上非常重要的生物能源作物和糖料作物, 主要分布在热带和亚热带地区[17]。现代甘蔗栽培品种主要是异源多倍体和种间杂交种, 是由含糖量高的热带种(Saccharum officinarum)和抗逆性强的割手密种(Saccharum spontaneum)杂交, 并经过多次与热带种回交或相互杂交而来。与其他作物相比, 甘蔗的遗传背景十分复杂且基因组庞大, 所以甘蔗在遗传学方面的研究一直很迟缓, 直至2018年甘蔗割手密种AP85-441基因组的首次破译, 而使得甘蔗基础生物学的研究又跨越一个新的台阶[18]。本研究通过与拟南芥的LRRII-RLK 基因进行比较, 在割手密种中对LRRII-RLK基因进行了鉴定和分类。同时, 通过比较基因组和比较转录组的方法对甘蔗LRRII-RLK基因家族的演化、基因结构和表达模式等进行了分析。研究结果为进一步揭示甘蔗LRRII-RLK基因家族在植物生长发育和病毒防御过程中的功能奠定了基础。
1 材料与方法
1.1 试验材料
本研究所使用的甘蔗材料分别为甘蔗割手密种SES 208 (2n=8x=64), 和以SES 208花药离体培养产生的四倍体材料AP85-441 (2n=4x=32), 种植于福建农林大学金山校区中华园温室试验基地; 还有对梢腐病(pokkah boeng disease, PBD)高度敏感的甘蔗现代栽培品种中蔗1号(Zhongzhe 1, ZZ1)和对甘蔗花叶病(Sugarcane mosaic disease)高度易感的热带种拔地拉(Badila), 种植于广西大学扶绥试验基地。
1.2 LRRII-RLK基因家族鉴定
甘蔗割手密种AP85-441基因组相关数据通过在线数据库(http://sugarcane.zhangjisenlab.cn/sgd/html/index.html)获得。从拟南芥(Arabidopsis thaliana)在线信息资源库TAIR (http://www.arabidopsis.org/)下载14个拟南芥LRRII-RLK基因的蛋白序列[5]。以这14个蛋白序列为查询序列, 利用Blastp软件, 检索本地甘蔗割手密种数据库中LRRII-RLK蛋白, 获得LRRII-RLK亚家族的候选基因。再通过在线工具SMART (http://smart.emblheidelberg.de/)和NCBI CD-search (https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对候选基因蛋白的保守结构域进行预测,并从中进一步筛选出有拟南芥LRRII-RLK相同蛋白结构域的基因, 再通过TMHMM网站(http://www.cbs.dtu.dk/services/TMHMM/)预测它们的跨膜结构域[19], 确保上述候选基因同时含有胞外LRR结构域、跨膜区和胞内丝氨酸/苏氨酸激酶结构域。将通过上述方法确定的SsLRRII-RLK基因候选成员与拟南芥的225个LRR-RLK基因家族成员使用Fastree软件构建系统发育树[20], 将其中与拟南芥LRRII-RLK聚类在同一分支的基因确定为甘蔗割手密种LRRII-RLK家族的成员。从植物基因组网站 Phytozome (https://phytozome.jgi.doe.gov/)和EnsemblPlant (http://plants.ensembl.org/index.html)数据库分别下载的高粱和水稻的蛋白序列, 以同样的鉴定方法获得它们的LRRII-RLK基因家族成员。通过与高粱同源蛋白序列比较, 筛选出不同SsLRRII-RLK等位基因的代表性基因, 根据其在染色体上的物理位置, 将16个具有代表性的SsLRRIIRLK基因从SsLRRII-RLK1命名至SsLRRII-RLK16,将其确定为甘蔗割手密种LRRII-RLK家族的单倍型基因, 随后用数字补充等位基因名称, 等位基因ID中末尾是P或T的基因, 不视为等位基因, 命名时将其重新编号, 高粱的LRRII-RLK基因家族成员也采用相同的命名方法命名[21]。利用ExPASy7的在线工具ProtParam (https://web.expasy.org/protparam/)对鉴定到的甘蔗LRRII-RLK基因的理化性质进行了预测。
1.3 甘蔗LRRII-RLK基因家族生物信息学分析
将鉴定得到的甘蔗割手密种LRRII-RLK基因序列与拟南芥、水稻和高粱的蛋白序列利用MAFFT软件[22]进行比对, 采用默认参数。最大似然(ML)树由FastTree构建, 根据拟南芥分类标准对家族成员进行分类。将已报道的蔷薇科的草莓(Fragaria ananassa)、苹果(Malus domestica)、中国白梨(Pyrus bretschneideri)、梅(Prunus mume)、桃子(Prunus persica)[23], 柑橘属的克莱门柚(Citrus clementina)和甜橙(Citrus maxima)[24], 以及棉花(Gossypium hirsutum)[25]、萝卜(Raphanus sativusL.)[26]、番茄(Solanum lycopersicum)[27]、马铃薯(Solanum tuberosum)[28]、黄瓜(Cucumis sativus)[29]等物种的LRRII-RLK成员的基因序列, 通过在线数据库网站(http://www.timetree.org/)构建LRRII-RLK基因的系统发育树。利用在线网站GSDS 2.0 (http://gsds.gao-lab.org/)绘制甘蔗割手密种LRRII-RLK基因内含子-外显子结构的示意图, 每个基因结构都是根据系统发育树位置排列的[30]。利用在线软件MEME Version 5.4.1(http://meme-suite.org/tools/meme)对这些基因的蛋白序列进行保守基序分析, 基序数量设置为10, 其他参数默认[31]。提取LRRII-RLK基因上游2000 bp启动子序列, 使用在线网站PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测启动子中的顺式作用元件, 只保留了典型的和功能性的顺式元件, 过滤掉了大多数基因中普遍存在的顺式作用元件, 例如CAAT-box、TATA-box、TATC-box等。
1.4 甘蔗LRRII-RLK基因家族共线性分析
根据甘蔗的基因组注释信息获得LRRII-RLK基因的染色体位置信息, 利用Blastp软件和MCScanX软件进行基因共线性分析[32], 最后使用circos v 0.69-8软件对染色体定位和种内共线性基因对进行可视化[33]。运用JCVI软件[34]对甘蔗和高粱种间共线性进行分析和可视化, 通过 KaKs_Calculator Version 2.0软件计算甘蔗割手密种LRRII-RLK基因家族与高粱SbLRRII-RLK基因之间的Ka/Ks值[35],分歧时间(T)通过公式T = Ks/(2×6.5×10-9)×10-6计算得出[36]。
1.5 甘蔗LRRII-RLK基因家族的表达分析
本研究基于本实验室和合作实验室现有的甘蔗不同发育组织、叶片梯度、昼夜节律和不同病害侵染叶片的转录组数据来探究SsLRRII-RLK基因在甘蔗中的表达模式。其中不同发育组织的转录组数据的材料使用SES 208苗期(35 d龄)、成熟前期(9个月龄)和成熟期(12个月龄)的叶和茎[37], 叶片发育梯度转录组材料来源于11 d龄的SES 208的卷叶, 昼夜节律转录组数据的材料使用19个时间点(从第1天凌晨06:00到第2天凌晨04:00间隔2 h取一次样,从第2天凌晨06:00到第3天凌晨06:00间隔4 h取一次样)的SES 208的成熟期+1叶片[38]。再结合本课题组现有的梢腐病胁迫下的中蔗1号和甘蔗花叶病胁迫下的拔地拉2种叶片转录组数据, 分析SsLRRII-RLK基因在病害胁迫下的表达模式。梢腐病胁迫下中蔗1号的转录组所用叶片材料中, 根据叶片染病的严重程度, 将其分为0~5级, 采集轻度病叶(1级或2级)和重度病叶(4级或5级), 还有健康叶片作为对照(CK); 在花叶病侵染试验中, 采用无病毒组织培养的拔地拉作为侵染对象, 在侵染后1个月后采集其+1叶, 以未脱毒的健康拔地拉+1叶片作为对照。以上转录组所用材料均设3个生物学重复。
1.6 总RNA提取和实时荧光定量PCR (qRTPCR)分析
使用TRIzol (Invitrogen)试剂分别提取甘蔗割手密种SES 208昼夜节律中间隔4 h不同时间点材料的总RNA, 使用反转录试剂盒StarScript II First-strand cDNA Synthesis Kit With gDNA Remover (A222-10,Genstar)合成cDNA。引物设计、qRT-PCR反应程序和使用仪器参考Li等[39], 引物名称及序列详见表1,使用 2-ΔΔCt法计算相关基因的相对表达量[40], 以GAPDH作为内参基因[41], 使用Graphpad prism 9.0软件绘图[42]。

表1 qPCR引物序列Table 1 Primers for qPCR study
2 结果与分析
2.1 甘蔗LRR-RLK基因家族成员的鉴定
通过Blastp软件比对, 再经过NCBI-CDD数据库和SMART在线程序的筛选, 最终在割手密种基因组中鉴定到27个LRRII-RLK基因, 同时分别在高粱和水稻中鉴定到15个和12个LRRII-RLK基因。由于甘蔗的同源多倍体特性, 鉴定得到的SsLRRIIRLK基因具有多个等位基因, 这些SsLRRII-RLK基因总的有1~3个等位基因, 其中3个SsLRRII-RLK成员有3个等位基因, 5个SsLRRII-RLK成员有2个等位基因。
根据蛋白质一级结构预测结果显示, 甘蔗割手密种LRRII-RLK氨基酸长度在336~982之间, 等电点在5.13~10.63之间, 分子量在37.00~105.55 kD之间, 蛋白质不稳定系数在26.89~46.82之间, 平均亲疏水性在-0.382~0.105之间(表2)。根据不稳定系数小于40为稳定蛋白、等电点小于7为酸性蛋白的规则, 推测甘蔗割手密种LRRII-RLK基因家族中, 有16个基因为稳定的酸性蛋白, 9个为不稳定的碱性蛋白, 2个为稳定的碱性蛋白。

表2 甘蔗割手密种LRRII-RLK家族基因和编码蛋白基本信息Table 2 Information of LRRII-RLK gene family inSaccharum spontaneum
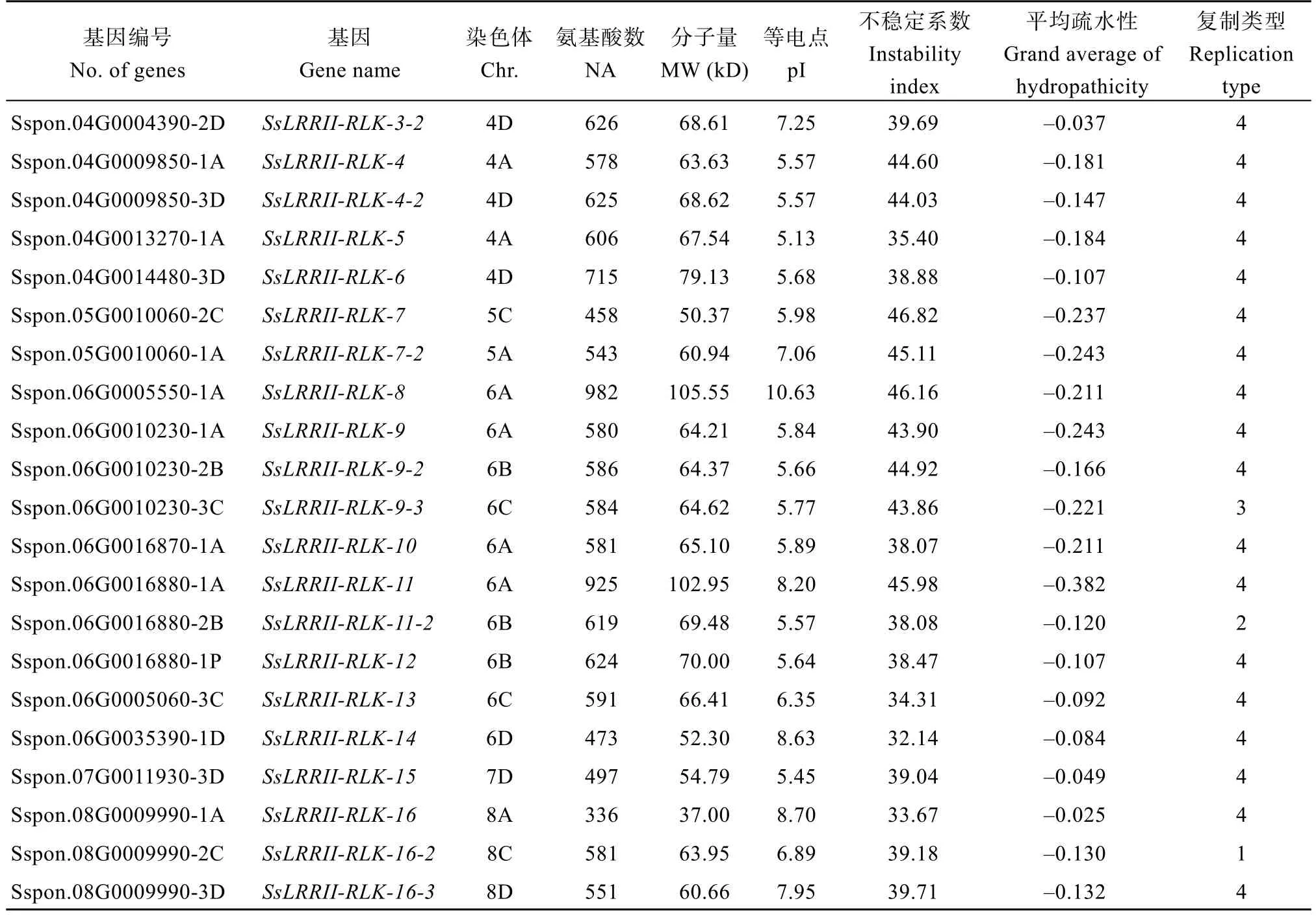
(续表2)
2.2 系统发育分析
将27个甘蔗、15个高粱和12个水稻的LRRIIRLK基因与14个拟南芥LRRII-RLK基因的蛋白序列进行比对, 构建ML系统发育树。结果表明, 甘蔗割手密种、水稻、高粱和拟南芥中LRRII-RLK基因的蛋白存在于所有簇中(图1), 根据拟南芥成员的聚类, 将这些分支分为NIK、SERK和LRRII-C 3个分支, NIK分支分别由11个甘蔗、9个高粱、6个水稻和6个拟南芥成员组成, 4个物种的LRRII-RLK基因在这个分支最多。SERK分支中将拟南芥5个SERK基因和7个甘蔗、4个高粱、3个水稻的LRRII-RLK基因聚集在一起。LRRII-C分支由9个甘蔗、2个高粱、3个水稻和3个拟南芥未知功能的LRRIIRLK基因组成。值得注意的是, 在NIK和SERK分支中, 甘蔗的LRRII-RLK单倍型基因数量与高粱中的一致, 而在LRRII-C分支中, 甘蔗的单倍型LRRII-RLK基因数量比高粱中的多了3倍, 这表明LRRII-C分支中的LRRII-RLK基因在甘蔗中出现了扩增。

图1 甘蔗(Ss)、拟南芥(AT)、水稻(Os)和高粱(Sb) LRRII-RLK蛋白的系统进化树Fig. 1 Phylogenetic tree of LRRII-RLKs informSaccharum spontaneum(Ss) and presentative species includingArabidopsis thaliana(AT),Oryza sativa(Os), andSorghum bicolor(Sb)
LRRII-RLK基因家族在植物中分布十分广泛,为了深入了解LRRII-RLK家族基因的系统发育关系,我们筛选了代表8个科的17个代表性物种, 构建了一个物种系统发育树, 包括禾本科、十字花科、蔷薇科、茄科等。由图2可知, LRRII-RLK基因在高等植物中的显著扩增和分化时间大约在120 Mya年之后,也就是白垩纪时期, 并且与其他禾本科物种相比,甘蔗拥有更多的LRRII-RLK基因, 可能是由于甘蔗同源多倍体的性质。当校正倍性水平后, 割手密种中SsLRRII-RLK基因的数量仍然高于大多数物种, 包括拟南芥和其他禾本科作物。与其他2种禾本科作物相比, 甘蔗和高粱的分化时间最晚, 由此也可以看出甘蔗和高粱的亲缘关系更近。

图2 17种植物的LRRII-RLK蛋白系统发育关系Fig. 2 Phylogenetic relationships of LRRII-RLK proteins in 17 plant species树的底部显示了时间Mya (百万年前)的标尺。17种植物包括: 甘蔗割手密种(Saccharum spontaneum)、水稻(Oryza sativa)、二穗短柄草(Brachypodium distachyon)、高粱(Sorghum bicolor)、马铃薯(Solanum tuberosum)、番茄(Solanum lycopersicum)、陆地棉(Gossypium hirsutum)、拟南芥(Arabidopsis thaliana)、萝卜(Raphanus sativus)、甜橙(Citrus sinensis)、柑橘(Citrus clementina)、黄瓜(Cucumis sativus)、草莓(Fragaria vesca)、梨(Pyrus bretschneideri)、苹果(Malus domestica)、梅(Prunus mume)、桃(Prunus persica)。Linear scale Time Mya (millions of years ago) was shown at the tree’s bottom. Seventeen plants includingSaccharum spontaneum,Oryza sativa,Brachypodium distachyon,Sorghum bicolor,Solanum tuberosum,Solanum lycopersicum,Gossypium hirsutum,Arabidopsis thaliana,Raphanus sativus,Citrus sinensis,Citrus clementina,Cucumis sativus,Fragaria vesca,Pyrus bretschneideri,Malus domestica,Prunus mume,andPrunus persica.
2.3 SsLRRII-RLK家族基因结构和保守基序
基因结构的多样性可能是基因家族进化的证据之一。本研究在甘蔗割手密种中预测了所有SsLRRII-RLK基因的外显子-内含子和保守基序。由图 3可知, 甘蔗割手密种LRRII-RLK基因外显子和内含子数量分别为2~12和1~11。在SERK和LRRII-C 2个分支中, 大多数LRRII-RLK基因包含8~11个外显子, 而且等位基因之间的基因结构都非常相似, 而在NIK分支中, LRRII-RLK基因的结构多样性更高, 例如SsLRRII-RLK2和SsLRRIIRLK162个基因都有一个等位基因的基因结构可能产生变异, 但是其他基因大多也是包含8~11个外显子, 说明LRRII-RLK基因家族在进化过程中也是比较保守的。
根据对全部割手密种LRRII-RLK基因蛋白序列的保守基序分析(图3), 共鉴定出10个保守基序,并根据每个基序的E值指定为基序1~10, 其中最为保守的是基序2和基序4, 它们在27个割手密种的LRRII-RLK基因中都存在。基序1和基序7分别只在2个和3个SsLRRII-RLK基因中没有发现, 且在甘蔗割手密种LRRII-RLK家族的3个主要分支中都尚未发现特异的保守基序。

图3

图3 甘蔗割手密种LRRII-RLK基因家族蛋白保守基序和基因结构分析Fig. 3 Analysis of conserved motifs and gene structure of LRRII-RLK gene family inSaccharum spontaneumA: SsLRRII-RLK基因结构分析, 不同颜色方框表示不同的基因结构, 黑线表示内含子。B: SsLRRII-RLK蛋白保守基序分析, 不同颜色方框表示不同保守基序, 黑线表示氨基酸序列。A: SsLRRII-RLK genes structure analysis, different colored boxes indicate different gene structures, black lines indicate introns. B:SsLRRII-RLK proteins conserved motif analysis, different colored boxes indicate different conserved motifs, and black lines indicate amino acid sequences.
2.4 顺式调控元件分析
启动子区的顺式作用元件对基因的转录和表达起着至关重要的控制作用, 因此对基因启动子顺式作用元件分析可以加深对基因功能的理解。顺式元件分析结果显示, 甘蔗割手密种LRRII-RLK基因启动子的基序涉及到其多种生物过程(图4)。这些不同的顺式调节元件在功能上可分为四大类: 响应光反应、响应激素反应、响应胁迫反应和植物生长代谢。第1类是光响应元件, 绝大多数的SsLRRII-RLK基因都包含有光响应元件, 例如, 保守的G-box广泛存在于基因的上游序列中。第2类是激素响应元件,在所有的激素响应元件中, 参与茉莉酸甲酯和脱落酸反应的元件在SsLRRII-RLK基因中占比较高, 其中26个基因启动子富含参与茉莉酸甲酯反应的调控元件CGTCA基序和TGACG基序, 21个基因启动子富含参与脱落酸反应的调控元件ABRE。根据预测结果, 这些SsLRRII-RLK基因可能调控植物中的MeJA和ABA信号, 并在植物防御和叶片脱落中发挥作用。第3类是参与胁迫响应的元件, SsLRRIIRLK基因在缺氧诱导和干旱诱导中所占比例较高,包含着部分低温反应元件(LTR)、防御和应激反应元件(TC-rich repeats), 表明SsLRRII-RLK基因可能参与胁迫响应的调控。第4类是响应植物生长代谢的元件, 如胚乳表达元件(GCN4-motif)、分生组织表达元件(CAT-box)、种子特异性调节元件(RY-element)等等, 除了这四大类元件, 还包含了一些最常见的启动子元件。

图4 甘蔗割手密种LRRII-RLK基因顺式元件分析Fig. 4Cis-elements analysis of LRRII-RLK genes inSaccharum spontaneum
2.5 染色体定位和共线性分析
基因复制是基因组一个十分显著的特征, 多项研究表明, 基因家族是由于全基因组复制、片段复制或串联复制进行进化的, 在这些复制事件之后,基因发生了多样化[43]。割手密种是同源多倍体, 是由8个同源染色体组组成, 每个染色体组有4个成员。本研究通过共线性分析估计了割手密种基因组中基因复制事件, 如图5所示, 27个SsLRRII-RLK基因只分布在17条染色体上, 在2号同源染色体组上不包含任何SsLRRII-RLK基因, 而4A、4D、6A和6B四条染色体上的SsLRRII- RLK基因最多, 都有3~4个成员。共线性分析结果显示在割手密种SsLRRII-RLK基因家族中总共有35对共线性对, 包括24对等位基因共线性对和11对非等位基因共线性对, 其中一半以上的共线性对主要集中在4号和6号同源染色体组。分别都只有1个(3.70%) SsLRRIIRLK基因来源于分散复制、邻近复制或串联复制, 24个(88.89%) SsLRRII-RLK基因被鉴定来自于片段复制。由以上结果可知甘蔗割手密种LRRII-RLK基因主要是以基因复制的方式进行扩增, 且主要以片段复制的方式扩增。

图5 SsLRRII-RLK基因在染色体上的分布及共线性关系Fig. 5 Distribution and syntenic analysis ofSsLRRII-RLKgenes inSaccharum spontaneum内部连线表示甘蔗割手密种LRRII-RLK基因家族间的共线性。The internal line indicates the collinearity within SsLRRII-RLK genes.
为进一步研究甘蔗割手密种LRRII-RLK基因家族的进化机制, 本研究还构建了割手密种与高粱的比较共线性图。由图6可知, 在割手密种和高粱LRRII-RLK基因之间鉴定出17对共线性对, 本研究还发现高粱中一个基因对应多个甘蔗割手密种基因的现象。本研究通过计算甘蔗和高粱直系同源基因对非同义和同义位点的替换率比率(Ka/Ks)来了解甘蔗LRRII-RLK基因的选择压力(图7)。甘蔗与高粱的同源对之间所有的Ka/Ks均小于1, 表明甘蔗与高粱在分化的时候可能经历了严格的纯化选择作用[44]。根据成对的Ks值估计了SsLRRII-RLK与其同源基因SbLRRII-RLK之间的分化时间, 在所有甘蔗和高粱的LRRII-RLK直系同源基因对中, 有4对的分歧时间在8.037~21.633 Mya之间, 有10对的分歧时间在2.874~7.416 Mya之间, 短于甘蔗和高粱的分歧时间(7.779 Mya)[38](表3)。

图6 甘蔗与高粱物种间的共线性分析Fig. 6 Synteny analysis betweenSaccharum spontaneumandSorghum bicolorspecies灰线表示2个物种基因组间的共线性区块, 红线表示2个物种间LRRII-RLK的共线基因对。The grey lines in the background indicate the collinear blocks within two genomes. The red lines indicate the LRRII-RLK syntenic gene pairs.
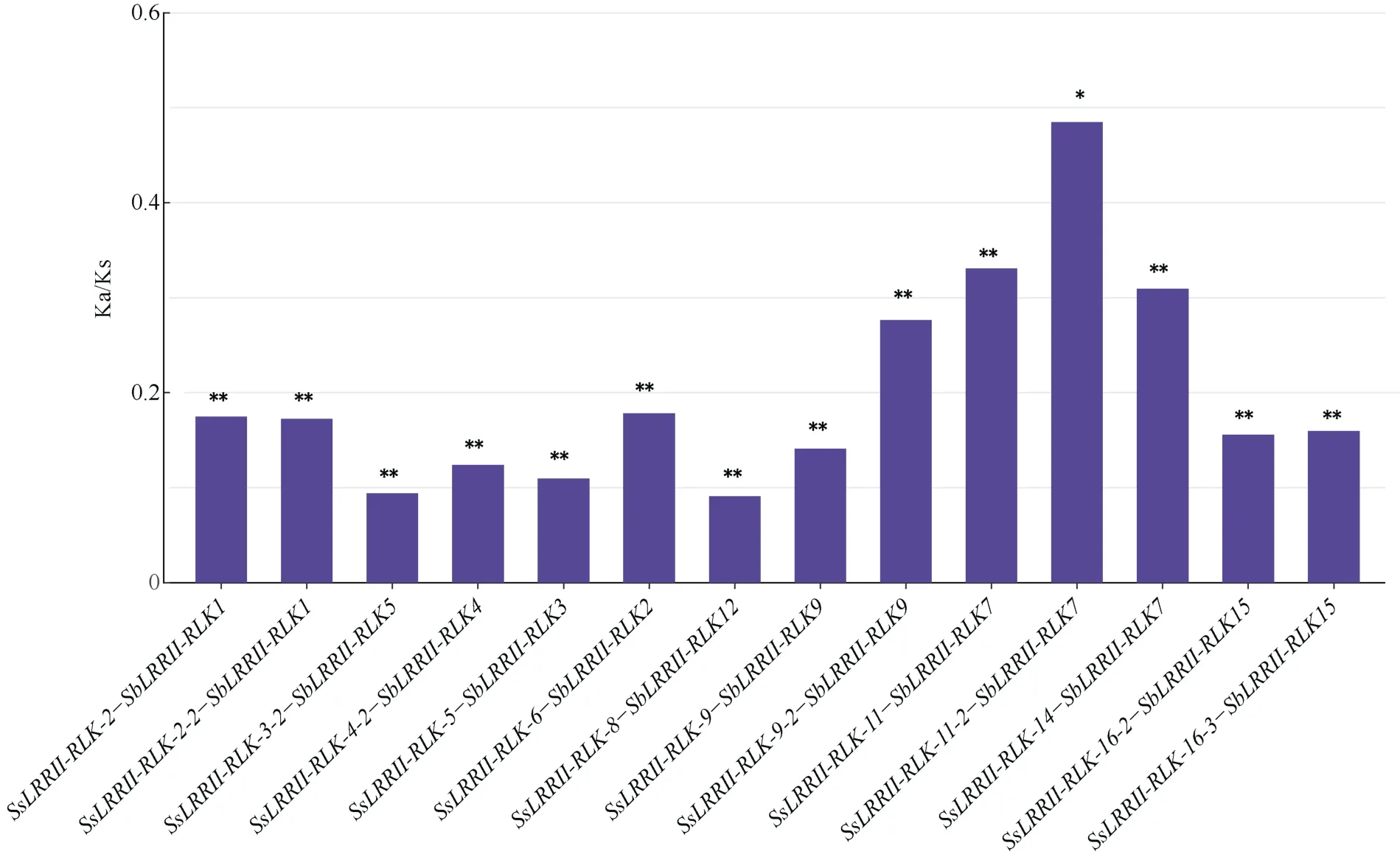
图7 甘蔗和高粱中同源LRRII-RLK基因对Ka/Ks值分析Fig. 7 Ka/Ks value distribution of all LRRII-RLK orthologous gene pairs betweenSaccharum spontaneumandSorghum bicolor*、**分别表示在0.05和0.01概率水平差异显著。* and ** mean significant difference at the 0.05 and 0.01 probability levels, respectively.

表3 甘蔗和高粱LRRII-RLK基因、Ks信息和基因分歧时间Table 3 Divergence time based on Ks estimation for the orthologous genes of LRRII-RLK fromSorghum bicolorandSaccharum spontaneum
2.6 SsLRRII-RLK基因的时空表达模式分析
为探究甘蔗LRRII-RLK基因在时间和空间的表达模式, 本研究使用甘蔗割手密种SES 208不同组织、叶片发育梯度和昼夜节律的转录组数据进行表达分析。由图8可知, 在甘蔗不同发育阶段(苗期、成熟前期、成熟期)的组织中, SsLRRII-RLK基因在茎和叶中表达模式主要分为3种, 第1种是在甘蔗的不同发育阶段, 15个SsLRRII-RLK基因在甘蔗茎和叶中都呈现显著低表达或者不表达的模式, 比较典型的有SsLRRII-RLK2、SsLRRII-RLK3、SsLRRIIRLK6、SsLRRII-RLK7等。第2种是在甘蔗的3个不同发育阶段, 5个SsLRRII-RLK基因在甘蔗的叶中表达高于茎, 尤其是SsLRRII-RLK4、SsLRRII-RLK4-2和SsLRRII-RLK14, 说明这些基因可能在叶组织中发挥的作用更甚于在茎中。第3种是在甘蔗的3个不同发育阶段, 7个SsLRRII-RLK基因在甘蔗的茎中表达高于叶, 比较典型的有SsLRRII-RLK1、SsLRRII-RLK3-2、SsLRRII-RLK9和SsLRRII-RLK9-3,表示这些基因更有可能在茎的生长发育中发挥作用。在不同发育梯度的叶片中, 大多数SsLRRIIRLK基因不表达, 表明这些基因在甘蔗叶片发育过程发挥非常有限的作用, 但是有8个SsLRRII-RLK基因在15个叶段中高表达, 例如SsLRRII-RLK3-2、SsLRRII-RLK4-2、SsLRRII-RLK9-3等, 说明这些基因在叶片发育中发挥着一定的作用。

图8 SsLRRII-RLK基因在甘蔗不同组织, 叶片发育梯度和昼夜节律中的表达Fig. 8 Relative expression profiles of SsLRRII-RLK genes in different tissues, leaf gradients, and day-night rhythms in sugarcaneSd: 苗期; PM: 成熟前期; M: 成熟期; SL: 苗期叶; SS: 苗期茎; LR: 卷叶; LF: 正叶; BZ: 基部区; TZ: 过渡区; MZ1: 成熟区1; MZ2:成熟区2。Sd: seedling stage; PM: pre-mature; M: mature; SL: seeding leaf; SS: seeding stem; LR: leaf roll; LF: leaf; BZ: basal zone; TZ: translational zone; MZ1: maturing zone 1; MZ2: maturing zone 2.
在昼夜不同时间段中, 仅仅有几个SsLRRIIRLK基因在昼夜不同时间段中表达, 例如SsLRRIIRLK1、SsLRRII-RLK4-2、SsLRRII-RLK9-3、SsLRRIIRLK11-2这几个基因在黑夜和白天的不同时间段差异表达, 其中SsLRRII-RLK14在每周期的凌晨06:00的表达量达到最高, 且在黑夜中的表达略高于白天,说明这个基因可能参与了甘蔗叶片的光合作用过程。为了验证RNA-seq数据的可靠性, 本研究选取了6个在甘蔗昼夜节律每间隔4 h的样品中FPKM值较高的SsLRRII-RLK基因进行qPCR分析(图9)。表明qPCR表达模式与RNA-Seq数据集一致。

图9 SsLRRII-RLK基因表达模式的qRT-PCR验证Fig. 9 Verification for the relative expression pattern of SsLRRII-RLKs genes by qRT-PCR
2.7 SsLRRII-RLK基因在病害胁迫中的表达分析
甘蔗梢腐病是一种由真菌病原体引起的破坏力最强的病害, 它会导致甘蔗的顶部腐烂, 进而使其顶部死亡[45-47]。由图10可知, 3个SsLRRII-RLK基因的表达与甘蔗梢腐病的感染有关, 其中SsLRRIIRLK4和它的等位基因SsLRRII-RLK4-2具有十分相似的表达模式, 其表达量从甘蔗健康叶片到发病轻微的叶片显著降低, 而后在发病严重的叶片中又重新升高, 而SsLRRII-RLK1则是随着梢腐病的病害逐渐严重而表达量逐渐下降。说明在甘蔗受到甘蔗梢腐病病原菌感染一定程度时, 它们积极参与到甘蔗对病害胁迫的应激反应和防御反应中。
甘蔗花叶病是影响甘蔗生产最普遍的、传染性极强的病毒性病害, 广泛存在于世界各地的甘蔗种植区[48]。甘蔗花叶病毒(Sugarcane mosaic virus,SCMV)属于正义单链RNA病毒, 通过破坏叶绿体进而阻止光合作用来降低产量[49-50]。由图10可知,甘蔗感染SCMV之后,SsLRRII-RLK4和它的等位基因SsLRRII-RLK4-2表达量增加,SsLRRII-RLK1、SsLRRII-RLK-11、SsLRRII-RLK-11-2和SsLRRIIRLK-12表达量减少, 说明这些SsLRR-RLK基因可能参与了SCMV感染甘蔗时的防御反应和涉及到甘蔗病毒性病害的调控过程。

图10 SsLRRII-RLK基因在不同病害(梢腐病和花叶病)侵染甘蔗中的表达热图Fig. 10 Heat map of LRRII-RLK genes in sugarcane infected with different diseases (pokkah boeng disease and sugarcane mosaic disease)P1: CK; P2: 轻微; P3: 严重; S1: CK; S2: 脱毒; S3: 侵染后。P1: CK; P2: inchoate; P3: advanced. S1: CK; S2: CK detoxify; S3:post-infection.
3 讨论
甘蔗现代栽培品种是由热带种和割手密种杂交后产生的, 割手密种为现代栽培甘蔗提供了抗逆、分蘖等优良性状。LRRII-RLK基因目前已经在多种植物中发现, 例如拟南芥[5]、大豆[51]、棉花[25]、萝卜[26]、番茄[27]、马铃薯[28]、黄瓜[29]等, 并且发现它们在植物中对多种生物胁迫反应起着关键作用[14],因此, LRRII-RLK基因可能在甘蔗育种中具有提高甘蔗抗逆性和产量的潜能。由于甘蔗复杂的遗传背景, LRRII-RLK基因尚未在甘蔗中有比较系统的研究, 甘蔗割手密种基因组的破译[18]为LRRII-RLK基因的鉴定、探索其在甘蔗生长发育和病毒防御机制的研究提供了机会。本研究在割手密种基因组中共鉴定出27个LRRII-RLK基因, 单倍型基因16个;它们同时都含有胞外LRR结构域、跨膜区和胞内丝氨酸/苏氨酸激酶结构域3种结构域, 符合LRRIIRLK基因家族的特点。并且初步分析了LRRII-RLK家族的系统发育关系、基因结构、共线性和在甘蔗不同时空以及在2种不同病害胁迫下的表达模式。根据拟南芥的分类标准将甘蔗割手密种、高粱和水稻分成NIK、SERK、LRRII-C 3个分支, 其中NIK分支中基因成员最多, NIK基因在植物中主要是参与病毒的防御, 例如拟南芥中NIK的3个旁系同源基因(AtNIK1、AtNIK2、AtNIK3)在病毒感染期间直接与双生病毒NSP相互作用, 从而参与病毒防御反应[15,52];其次是SERK分支, SERK基因与植物多种反应过程相关, 例如, 油菜素内酯信号传导、细胞死亡、光反应和病原体相关分子模式反应等[12]。有研究表明, 水稻通过介导防御信号转导来对抗真菌病原体感染[53],说明LRRII-RLK基因家族发挥着防御植物病害和调控植物生长发育的双重功能。根据物种系统发育树的结果, 甘蔗割手密种LRRII-RLK基因的数量在17种物种中居于第2, 远远超过禾本科的其他作物, 甘蔗LRRII-RLK基因的显著增多可能是受到两轮全基因组复制的影响, 包括异源多倍化, 然后是自多倍化[54], 或者2轮多倍化[18]。27个SsLRRII-RLK基因都有2个非常保守的基序——基序2和基序4, 且其他基序也都存在于一半以上的SsLRRII-RLK基因中。通过基因结构分析发现, 在NIK、SERK和LRRII-C 3个分支中, 它们成员的基因结构都是比较相似的,在SERK和LRRII-C分支中, 大多数LRRII-RLK基因都包含8~11个外显子和2~12个内含子, 在番茄基因组[55]中的LRRII-RLK家族中也发现了相同的趋势, 说明LRRII-RLK基因家族在进化过程中是比较保守的, 也表明我们对甘蔗割手密种基因组进行的分类是准确和可靠的。而在NIK分支中基因结构多样性较大, 且部分等位基因之间的遗传结构差异较大, 如SsLRRII-RLK2和SsLRRII-RLK11。
本研究中, 所有的SsLRRII-RLK基因主要包含光响应元件、植物激素响应元件、胁迫响应元件和生长代谢元件四大类, 其中光响应元件和植物激素响应元件占比最多, 且甘蔗LRRII-RLK基因的顺式元件数量和种类存在差异, 推测SsLRRII-RLK基因在复制的过程中又产生了新的功能。本研究还分析了LRRII-RLK基因家族扩增的方式, 基因的扩增和功能分化主要是由于基因复制产生的, 其中全基因组复制, 串联复制和片段复制在植物中最常见, 因为大多数植物在染色体重排后通过多倍体在其基因组中保留了大量重复的染色体块[56-58]。甘蔗割手密种基因组包含35对LRRII-RLK基因共线性对, 27个SsLRRII-RLK基因, 分别都只有一个基因来自串联复制, 分散复制或邻近复制, 有24个来自于片段复制, 说明LRRII-RLK基因家族在甘蔗割手密种中主要是以片段复制的方式进行扩增。结合高粱和甘蔗种间共线性的结果, 推测SsLRRII-RLK基因家族的扩增方式主要是由于片段复制以及割手密种的全基因组复制。
植物基因的表达模式常常与其功能高度相关[59]。根据表达谱结果, SsLRRII-RLK基因家族在甘蔗不同组织具有不同的表达模式, 表明SsLRRII-RLK基因直接或者间接参与植物的生长发育, 例如SsLRRII-RLK1和SsLRRII-RLK3-2在甘蔗茎组织表达上调, 这些基因可能主要发挥调控与茎发育相关生物过程的作用。一些基因在甘蔗叶片组织中上调,例如SERK分支的SsLRRII-RLK4和LRRII-C分支的SsLRRII-RLK14, 这些基因很有可能主要参与叶片生长的发育过程。根据先前的研究, 其他植物LRRII-RLK基因家族的成员NIK和SERK在植物生长过程中具有重要的功能, 例如拟南芥AtSERK3-5调控激素信号、参与油菜素内酯信号的调节、影响植物生长发育[60-61]; 而在叶片发育不同梯度中,SsLRRII-RLK基因同它的等位基因之间的表达模式都是相似的, 例如SsLRRII-RLK4和SsLRRII-RLK4-2,说明这些基因复制可能产生功能冗余, 在之前的研究中也有报道, 基因复制导致的某些基因家族表现为基因功能冗余或者分化[62-64]。有些基因的表达水平易受到昼夜节律的影响, 这使得植物可以预测周围环境的变化从而协调自身发育和新陈代谢过程以适应环境变化[65-68]。然而, SsLRRII-RLK基因大部分在昼夜节律不同的时间段表达水平很低, 甚至检测不到, 说明它们很可能不响应光合反应。只有少数几个基因, 例如SsLRRII-RLK1、SsLRRII-RLK4-2和SsLRRII-RLK14等在甘蔗成熟叶片的昼夜循环中表达量有所变化, 说明这些基因有可能调节光合反应。一些SsLRRII-RLK基因在2种病害胁迫下表达呈现上升或下降, 说如SsLRRII-RLK1、SsLRRIIRLK4和SsLRRII-RLK11, 说明它们在一定程度上响应病害的侵染。在水稻中也有报道OsSERK1-2会被病原体信号或者其他胁迫信号激活表达, 从而调节免疫信号通路[53,69], 在本氏烟草中, 证明NbSERK3A/NbSERK3B对晚疫病具有抗性[70], 因此推测SsLRRII-RLK基因是植物抵御真菌和病毒病原体防御机制的组成部分, 这些结果将有助于了解甘蔗的抗病机制。
4 结论
本研究在甘蔗割手密种全基因组水平上鉴定到了27个LRRII-RLK家族基因, 其中单倍型16个, 分布在17条染色体上, 分别属于NIK、SERK和LRRII-C这3个分支, 具有较高的保守性。共线性分析表明, 该家族在甘蔗割手密种中主要以片段复制的方式进行扩增, 与高粱分化的过程中经历了严格的纯化选择作用。转录组数据分析表明, SsLRRIIRLK基因表达具有时间和组织特异性, 同时也表明了它们参与了甘蔗光合反应和对病害的防御反应。本研究为LRRII-RLK基因家族成员在甘蔗生长发育、光合作用以及在病害胁迫中的功能研究提供初步的理论基础。
