谷子毛状根诱导方法的建立与优化
2023-05-11万夷曼肖圣慧白依超范佳音吴长艾
万夷曼 肖圣慧 白依超 范佳音 王 琰 吴长艾
山东农业大学生命科学学院, 山东泰安 271000
谷子(Setaria italicaL.)是重要的禾本科粮饲作物, 具有适应性广、营养丰富、节水性突出、生长周期短、基因组小、二倍体自花授粉和单穗结实多等特点, 已成为研究C4光合作用、非生物响应和生物能产生的模式作物[1], 也是未来确保全球粮食安全和营养健康的重要作物[2]。对谷子基因组学、农艺性状形成和遗传机制的研究具有重要价值[3-4]。
根癌农杆菌介导谷子遗传转化的最大困难是基因依赖性以及农杆菌对谷子的低敏感性[5-6]。干燥成熟的谷子种子作为外植体, 利用根癌农杆菌介导谷子遗传转化效率达19.2%[7]。一种谷子新品种xiaomi诱导胚性愈伤组织作为外植体, 利用根癌农杆菌介导的xiaomi遗传转化效率约达23.28%[3]。以冀谷11谷子幼穗为外植体, 抗性愈伤组织获得率为16.4%[8]。但根癌农杆菌介导的谷子遗传转化体系耗时较长, 需要4到5个月才可获得转基因幼苗, 且对谷子品种要求比较严格[9]。因此, 建立一种普遍适用且高效快捷的谷子遗传转化体系对谷子基因功能研究至关重要。
发根农杆菌携带的Ri质粒通过感染植物损伤部位, 可诱导产生大量生长迅速和毛状分支多的毛状根[10]。另外, 由于具有遗传稳定、激素自主性、分化程度高和次生代谢产物含量高等特点[11], 毛状根在农作物育种、医药合成、环境修复以及基因功能研究等方面具有广泛应用[12-15]。发根农杆菌介导的遗传转化, 已在多种植物中获得成功, 如玉米(Zea maysL.)[16]、大豆(Glycine maxL.)[17]、棉花(Gossypium hirsutumL.)[18]、菠菜(Spinacia oleraceaL.)[19]和向日葵(Helianthus annuusL.)[20]。而发根农杆菌介导的谷子发根诱导体系未见报道。
研究表明, 发根农杆菌介导植物产生毛状根的效率受乙酰丁香酮(acetosyringone, AS)、菌液浓度和共培养时间等多种因素影响。巴戟天(Morinda officinalisHow.)毛状根诱导时, 在侵染液中加入300 μmol L-1AS诱导毛状根的效率最高, 诱导率达到36.7%, 而加入AS的浓度低于100 μmol L-1时, 对诱导效率影响不大[21]。钩藤(Uncaria rhynchophylla(Miq.) Jacks)毛状根在加入100 μmol L-1AS时诱导率达54.76%; 加入200 μmol L-1AS的钩藤毛状根转化效率为0[22]。可见, 适量的乙酰丁香酮可以提高毛状根的诱导效率。杜梨(Pyrus betulifoliaBunge)毛状根诱导产生需要的菌液浓度OD600值为0.3~0.4[23];虎杖(Polygonum cuspidatum)毛状根诱导产生需要的菌液浓度OD600值为0.8[24]。因此, 毛状根诱导过程中选择适合的菌液浓度也是至关重要的。此外, 共培养时间过短, 发根农杆菌不易附着并进入植物细胞, 导致毛状根诱导效率低; 而共培养时间过长可导致外植体死亡, 从而导致毛状根诱导效率降低[25]。这些研究为发根农杆菌介导的谷子发根诱导体系的建立提供了很好的参考。
CBL (calcineurin B-like proteins)是植物中一类Ca2+感应蛋白[26], CBL及其互作蛋白CIPK (CBLinteracting protein kinase)构成CBL-CIPK信号系统,在植物应对干旱、盐渍、低温等逆境胁迫响应中起重要作用[27]。在谷子中,SiCBL1、SiCBL3和SiCBL7受高盐胁迫诱导表达[28]。NHX家族蛋白含有Na+/H+exchange (PF00999)蛋白结构域, 主要参与调控细胞内的离子重建和pH平衡, 在植物生长、发育和盐胁迫响应过程中发挥重要作用[29-30]。研究发现狗尾草(Setaria viridis) NHX介导Na+的吸收过程[31]。DVL编码一类小肽, 具有功能多效性。拟南芥(Arabidopsis thaliana)DVL1过表达株系株高变矮、叶片变圆、花簇生、花梗和果荚变短等[32]。苜蓿(Medicago sativaL.) DVL还介导根瘤形成[33]。谷子DVL、SiNHX和SiCBL的生物学功能研究较少。因此, 本研究通过比较谷子外植体、品种、乙酰丁香酮、菌液浓度和共培养时间对发根农杆菌K599介导的毛状根诱导效率及遗传转化效率的影响, 建立了一种高效的谷子毛状根遗传转化体系。并利用实验室已有载体, 通过蛋白亚细胞定位和基因功能鉴定证明了该技术体系在谷子基因功能鉴定中的可行性。
1 材料与方法
1.1 植物材料
谷子品种Ci846和豫谷1号(Yugu 1)种子来自中国农业科学院种质资源保存中心, 龙珠1号种子来自章丘创新源农作物种植专业合作社,xiaomi种子来自山西农业大学杂粮育种团队, 吨谷种子购于育种销售市场; 后期由实验室自行繁殖保存。
1.2 菌株
发根农杆菌K599菌种购于上海唯地生物技术有限公司, 后期由实验室自行保存。
1.3 谷子芽尖外植体培养
挑选100粒均匀饱满的谷子种子, 用砂纸除去麸皮。无菌条件下进行种子表面消毒: 先用10 mL 75%酒精消毒5 min, 10 mL 0.1%吐温水冲洗2次; 后依次用10 mL 2.6%次氯酸钠消毒3 min, 10 mL 0.1%吐温水冲洗3次, 10 mL无菌水冲洗5次; 然后将种子用无菌滤纸吸干, 用无菌牙签点于MS培养基,25℃±1℃黑暗培养3 d。取4~7 mm嫩黄色芽尖用于发根诱导。
1.4 谷子胚性愈伤组织培养
将消毒晾干的种子点于含4.0 mg L-12,4-D和1.0 mg L-16-BA的MS培养基上, 25℃±1℃黑暗培养30 d (期间每10 d更换1次新鲜培养基), 诱导胚性愈伤组织, 取淡黄色紧致的胚性愈伤组织用于发根诱导。
1.5 毛状根诱导条件的选择
1.5.1 外植体选择 各取谷子50个芽尖和50块愈伤组织外植体于20 mL无菌水悬浮的菌体中(OD600= 0.5) 15 min, 将外植体置于毛状根诱导基础培养基。
1.5.2 乙酰丁香酮对毛状根诱导产生的影响 40个龙珠1号芽尖外植体分别于20 mL 1/2 MS或含有50、100、150、200 μmol L-1乙酰丁香酮的1/2 MS液体培养基悬浮菌体(OD600= 0.5) 15 min。
外出学习使她产生“顿悟”,教学技巧、课堂管理和“教书育人”的教育信念也随之改变。比如,她的备课方法和教案写法有了改观,教学技巧、组织课堂的方法和教学效果都有很大提高。她对外语教育的意义有了新认识。这个阶段的职业发展特点是主动探索外语的教育功能,体现出积极性和主观能动性。教师信念构建体现为对教育信念的反思和探索。
1.5.3 菌液浓度对毛状根诱导的影响 40个龙珠1号芽尖外植体分别于OD600为0.1、0.2、0.3、0.5、0.8、1.0的含有100 μmol L-1AS的1/2 MS液体培养基中15 min。
1.5.4 暗培养时间对毛状根诱导的影响 200个龙珠1号芽尖外植体于20 mL含100 μmol L-1AS的1/2 MS液体培养基(OD600= 0.5)中15 min, 然后将芽尖外植体分为5组(每组40个芽尖外植体)置于毛状根诱导基础培养基, 分别暗培养1、2、3、4和5 d。
1.6 相关培养基配置及培养条件
谷子芽尖外植体诱导培养基: 4.42 g L-1MS+30 g L-1蔗糖+8 g L-1琼脂。谷子愈伤组织诱导培养基: 4.42 g L-1MS+30 g L-1蔗糖+4.0 mg L-12,4-D+1.0 mg L-16-BA+8 g L-1琼脂粉。毛状根诱导基础培养基: 4.42 g L-1MS+30 g L-1蔗糖+8 g L-1琼脂。毛状根诱导扩繁培养基: 4.42 g L-1MS+30 g L-1蔗糖+8 g L-1琼脂+300 mg L-1特美汀。探究乙酰丁香酮对毛状根诱导的培养基: 1/2 MS+15 g L-1蔗糖+0、50、100、150、200 μmol L-1乙酰丁香酮。以上培养基的pH均为5.8, 121℃高温高压灭菌20 min。
培养条件: 光照培养箱温度25 ±1 ,℃ ℃ 光周期为光照16 h/黑暗8 h, 光照强度为125 μmol m-2s-1,培养时间15 d。每个处理包括40个外植体, 统计30个外植体的数据, 包括毛状根的根长、毛状根诱导率和平均生根数, 3次重复试验。
1.7 谷子SiDVL1和SiDVL3表达载体构建及定位分析
设计SiDVL1(Seita.2G169800.1)和SiDVL3(Seita.3G159000.1)特异引物, 分别通过PCR技术扩增目的基因cDNA, 利用同源重组的方法将目的基因与载体pCAMBIA1305.1连接, 获得目的基因融合GFP的表达载体。将35S::SiDVL1-GFP和35S::SiDVL3-GFP表达载体转化EHA105感受态细胞和K599感受态细胞, 转化方法见上海唯地生物技术公司的感受态使用说明书。
烟草瞬时转化: 将35S::SiDVL1-GFP-EHA105和35S::SiDVL3-GFP-EHA105目标菌株活化, 用渗透液重悬菌体并调至OD600=1.0, 黑暗放置2~4 h,将含辅助质粒p19的农杆菌和目标质粒的农杆菌1∶1混匀, 用1 mL注射器(无针头)吸取混合菌液接种烟草叶片背面, 暗培养3 d, 使用激光共聚焦显微镜LSM880进行GFP荧光鉴定。
DVL定位分析: 将SiDVL1-GFP和SiDVL3-GFP瞬时转化的烟草叶片以及随机选取的20条K599介导的毛状根根尖, 用激光共聚焦显微镜LSM880进行GFP荧光鉴定, 判断基因在烟草和谷子毛状根的定位情况。
1.8 谷子SiNHX2、SiCBL4和SiCBL7表达载体构建及功能鉴定
设 计SiNHX2(Seita.2G160200.1)、SiCBL4(Si002829m)和SiCBL7(Si002269m)的基因特异引物,通过PCR技术扩增目的基因cDNA, 利用同源重组的方法将目的基因与载体pCAMBIA1305.1连接,获得目的基因的表达载体。将35S::SiNHX2、35S::SiCBL4、35S::SiCBL7表达载体以及空载体(pCAMBIA1305.1)转化K599感受态细胞, 转化方法见上海唯地生物技术公司的感受态使用说明书。
1.9 数据统计分析
利用以下公式进行数据统计, 采用GraphPad Prism 6.01软件作图, 利用LSD和Duncan’s方法对数据进行方差分析和多重比较。
毛状根诱导率(%) = 产生毛状根的外植体数/侵染的外植体总数×100%;
外植体的平均生根数(条) = 所有外植体产生的毛状根数/产生毛状根的外植体;
毛状根的转化效率(%) = PCR验证成功的转基因毛状根数或有GFP荧光的毛状根数/毛状根总数×100。
2 结果与分析
2.1 谷子外植体选择
根癌农杆菌介导谷子遗传转化时, 未成熟的花序、成熟的茎尖、未成熟胚胎或花序诱导的愈伤组织均可作为谷子外植体, 但是不同外植体的遗传转化效率存在很大差异[3]。本试验用谷子芽尖和胚性愈伤组织为外植体, 利用发根农杆菌诱导谷子毛状根。结果表明, 胚性愈伤组织作为外植体产生毛状根需要10 d, 且生长缓慢(图1-A), 芽尖外植体产生毛状根需要5 d, 生长较快(图1-B)。培养14 d时,谷子芽尖诱导的毛状根显著长于胚性愈伤组织诱导的毛状根(图1-C), 芽尖诱导毛状根的效率显著高于胚性愈伤组织诱导毛状根的效率(图1-D)。说明谷子芽尖比胚性愈伤组织更适合用作毛状根诱导外植体。

图1 不同外植体对诱导毛状根的影响Fig. 1 Effects of different types of explants on hairy roots inductionA和B分别为发根农杆菌K599侵染谷子胚性愈伤组织和芽尖外植体诱导10 d和5 d时毛状根发生情况; C: 培养14 d诱导产生毛状根的根长; D: 培养14 d诱导产生毛状根的诱导效率。3次生物学重复,n= 30。采用单因素方差分析, 不同字母表示差异显著(P< 0.05)。A and B: Foxtail millet’s hairy-root development afterA. rhizogenesstrain K599 infecting embryogenic callus for 10 days and bud tips for 5 days, respectively. C: the root length of induced hairy roots cultured for 14 days. D: the induction efficiency of hairy roots cultured for 14 days. Three biological experiments were repeated,n= 30. One-way ANOVA Duncan’s test is used for statistical analysis. Different letters indicate significant differences atP< 0.05.
2.2 不同品种的芽尖外植体对毛状根诱导的影响
谷子遗传转化具有基因依赖性以及农杆菌低敏感性等限制[5-6]。本试验对Ci846、xiaomi、龙珠1号、豫谷1号和吨谷5个品种的谷子芽尖外植体进行毛状根诱导, 发现5个供试品种的芽尖外植体均能诱导产生白色毛状根, 且形态相似(图2-A~E); 毛状根长度均在1.5~2.0 cm之间(图2-F); 毛状根诱导率均在70%左右(图2-G); 平均产生毛状根数目约4条(图2-H)。说明利用发根农杆菌诱导谷子毛状根可能不受品种限制, 易于推广应用, 可能是一种突破品种限制提高谷子遗传转化效率的方法。
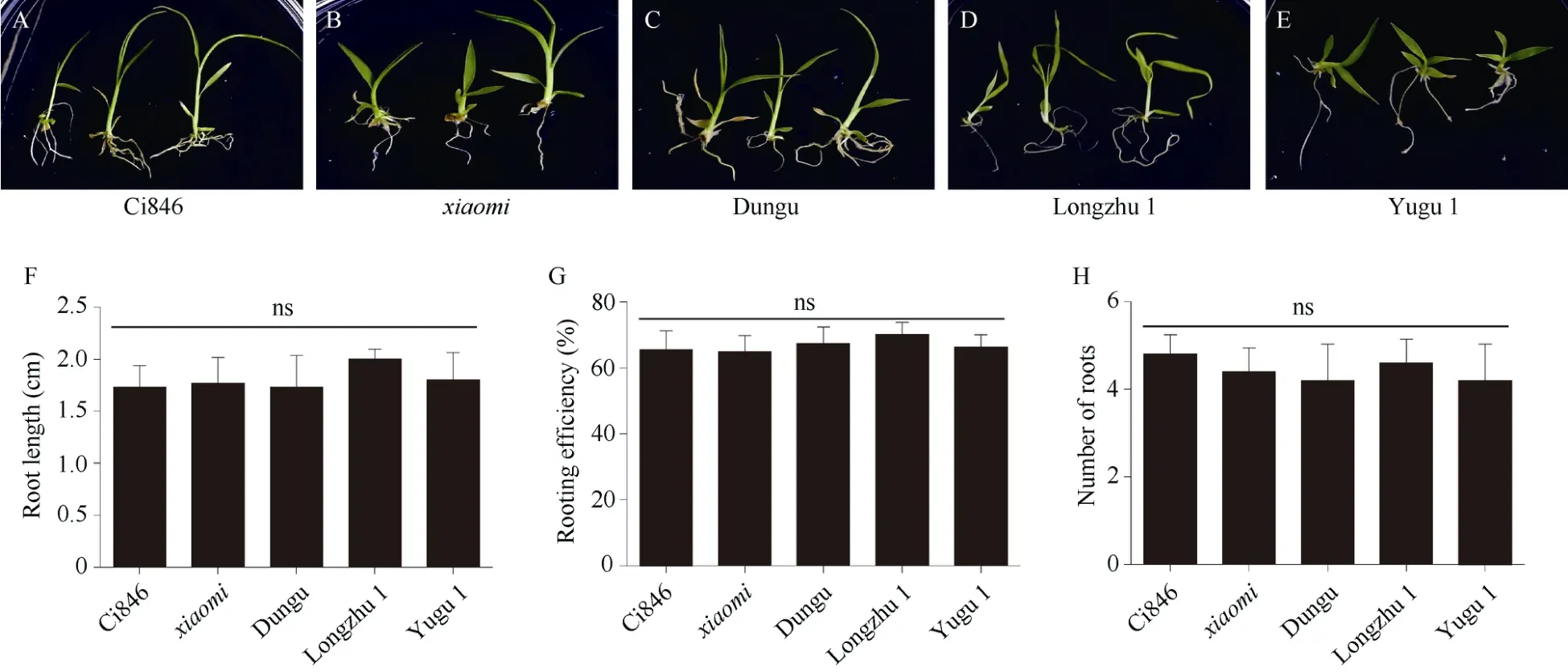
图2 不同谷子品种的芽尖外植体对毛状根诱导的影响Fig. 2 Effects of bud tip explants from different millet varieties on hairy roots inductionA~E: 分别为Ci846 (A)、xiaomi(B)、吨谷(C)、龙珠1号(D)和豫谷1号(E)芽尖外植体对毛状根诱导的影响; F: 不同品种来源的芽尖外植体诱导毛状根的根长; G: 不同品种来源的芽尖外植体诱导毛状根的诱导效率; H: 不同品种来源的芽尖外植体诱导毛状根的平均生根数。3次生物学重复,n= 30。采用单因素方差分析, ns表示在0.05概率水平无显著差异。A-E: the effects of Ci846,xiaomi, Dungu, Longzhu 1, and Yugu 1 on hairy roots induction, respectively. F: the root length of induced hairy roots using bud tips from indicated varieties as the explants. G: the induction efficiency of hairy roots when bud tips from indicated varieties were used as the explants. H: the average induced hairy root number when bud tips from indicated varieties were used as the explants. Three biological experiments were repeated,n= 30. One-way ANOVA Duncan’s test is used for statistical analysis; ns indicates no significant correlation at the 0.05 probability level.
2.3 乙酰丁香酮对谷子毛状根诱导的影响
乙酰丁香酮在农杆菌介导单子叶植物遗传转化体系中起到提高质粒遗传转化效率的作用[21-22]。本研究发现0、50、100、150和200 μmol L-1的AS处理龙珠1号芽尖能够诱导分支多、无向地性的白色毛状根(图3-A~E)。诱导培养15 d的毛状根根长分别为0.69、0.75、0.95、0.65和0.59 cm (图3-F); 毛状根诱导率分别为50.15%、59.93%、80.15%、71.65%和59.54% (图3-G), 平均生根数分别为1条、2条、3条、2条和2条(图3-H)。说明在侵染液和共培养基中加入AS有利于谷子毛状根诱导, 其中100 μmol L-1AS对谷子毛状根的诱导效果最好。
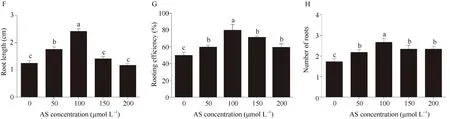
图3 乙酰丁香酮对谷子毛状根诱导的影响Fig. 3 Effects of AS on foxtail millet hairy roots inductionA~E: 分别为0、50、100、150和200 μmol L-1AS对诱导毛状根的影响; F: 0、50、100、150和200 μmol L-1AS诱导毛状根的根长; G:0、50、100、150和200 μmol L-1AS诱导毛状根的诱导效率; H: 0、50、100、150和200 μmol L-1AS诱导毛状根的平均生根数。3次生物学重复,n= 30。采用单因素方差分析, 不同字母表示差异显著(P< 0.05)。A-E: the effect of 0, 50, 100, 150, and 200 μmol L-1AS on hairy roots induction, respectively. F: the root length of induced hairy roots in the presence of 0, 50, 100, 150, and 200 μmol L-1AS. G: the induction efficiency of hairy roots in the presence of 0, 50, 100, 150, and 200 μmol L-1AS. H: the average induced root number in the presence of 0, 50, 100, 150, and 200 μmol L-1AS. Three biological experiments were repeated,n= 30. One-way ANOVA Duncan’s test is used for statistical analysis. Different letters indicate significant differences atP< 0.05.
2.4 菌液浓度对谷子毛状根诱导的影响
适宜的发根农杆菌菌液浓度是影响遗传转化的重要因素[34]。本研究分别用OD600= 0.1、0.2、0.3、0.5、0.8和1.0的菌液侵染龙珠1号芽尖。结果表明所有浓度的菌液均能诱导白色毛状根, 但存在差异(图4-A~F)。6个菌液浓度诱导毛状根根长分别为3.51、3.94、7.15、5.18、4.25和3.85 cm (图4-G); 毛状根诱导率分别为54.85%、55.56%、74.54%、76.25%、62.89%和60.75% (图4-H); 平均生根数分别为2条、2条、3条、4条、2条和2条(图4-I)。说明OD600为0.3的菌液诱导的毛状根根长最长, OD600为0.5的菌液诱导的毛状根效率和平均生根数最高。后续试验用OD600为0.5的菌液浓度进行侵染。
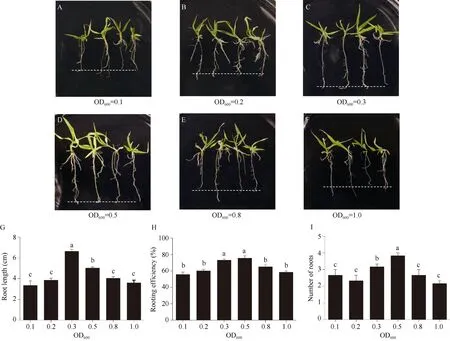
图4 菌液浓度对谷子毛状根诱导的影响Fig. 4 Effect of bacterium concentration on foxtail millet hairy roots inductionA~F: OD600分别为0.1、0.2、0.3、0.5、0.8和1.0对诱导毛状根的影响; G: 不同菌液浓度诱导产生毛状根的根长; H: 不同菌液浓度诱导产生毛状根的诱导效率; I: 不同菌液浓度诱导产生毛状根的平均生根数。3次生物学重复,n= 30。采用单因素方差分析, 不同字母表示差异显著(P< 0.05)。A-F: the effect of bacteria solution at concentrations 0.1, 0.2, 0.3, 0.5, 0.8, and 1.0 OD600on hairy roots induction, respectively. G: the root length of induced hairy roots by bacteria at concentrations mentioned in (A-F), respectively. H: the induction efficiency of hairy roots by bacteria solution at concentrations mentioned in (A-F), respectively. I: the average induced rooting number by bacteria solution at concentrations mentioned in (A-F), respectively. Three biological experiments were repeated,n= 30. One-way ANOVA Duncan’s test is used for statistical analysis. Different letters indicate significant differences atP< 0.05.
2.5 共培养时间对谷子毛状根诱导的影响
外源基因转移至植物受体细胞的过程, 主要是由外植体与发根农杆菌的共培养时间决定[25]。为探究谷子发根诱导的最佳共培养时间, 本研究比较了1、2、3、4和5 d共培养时间对龙珠1号毛状根诱导的影响。结果表明5种共培养时间均能诱导谷子毛状根产生, 但存在明显差异(图5-A~E)。与其他共培养时间相比, 共培养3 d时诱导产生的毛状根最长(3.58 cm) (图5-F), 毛状根诱导率最高(65.35%)(图5-G), 平均生根数最多(3条) (图5-H)。说明K599侵染后共培养3 d对谷子毛状根诱导效果最好。

图5 共培养时间对谷子毛状根诱导的影响Fig. 5 Effect of co-culture time on foxtail millet hairy roots inductionA~E: 分别为共培养1、2、3、4和5 d对诱导毛状根的影响; F: 共培养1、2、3、4和5 d诱导毛状根的根长; G: 共培养1、2、3、4和5 d诱导毛状根的效率; H: 共培养1、2、3、4和5 d诱导毛状根的平均生根数。3次生物学重复,n= 30。采用单因素方差分析, 不同字母表示差异显著(P< 0.05)。A-E: the effects of co-culture time of 1, 2, 3, 4, and 5 day(s) on hairy roots induction, respectively. F: the root length of induced hairy roots after co-culture for 1, 2, 3, 4, and 5 day(s). G: the induction efficiency of hairy roots after co-culture for 1, 2, 3, 4, and 5 day(s). H: the average hairy root number after co-culture for 1, 2, 3, 4, and 5 day(s). Three biological experiments were repeated,n= 30. One-way ANOVA Duncan’s test is used for statistical analysis. Different letters indicate significant differences atP< 0.05.
2.6 优化条件下谷子毛状根诱导效率验证
为验证优化条件下谷子毛状根的诱导效率, 本研究用含有100 μmol L-1AS、OD600为0.5的菌液侵染龙珠1号芽尖15 min, 在含有100 μmol L-1AS的MS固体培养基上黑暗培养3 d, 转移至含有300 mg L-1特美汀的MS固体培养基上诱导培养7 d。试验重复12次, 共侵染253个芽尖。结果表明平均每个芽尖诱导毛状根数目为3条, 毛状根诱导效率达到80.24% (表1), 高于单独最佳AS浓度、共培养时间和菌液浓度对毛状根的诱导效率, 接近于棉花子叶诱导产生毛状根的诱导率(82%)[18]。

表1 芽尖外植体诱导毛状根的数据统计Table 1 Data statistics of hairy root by shoot tip explants induction
2.7 谷子毛状根在基因功能验证研究中的应用
为利用谷子毛状根体系进行科学研究, 本研究构建了SiDVL-GFP谷子表达载体, 转化发根农杆菌K599, 侵染龙珠1号芽尖并诱导毛状根。随机选取388条毛状根, 提取毛状根基因组DNA进行GFP基因的PCR检测。以无菌苗正常根作为阴性对照, 空载体质粒为阳性对照。其中277条毛状根检测出目的大小的条带(部分结果见图6)。进一步计算发根农杆菌K599介导谷子芽尖外植体产生毛状根的遗传转化效率达到71%。

图6 部分转基因发根的PCR验证结果Fig. 6 Verification of transgenic hairy root by PCRM: DNA marker; 1: 基因表达载体质粒(阳性对照); 2~33: 基因表达载体转化毛状根的DNA; WT: 空载体转化毛状根DNA。M: DNA marker. 1: the gene expression vector was used as the positive control. 2-33: DNA from induced hairy root samples. WT: the empty vector from induced hairy root samples was used as the negative control.
同时, 本研究随机选取20条SiDVL1-GFP和SiDVL3-GFP转化的毛状根根尖, 用激光共聚焦显微镜LSM880进行GFP荧光鉴定。结果表明带有GFP荧光信号的毛状根有15条(部分数据见图7),进一步计算发根农杆菌K599介导谷子芽尖外植体产生毛状根的遗传转化效率达到75%, 与PCR检测结果基本一致。SiDVL1-GFP和SiDVL3-GFP在谷子发根中的亚细胞定位与其在烟草叶片中的定位一致(图7)。说明该系统可用于谷子蛋白的亚细胞定位分析。

图7 发根农杆菌介导的谷子DVL基因定位分析Fig. 7 Subcellular localization ofSiDVLgenes usingA. rhizogenes-mediated hairy root transformation
为利用该系统进行基因功能鉴定, 本研究将构建的SiNHX2、SiCBL4和SiCBL7的谷子表达载体利用发根农杆菌转化谷子芽尖, 获得谷子转基因植株,进行耐盐性分析。结果表明,SiNHX2、SiCBL4和SiCBL7转基因谷子幼苗在正常条件下的生长与空载体质粒转化谷子幼苗(对照)无明显差异; 而在175 mmol L-1NaCl条件下,SiNHX2、SiCBL4和SiCBL7转基因谷子幼苗的存活率显著高于对照(图8), 说明SiNHX2、SiCBL4和SiCBL7提高谷子的耐盐性, 同时证明该体系可用于谷子基因功能鉴定。
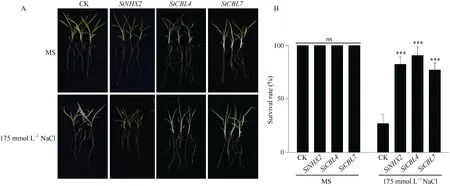
图8 SiNHX2、SiCBL4和SiCBL7转基因谷子幼苗对盐胁迫的响应Fig. 8 Responses of foxtail millet withSiNHX2,SiCBL4, andSiCBL7transformed hairy-roots to salt stressA:SiNHX2、SiCBL4和SiCBL7转发根谷子幼苗在含有175 mmol L-1NaCl的MS培养基(MS培养基为对照)上生长7 d的表型; B:SiNHX2、SiCBL4和SiCBL7转基因谷子幼苗在含有175 mmol L-1NaCl的MS培养基(MS培养基为对照)上生长7 d的存活率统计。3次生物学重复,n= 30。ns表示在0.05概率水平无显著差异, ***表示在0.01概率水平显著相关。A: the phenotypes of millet seedlings withSiNHX2,SiCBL4, andSiCBL7transformed hairy-roots when treated on MS medium with or without 175 mmol L-1NaCl for 7 days. B: the survival rates of millet seedlings withSiNHX2,SiCBL4, andSiCBL7transformed hairy-roots when treated on MS medium with or without 175 mmol L-1NaCl for 7 days. Three biological experiments were repeated,n= 30. ns indicates no significant correlation in the 0.05 probability level; *** indicates significant correlation at the 0.01 probability level.
3 讨论
3.1 不同外植体影响谷子毛状根诱导效率
在根癌农杆菌介导谷子遗传转化时, 未成熟的花序、成熟的茎尖、未成熟胚胎或花序诱导的愈伤组织均可作为谷子外植体, 但是这些外植体获取的时间较长, 不同外植体遗传转化效率存在很大差异[3]。发根农杆菌介导植物毛状根遗传转化效率较高, 如以虎杖叶片为外植体诱导产生毛状根的转化效率达到92%[24]; 以棉花子叶为外植体诱导产生毛状根的诱导率达到82%[18]。本研究发现谷子胚性愈伤组织作为外植体时产生毛状根需要10 d, 而且毛状根生长缓慢; 而以谷子芽尖作为外植体时产生毛状根需要5 d, 且毛状根生长较快(图1)。说明不同外植体对谷子毛状根诱导效果具有较大影响。
3.2 菌液浓度、乙酰丁香酮和共培养时间影响谷子毛状根诱导效率
研究表明菌液浓度、乙酰丁香酮和共培养时间对毛状根的诱导也有很大影响。杜梨和虎杖毛状根诱导产生需要的菌液浓度OD600分别为0.3~0.4[23]和0.8[24]。巴戟天[21]和钩藤[22]毛状根诱导适宜的乙酰丁香酮浓度分别为300 μmol L-1和100 μmol L-1。外源基因转移至植物受体细胞的过程, 主要是由外植体与发根农杆菌的共培养时间决定, 而共培养时间过短, 发根农杆菌不易附着并进入植物细胞, 发挥作用的Ri质粒减少, 导致毛状根诱导效率低; 而共培养时间过长可导致外植体死亡, 从而导致毛状根诱导效率降低[23]。本实验发现发根农杆菌K599菌液在OD600为0.5时对谷子毛状根的诱导效率较高(图4)。侵染液中加入适量的乙酰丁香酮共培养3 d时有助于谷子芽尖诱导谷子毛状根(图3和图5)。因此, 合适的菌液浓度、乙酰丁香酮和共培养时间对谷子芽尖诱导毛状根具有显著的促进作用。
3.3 谷子毛状根体系具有重要的应用价值
发根农杆菌介导植物产生的毛状根在农作物育种、医药合成、环境修复以及基因功能研究等方面具有广泛应用[12-15]。本研究利用谷子毛状根体系进行的蛋白亚细胞定位分析(图7)和基因功能鉴定(图8), 说明发根农杆菌K599介导的谷子芽尖毛状根是一种谷子蛋白亚细胞定位分析和基因功能鉴定的快速有效的方法。此外, 谷子遗传转化具有基因型依赖性[5-6], 且根癌农杆菌介导谷子遗传转化的效率较低, Y4品种为4.72%[35], 而xiaomi品种约为23.28%[3]。本研究发现谷子品种对毛状根诱导效率无影响, 诱导效率较高, 均能达到70% (图2), 说明谷子毛状根可能是一种突破品种限制提高谷子遗传转化效率的方法。
4 结论
利用OD600为0.5的K599介导谷子芽尖外植体,在加入100 μmol L-1AS的培养基中共培养3 d, 谷子毛状根的遗传转化效率达70%, 同时该体系可进行基因定位和功能分析, 因此本研究建立了一种突破品种限制高效快速鉴定谷子基因功能的方法。
