黄精总皂苷的提取和含量测定方法研究*
2023-03-20戴万生毕露露
戴万生,毕露露,邱 斌,贺 森,顾 雯
(云南中医药大学,云南 昆明 650500)
2020版《中国药典》收载黄精的来源为百合科植物滇黄精PolygonatumkingianumColl.et Hemsl.、黄精PolygonatumsibiricumRed.或多花黄精PolygonatumcyrtonemaHua.的干燥根茎。主要含有多糖、甾体皂苷、三萜、生物碱、木脂素、黄酮、植物甾醇及挥发油等活性成分[1]。关于黄精及其炮制品的质量评价,主要以糖类和皂甙类成分为指标,《中国药典》(2020版)以多糖为质量评价指标。总皂苷的测定以香草醛-高氯酸比色法较为常用[2-4],黄精总皂苷和皂苷元的含量测定亦有一些文献报道[5-8],但方法不统一,结果和结论存在较大差异。本文以滇黄精及其炮制品为原料,对黄精总皂苷测定方法进行研究,确立以总皂苷含量为指标的黄精质量评价方法,为黄精炮制工艺和质量标准的制定提供科学依据。
1 仪器和材料
BioMate 3S紫外可见分光光度计(美国),AR224CN电子天平(奥豪斯仪器(常州)有限公司),SK7210型超声波清洗器(上海科导超声仪器有限公司),DK-98-ⅡA恒温水浴锅(天津市泰斯特仪器有限公司),薯预皂苷元对照品(上海源叶生物科技有限公司),香兰素(天津市光复精细化工研究所),其余试剂均为分析纯。
黄精(采自云南禄丰,经邱斌教授鉴定为滇黄精PolygonatumkingianumColl.Et Hemsl.的根茎。)
2 实验方法与结果
2.1 样品的炮制
2.1.1 生黄精 取鲜黄精,去除杂质,洗净,置沸水中煮15 min,取出,放凉,切3~4 mm厚片,60 ℃干燥,得生黄精片,粉碎,过60目筛,备用。
2.1.2 蒸黄精 取鲜黄精,去除杂质,洗净,置蒸制容器内蒸,从已至子,取出,切3~4 mm厚片,60 ℃干燥,得蒸黄精,粉碎,过60目筛,备用。
2.1.3 酒黄精 取生黄精片,适宜的容器内,加20%黄酒及适量(100%)水拌匀,浸润过夜,置蒸制容器内蒸12 h,闷润12 h,取出,60 ℃干燥,得酒黄精,粉碎,过60目筛,备用。每100kg黄精,用黄酒20 kg。
2.1.4 炙黄精 取生黄精片,置适宜的容器内,加入黑豆汁、蜂蜜、白酒及适量水(85%)拌匀,浸润过夜,置蒸制容器内蒸12 h,闷润12 h,取出,60 ℃干燥,得炙黄精,粉碎,过60目筛,备用。每100kg黄精,用黑豆10 kg,蜂蜜5 kg,白酒5kg。。
2.1.5 九蒸九晒黄精 取鲜黄精,去除杂质,洗净,置蒸制容器内蒸4 h,取出,60 ℃干燥4h,如此反复九次,切3~4 mm厚片,取出,60 ℃干燥,得九蒸九晒黄精,粉碎,过60目筛,备用。
2.2 不同提取方法比较
2.2.1 正丁醇超声提取法 取生、熟黄精粗粉(过60目筛)约1 g,精密称定,置烧瓶中,加入15倍量水饱和正丁醇,浸泡30 min,60℃超声提取50 min,提取2次,合并滤液,减压浓缩回收溶剂至干,得黄精总皂苷粗提物。
2.2.2 乙醇超声提取法 取样品3份,以80%乙醇做提取溶液,按2.2.1方法操作,得黄精总皂苷粗提物后,一份留用;一份用正丁醇萃取纯化,加水20 mL使其溶解,移入分液漏斗,加水饱和的正丁醇提取3次,每次15 mL,合并正丁醇液,减压浓缩,回收正丁醇得纯化黄精总皂苷粗提物;一份用硫酸水解纯化,将其置圆底烧瓶内,加2%稀硫酸50 mL、石油醚(60~90 ℃)50 mL,于水浴上回流(80 ℃)4 h水解,倾出、冷却、分层,取上层(石油醚溶液),回收石油醚至得水解后黄精总皂苷粗提物。
上述不同方法提取得到的粗提物,分别加甲醇适量溶解,转移至25 mL量瓶中定容,摇匀,按照2.3.3项下操作测定总皂苷含量,结果见表1。

表1 黄精不同提取方法总皂苷(%)测定结果(n=3)
实验结果表明,不同方法提取对总皂苷的测定影响较大,正丁醇超声提取法简便和快捷,所以宜选用水饱和正丁醇超声提取法。
2.3 总皂苷含量测定
2.3.1 对照品溶液的制备 精密称取薯蓣皂苷元对照品2.50 mg,置 l0 mL容量瓶中,加甲醇至刻度,摇匀,即得每1 mL含0.25 mg薯蓣皂苷元的对照品溶液,(4℃冷藏)备用。
2.3.2 测定波长的选择 精密吸取对照品溶液0.2 mL,按照2.3.3项下操作,用紫外-可见分光光度计在400~700 nm范围内扫描,见图1,结果显示对照液在550 nm左右处有特征吸收波长,故将检测波长定为550 nm。

图1 薯蓣皂苷元对照品紫外扫描光谱图
2.3.3 标准曲线制备 精密吸取上述对照品溶液0.10,0.20,0.30,0.40,0.50,0.60 mL于10 mL具塞试管中,水浴挥尽溶剂,分别加入新配制的5 %香荚兰醛冰醋酸溶0.20 mL,高氯酸1.0 mL,在70℃水浴中加热15 min,冰水冷却5 min,加5 mL冰醋酸,摇匀,放置15 min后,以试剂空白为对照,在波长550处测定其吸光值。以吸光度(A)为纵坐标,薯蓣皂苷元质量(mg)为横坐标回归处理,得回归方程:Y=0.0232X-0.0015(R2=0.9985),结果表明薯蓣皂苷元在4.03~24.18 μg/mL范围内浓度与A呈良好的线性关系。
2.3.4 温度对吸光度的影响 分别精密吸取对照品、蒸黄精供试品溶液0.2 mL,按照2.3.3项下操作,测定吸光值。结果见图2,其他因素相同的条件下,吸光度随温度的升高而增大,温度越高对吸光度的影响越大,但温度过高试验的重复性差,温度过低(<60 ℃)反应不完全,故本法选用70 ℃。

图2 温度对吸光度的影响
2.3.5 加热时间对吸光值的影响 分别精密吸取对照品、蒸黄精供试品溶液0.2 mL,在加热温度为70 ℃条件下,按照2.3.3项下操作测定不同加热时间下供试品溶液的吸光值,结果见图3,在其他因素一定的条件下,吸光度随加热时间的增加而增大,但时间过长试验的重复性差,故本法选用15 min。

图3 加热时间对吸光值的影响
2.3.6 精密度试验 精密吸取对照品溶液0.2 mL各5份,按照2.3.3项下操作测吸光度,结果见表2,RSD为1.27%,表明仪器精密度良好。

表2 精密度测定结果
2.3.7 稳定性试验 精密吸取对照品溶液各0.2 mL,按照2.3.3项下操作测定测定不同时间(5~50 min)的吸光度A,结果见表3,图4,表明样品吸光度随时间延长显下降趋势,显色后15 min相对稳定。
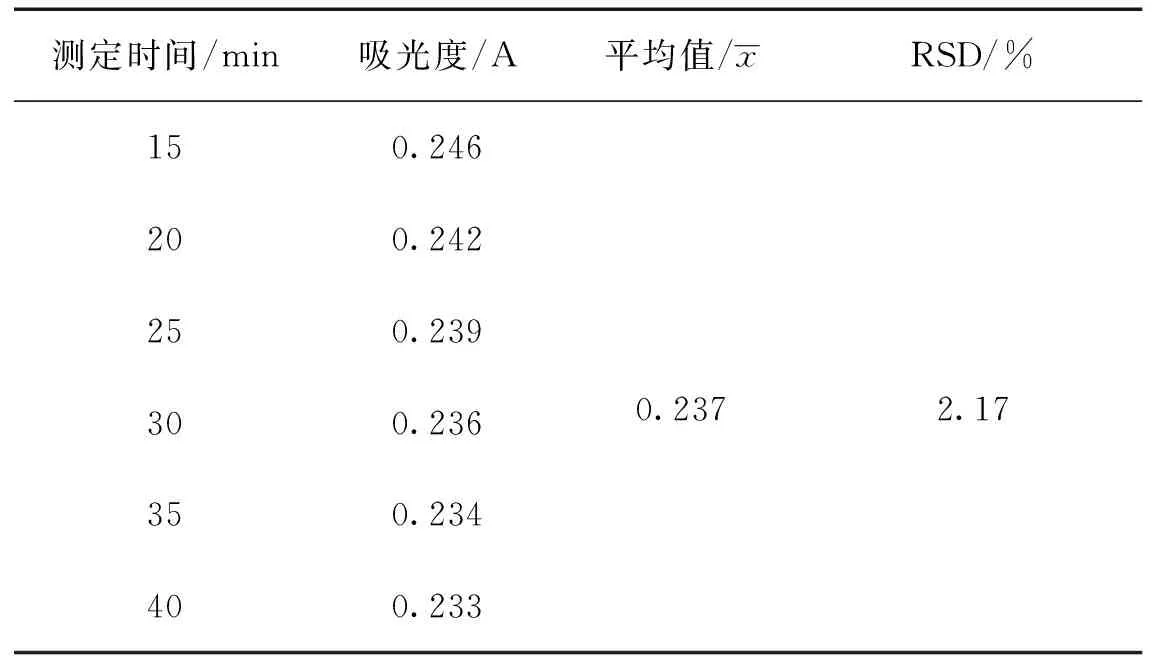
表3 稳定性测定结果

图4 稳定性测定结果
2.3.8 重现性试验 取同一批制黄精粉末5份,按照2.3.3项下操作测定总皂苷的含量,结果见表4,RSD为1.68%,表明方法重现性良好。

表4 重现性测定结果(n=5)
2.3.9 加样回收率试验 精密吸取已知总皂苷含量的供试品溶6份,分别精确加入薯蓣皂苷元对照品溶液,按照2.3.3项下操作测定总皂苷含量,计算结果见表5,平均回收率为100.02%,RSD为2.20%。

表5 黄精中总皂苷加样回收率(n=6)
2.4 样品测定 吸取一定量不同供试液,挥干溶剂,加入0.2 mL5%香草醛一冰醋酸溶液(新鲜配置),冰浴时加入1 mL高氯酸,摇匀,70℃水浴加热15 min后,冰浴5 min,加入5 mL冰醋酸,摇匀,静置15 min,于550nm波长处测定吸光度,计算总皂苷含量(%),结果见表6。

表6 样品测定结果(n=3)
3 讨论
不同方法制备供试品溶液(生品 炮制品)的比较结果表明,制备方法不同,所测出的黄精总皂苷含量有显著差异,采用乙醇超声提取后(1)甲醇直接溶解法,因含杂质较多,其总皂苷含量测定结果远高于乙醇超声提取后正丁醇萃取所得浸膏率,不符合总皂苷实际含量;(2)水解纯化法由于硫酸的作用,部分总皂苷可能被破坏,含量偏低;(3)正丁醇萃取法使样液得到了纯化而不破坏皂苷,是较好的方法;水饱和正丁醇超声提取法在有利于除去杂质的同时更利于皂苷类成分的溶出,是测定黄精总皂苷含量时理想的提取方法。
水浴加热温度及时间对吸光值均有显著的影响,且影响能力为:温度>时间。故操作过程中需严格控制水浴加热温度及时间。加热温度过高、时间过长使得试验重复性差,可能跟某些成分发生其他一些复杂的化学反应有关。
样品含量测定结果表明,黄精经过炮制后总皂苷含量增加,九蒸九晒黄精>炙黄精>酒黄精>蒸黄精>生黄精。制黄精水饱和正丁醇超声提取液随着蒸制时间的增加其颜色加深,其颜色深浅对吸光度是否有影响有待进一步的研究。
