枯草芽孢杆菌HG-02聚谷氨酸发酵条件优化
2023-02-23虎恩熊贾勇正钱栋全李伟建孙芳芳
虎恩熊,贾勇正,钱栋全,李伟建,孙芳芳
(云南润杰农业科技股份有限公司,云南 昆明 650000)
γ-聚谷氨酸(γ-PGA)是由D-/L-谷氨酸单体通过γ-酰胺键连接而成的一种直链纤维状生物大分子[1],是一种具有生物可降解性、保湿性、高吸水性、成纤维性、生物相容性、可食用性和超强的吸附性等特性的不具毒性的新型天然高分子[2],被广泛运用于食品、医药、环保、化妆品和农业等多个领域。目前γ-聚谷氨酸的生产制备主要采用微生物发酵法,在γ-聚谷氨酸发酵生产中,细菌中芽孢杆菌属类是应用最多的,其中以枯草芽孢杆菌、地衣芽孢杆菌为典型代表[3]。微生物发酵法生产γ-聚谷氨酸,发酵工艺和生产菌株是主要的影响因素,本文通过对实验室现有产γ-聚谷氨酸菌株的筛选和发酵条件优化,以期实现γ-聚谷氨酸高产量和高效率生产。
1 材料与方法
1.1 材料与仪器
化学试剂:蔗糖、葡萄糖、牛肉膏、蛋白胨、柠檬酸、甘油、酵母浸粉、谷氨酸钠、硫酸镁、氯化钠、氯化钙、磷酸氢二钾、硫酸锰、消泡剂、95%乙醇(除消泡剂外,其余化学试剂均为分析纯)。仪器:恒温摇床,无菌操作台,灭菌锅,恒温培养箱,电子天平,50 L 发酵罐,紫外分光光度计。
1.2 培养基与培养条件
1.2.1 培养基
平板培养基:蛋白胨0.8%,牛肉膏0.3%,氯化钠0.5%,葡萄糖0.25%,琼脂1.6%,自然pH;灭菌条件:121 ℃,20 min。
种子培养基:葡萄糖1%,蛋白胨1%,谷氨酸钠2%,硫酸镁0.1%,氯化钠0.5%,磷酸氢二钾0.05%,pH7.0;灭菌条件:121 ℃,20 min。
初始发酵培养基:蔗糖3.5%,蛋白胨2%,谷氨酸钠4%,硫酸镁0.1%,氯化钠0.5%,氯化钙0.01%,磷酸氢二钾0.05%,硫酸锰0.02%,消泡剂1%,pH7.0;灭菌条件:121 ℃,20 min。
1.2.2 培养方法
平板活化培养:在无菌条件下,挑取一环保存于 -4 ℃ 冰箱的枯草芽孢杆菌株种接种于平板培养基中,37 ℃ 恒温培养12~14 h,作为一次活化菌种。将一次活化菌种接种于新鲜平板培养基中,37 ℃ 下静置培养12~14 h,作为二次活化菌种。
种子培养:在无菌条件下,挑取平板培养好的二次活化菌种接种于摇瓶种子培养基上,置于摇床上 200 r/min,37 ℃ 恒温培养约12~14 h,待OD600大于8时取出为种子液备用。
发酵培养:以3%的接种量将种子培养液接种到 250 mL 三角瓶中,按照发酵液初始pH7.0,发酵转速 200 r/min,发酵温度 37 ℃,装液量60%即 150 mL 进行恒温培养 72 h。
1.3 高产γ-聚谷氨酸菌株筛选
挑选实验室现有的8株产γ-聚谷氨酸菌株,分别接种于平板培养基活化后,在无菌条件下接种至种子摇瓶上,待OD600值大于8时接种至发酵摇瓶上进行发酵培养,37 ℃ 恒温培养 72 h 后测定γ-聚谷氨酸产量,对比得到聚谷氨酸产量最高的菌株HG-02,其最终产量为 21.3 g/L。菌株HG-02经 16 s rDNA鉴定为枯草芽孢杆菌,为谷氨酸依赖性菌株。
聚谷氨酸质量浓度采用酒精法测量:取 10 mL 发酵液,10000 r/min 离心 30 min,去除菌体。加入3倍体积的95%乙醇,充分搅拌待聚谷氨酸析出后,加入蒸馏水进行重溶,再加入3倍体积的95%乙醇析出聚谷氨酸,反复溶3次后,将聚谷氨酸置于 50 ℃ 烘干至恒重,得到聚谷氨酸质量浓度。
1.4 单因素试验优化初始发酵培养基
1.4.1 氮源种类与质量浓度筛选
以初始发酵培养基为基础,分别设置不同的氮源:牛肉膏、蛋白胨、酵母浸粉,其它条件相同,通过发酵培养测定聚谷氨酸质量浓度获得最佳氮源。再设置最佳氮源的添加量分别为 30 g/L,35 g/L,40 g/L,45 g/L,50 g/L。每个试验组设置3个平行,37 ℃ 恒温培养 72 h 后,测定发酵液中聚谷氨酸质量浓度。
1.4.2 碳源种类与质量浓度筛选
以初始发酵培养基为基础,分别设置不同的碳源:蔗糖、葡萄糖、柠檬酸,其它条件相同,通过发酵培养测定聚谷氨酸质量浓度获得最佳碳源。再设置最佳碳源的质量浓度分别为 20 g/L,25 g/L,30 g/L,40 g/L,45 g/L。每个试验组设置3个平行,37 ℃ 恒温培养 72 h 后,测定发酵液中聚谷氨酸质量浓度。
1.4.3 谷氨酸钠添加量筛选
对于谷氨酸依赖型菌株,发酵培养基中必须有谷氨酸存在才能合成聚谷氨酸,如果培养基中没有谷氨酸,则不能合成聚谷氨酸[4]。谷氨酸钠的质量浓度就显得非常重要,设置质量浓度分别为 30 g/L,40 g/L,50 g/L,60 g/L,70 g/L。每个试验组设置3个平行,37 ℃ 恒温培养 72 h 后,测定发酵液中聚谷氨酸质量浓度。
1.5 单因素试验优化发酵工艺
1.5.1 摇瓶转速筛选
发酵培养基的转速影响发酵体系的物质传递、氧气传递[5]。为探寻发酵中最佳摇瓶转速,分别设置转速为 160 r/min,180 r/min,200 r/min,220 r/min,240 r/min。每个试验组设置3个平行,37 ℃ 恒温培养 72 h 后,测定发酵液中聚谷氨酸质量浓度。
1.5.2 接种量筛选
接种量影响发酵液中菌体的富集速度和含量,从而影响产物的积累。为探寻发酵中最佳接种量,分别设置接种量为3%,4%,5%,6%,7%。每个试验组设置3个平行,37 ℃ 恒温培养 72 h 后,测定发酵液中聚谷氨酸质量浓度。
1.5.3 初始pH值筛选
pH对微生物的生长和代谢产物生成都有很大影响,不同的微生物对pH值的要求是不同的,为探寻发酵中最佳初始pH值,分别设置初始pH值为6.4,6.6,6.8,7.0,7.2。每个试验组设置3个平行,37 ℃ 恒温培养 72 h 后,测定发酵液中聚谷氨酸质量浓度产量。
1.5.4 发酵温度筛选
从酶反应动力学来看,温度升高,反应速度加大,生长代谢加快,产物生成提前。但是,温度越高酶失活越快,菌体易于衰老,影响产物的生成。为探寻发酵过程中的最佳温度,分别设置发酵温度为 32 ℃,34 ℃,36 ℃,38 ℃,40 ℃。每个试验组设置3个平行,37 ℃ 恒温培养 72 h 后,测定发酵液中聚谷氨酸质量浓度。
1.5.5 发酵时间筛选
发酵时间的长短直接关系到产物的积累,为探寻最佳发酵时间,分别设置发酵时间为 24 h,36 h,48 h,60 h,72 h。每个试验组设置3个平行,37 ℃ 恒温培养 72 h 后,测定发酵液中聚谷氨酸质量浓度。
1.5.6 装液量筛选
装液量影响发酵液的溶氧,为探寻最佳发酵装液量,分别设置装液量为20%,30%,40%,50%,60%。每个试验组设置3个平行,37 ℃ 恒温培养 72 h 后,测定发酵液中聚谷氨酸质量浓度。
1.6 正交试验优化发酵条件
根据单因素实验情况,选择培养基及含量、发酵温度、初始发酵pH、接种量、装液量等来确定最优的发酵条件。正交试验表根据实际情况选择,每组试验设置3个平行,通过测定最终γ-聚谷氨酸质量浓度确定最佳发酵条件。
1.7 小试发酵
根据单因素试验和正交试验结果进行 50 L 罐子小试发酵试验,验证优化后的发酵条件。种子液接种方法为火焰接种法,从发酵开始每隔 2 h 记录pH和溶氧的变化,同时发酵 12 h 后每隔 2 h 取样测量γ-聚谷氨酸质量浓度直至发酵结束。
2 结果与讨论
2.1 单因素试验优化培养基成分
采用 250 mL 三角瓶进行单因素优化发酵试验,按照发酵初始pH7.0,发酵转速 200 r/min,发酵温度 37 ℃,装液量 150 mL,接种量4%进行培养,发酵时间 48 h,发酵完成后检测发酵终点发酵液中的γ-聚谷氨酸质量浓度,按γ-聚谷氨酸质量浓度来确定培养基最优成分及用量。发酵试验结果如图1,图2,图3,图4,图5所示。

图1 不同氮源对γ-聚谷氨酸质量浓度的影响

图2 不同碳源对γ-聚谷氨酸质量浓度的影响

图3 蔗糖含量对γ-聚谷氨酸质量浓度的影响

图4 蛋白胨含量对γ-聚谷氨酸质量浓度的影响

图5 谷氨酸钠含量对γ-聚谷氨酸质量浓度的影响
由图可知,菌株HG-02发酵生产γ-聚谷氨酸的最佳碳源为蔗糖,最佳氮源为蛋白胨,其中蔗糖最佳质量浓度为 40 g/L,蛋白胨最佳质量浓度为 35 g/L,谷氨酸钠最佳质量浓度为 50 g/L。
2.2 单因素试验优化发酵工艺
采用 250 mL 三角瓶进行单因素优化发酵试验,按照单因素优化的培养基配方蔗糖4%,蛋白胨4%,谷氨酸钠5%,硫酸镁0.1%,氯化钠0.5%,氯化钙0.01%,磷酸氢二钾0.05%,硫酸锰0.02%来进行发酵,发酵完成后检测发酵终点发酵液中的γ-聚谷氨酸质量浓度,按γ-聚谷氨酸质量浓度来确定培养基最优成分及用量。发酵试验结果如图6,图7,图8,图9,图10,图11所示。
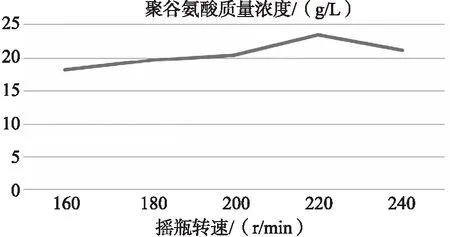
图6 摇瓶转速对γ-聚谷氨酸质量浓度的影响

图7 接种量对γ-聚谷氨酸质量浓度的影响

图8 初始pH对γ-聚谷氨酸质量浓度的影响

图9 温度对γ-聚谷氨酸质量浓度的影响

图10 发酵时间对γ-聚谷氨酸质量浓度的影响

图11 装液量对γ-聚谷氨酸质量浓度的影响
由图可知,菌株HG-02发酵生产γ-聚谷氨酸的最佳转速为 220 r/min,最佳接种量为6%,最佳初始pH为6.8,最佳发酵温度为 36 ℃,最佳发酵时间为 48 h,最佳装液量为40%。
2.3 正交试验优化发酵条件
根据以上单因素实验情况,选择发酵温度、谷氨酸钠、蔗糖、发酵温度进行正交试验来确定最优的发酵条件,正交设计表及结果如表2所示,各因素水平如表1所示。
从正交试验结果表可知,影响γ-聚谷氨酸产率的因素顺序为B>A>D>C,即谷氨酸钠>蔗糖>发酵温度>初始pH,选择最优的组合为A2B3C3D3,即:谷氨酸钠 60 g/L,蔗糖 40 g/L,初始pH值7.0,发酵温度 37 ℃。根据此条件进行摇瓶发酵,至 48 h 发酵结束,测定γ-聚谷氨酸含量为 34.2 g/L。

表1 正交试验各因素水平

表2 正交试验设计表及结果
2.4 小试发酵
在无菌条件下,用接种针挑取一环在平板上活化的菌体接种至种子摇瓶种中,放置于 37 ℃ 恒温摇床上,设置转速为 220 r/min,培养12~14 h,待菌液OD600大于 8 h,接种至 50 L 发酵罐上。发酵罐空消 121 ℃ 灭菌 20 min,实消 121 ℃ 灭菌 30 min,装液量为 20 L(实消后体积为 21.5 L),初始pH为7.01(实消后pH为6.86),接种量为6%,搅拌转速为 220 r/min,通风量为 1.6 m3/h,罐压为 0.07 Mpa,37 ℃ 恒温培养。发酵结束后,测量聚谷氨酸最高质量浓度为 35.9 g/L。发酵过程中的pH、溶氧及聚谷氨酸质量浓度变化如图12所示。

图12 小试发酵pH、溶氧及聚谷氨酸质量浓度变化
3 小结
从实验室现有产γ-聚谷氨酸菌株中筛选出一株高产菌株HG-02,经16srDNA鉴定为枯草芽孢杆菌。以初始培养基为基础,通过单因素试验和正交试验获得菌株HG-02产γ-聚谷氨酸的最佳发酵培养基配方和工艺:蔗糖4%,蛋白胨3.5%,谷氨酸钠6%,硫酸镁0.1%,氯化钠0.5%,氯化钙0.01%,磷酸氢二钾0.05%,硫酸锰0.02%,初始pH7.0,121 ℃ 灭菌 30 min,250 mL 三角瓶,装液量40%即 100 mL,接种量6%,摇床转速为 220 r/min,37 ℃ 振荡培养 48 h。最后用 50 L 小试发酵试验验证,测得聚谷氨酸最终质量浓度为 35.9 g/L,相较于初始发酵工艺产量提高了68.5%,后续将继续进行放大试验。
