IVIM-DWI及DCE-MRI评估兔VX2恶性骨肿瘤放疗早期疗效的价值
2022-11-16刘昶君徐文坚
刘昶君 徐文坚



[摘要] 目的 通过分析体素内不相干运动扩散加权成像(IVIM-DWI)及动态对比增强磁共振成像(DCE-MRI)定量参数的差异,探讨IVIM-DWI及DCE-MRI在评估恶性骨肿瘤放疗早期疗效中的应用价值。
方法 采用手术法将VX2恶性骨肿瘤组织块植入新西兰大白兔右侧胫骨骨髓腔,建立动物模型。肿瘤种植2周后,将30只模型兔随机分为实验组及对照组(n=15),实验组接受放射治疗,对照组不予治疗。于放疗3 d后行IVIM-DWI及DCE-MRI扫描,并取右侧胫骨行组织病理学检查。将原始图像导入后处理软件,对照病理切片于肿瘤实质区勾画感兴趣区(ROI),获得IVIM-DWI定量参数真性扩散系数(D)、假性扩散系数(D*)、扩散分数(f)及DCE-MRI定量参数组织容积转移常数(K)、速率转运常数(Kep)、组织细胞外血管外容积分数(Ve),采用受试者工作特征(ROC)曲线分析评价各参数的诊断效能。
结果 放疗后实验组D值明显高于对照组,D值明显低于对照组,差异具有统计学意义(t=-7.927、4.246,P<0.05);实验组K值明显低于对照组,差异具有统计学意义(t=9.313,P<0.05)。ROC曲线分析显示,各参数中D值的曲线下面积(AUC)最大(0.978)、特异度最高(100.00%),K值的灵敏度最高(93.30%)。
结论 IVIM-DWI定量参数D值联合DCE-MRI定量参数K值可有效评估兔VX2恶性骨肿瘤放疗早期疗效。
[关键词] 骨肿瘤;磁共振成像;放射疗法;治疗结果;兔
[中图分类号] R738.1;R445.2
[文献标志码] A
[文章编号] 2096-5532(2022)05-0650-06doi:10.11712/jms.2096-5532.2022.58.113
[開放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20220622.1615.005.html;2022-06-24 10:59:11
VALUE OF INTRAVOXEL INCOHERENT MOTION DIFFUSION-WEIGHTED IMAGING AND DYNAMIC CONTRAST-ENHANCED MAGNETIC RESONANCE IMAGING IN EVALUATING THE EARLY TREATMENT OUTCOME OF RABBIT VX2 MALIGNANT BONE TUMOR AFTER RADIOTHERAPY
LIU Changjun, XU Wenjian
(Department of Radiology, The Affiliated Hospital of Qingdao University, Qingdao 266003, China);
[ABSTRACT] Objective To investigate the value of intravoxel incoherent motion diffusion-weighted imaging (IVIM-DWI) and dynamic contrast-enhanced magnetic resonance imaging (DCE-MRI) in evaluating the early treatment outcome of malignant bone tumor after radiotherapy by analyzing the difference in quantitative parameters between IVIM-DWI and DCE-MRI.Methods VX2 malignant bone tumor tissue block was implanted by surgery into the marrow cavity of the right tibia of New Zealand white rabbits to establish an animal model. At 2 weeks after implantation, 30 rabbits for modeling were randomly divided into experimental group and control group, with 15 rabbits in each group; the rabbits in the experimental group were given radiotherapy, while those in the control group were not given any treatment. IVIM-DWI and DCE-MRI were performed after 3 days of radiotherapy, and the right tibia was taken for histopathological examination. The original images were imported into the post-processing software, and the region of interest (ROI) in tumor parenchyma was delineated based on pathological section. IVIM-DWI quantitative parameters [true diffusion coefficient (D), perfusion-related diffusion coefficient (D*), and perfusion fraction (f)] and DCE-MRI quantitative parameters [volume transfer constant (K), reflux constant (Kep), and extra-vascular extra-cellular volume fraction (Ve)] were obtained, and the receiver operating characteristic (ROC) curve was used to evaluate the diagnostic efficiency of each parameter.esults After radiotherapy, the experimental group had a significantly higher D value and a significantly lower D* value than the control group (t=-7.927,4.246;P<0.05), and the experimental group had a significantly lower K value than the control group (t=9.313,P<0.05). The ROC curve analysis showed that D value had the largest area under the ROC curve (0.978) and the highest specificity (100.00%), and K value had the highest sensitivity (93.30%).Conclusion The quantitative parameter D value of IVIM-DWI combined with the quantitative parameter K value of DCE-MRI can effectively evaluate the early treatment outcome of rabbit VX2 malignant bone tumor after radiotherapy.
[KEY WORDS] boneneoplasms;magneticresonanceima-ging; radiotherapy; treatment outcome; rabbits
原发性恶性骨肿瘤好发于青少年,恶性程度高,给病人及其家庭带来极大的负担。1970年之前,恶性骨肿瘤的治疗方法以截肢术为主,5年生存率低,超过80%的病人最终死于远处转移。近年来放化疗联合保肢治疗成为恶性骨肿瘤主要治疗方法之一,早期有效的疗效评估与恶性骨肿瘤预后关系密切。如何提高对恶性骨肿瘤放疗后早期微观变化的了解,评估放疗早期疗效,成为临床研究的热点。动态对比增强磁共振成像(DCE-MRI)可间接反映病变组织的微血管生成状态及微观血流灌注状况,体素内不相干运动扩散加权成像(IVIM-DWI)能够有效区分活体组织内部水分子扩散运动产生的真性扩散以及微循环血流灌注产生的假性扩散。有学者利用IVIM-DWI及DCE-MRI进行肿瘤良恶性鉴别及疗效预测的研究,但相关研究多针对软组织肿瘤,罕有两者联合对动物模型恶性骨肿瘤放疗早期疗效评估的研究。本研究旨在通过分析IVIM-DWI及DCE-MRI定量参数的相关性及诊断效能,实现恶性骨肿瘤放疗早期疗效的无创性量化评估。现将结果报告如下。
1 材料与方法
1.1 动物模型建立
雄性健康新西兰大白兔(由青岛市实验动物和动物实验中心提供)32只,2月龄,体质量为2.0~3.0 kg。所有手术及磁共振检查操作均在兔麻醉状态下完成,麻醉采用100 g/L水合氯醛溶液,左侧大腿外侧肌群肌注,注射剂量3 mL/kg。将VX2肿瘤组织块(上海交通大学第一人民医院提供)剪碎、研磨、离心,获得肿瘤细胞悬浊液。取2只新西兰大白兔,用5 mL的注射器取肿瘤细胞悬浊液分别接种于双侧股骨周围肌群,每侧1 mL,制备荷瘤兔。荷瘤兔正常饲养14 d后触摸接种处有硬结形成,在全身麻醉状态下剥离肿瘤,剔除囊变坏死区及纤维组织后,分割成1 mm组织块用以制备兔恶性骨肿瘤模型。将剩余30只新西兰大白兔充分麻醉后仰卧位固定于手术台上,严格遵循无菌原则,纵行切开右侧胫骨结节下方皮肤及皮下组织至暴露骨皮质,用牙科钻钻通至骨髓腔,将2~3块VX2肿瘤组织植入骨髓腔,用骨蜡封堵缺损,逐层缝合切开部位。术后每天连续肌注青霉素4×10 U/kg,共注射3 d,以预防术后感染。
1.2 模型兔分组及处理
肿瘤植入2周后,模型兔在充分麻醉下行磁共振成像(MRI)平扫,确认肿瘤生长后纳入实验。随机编号将30只模型兔分为实验组及对照组,每组15只。实验组于首次磁共振检查后行放射治疗,对照组不予任何治疗。
1.3 放射治疗
实验组模型兔充分麻醉后仰卧位固定于检查床上,充分暴露右侧胫骨内侧肿瘤种植区域。放疗采用医用高能直线加速器(Varian-23EX,USA),照射剂量10 Gy,照射采用6 MeV的X射线,照射次数1次,照射野6 cm×6 cm,源皮距100 cm。
1.4 MRI检查及数据后处理
采用Siemens Prisma 3.0 T MR扫描仪(Siemens Healthcare GmbH,Erlangen,Germany)及8通道动物线圈(上海辰光医疗公司)。模型兔取仰卧位,头先进,扫描范围为兔右側股骨下段1/3处至踝关节。常规MRI扫描序列包括矢状位TWI(TR 737 ms,TE 22 ms)、TIRM(TR 3 200 ms,TE 44 ms,IR 230 ms)、TWI(TR 3 000 ms,TE 96 ms)、冠状位TWI(TR 737 ms,TE 22 ms),层厚3 mm,层间距1 mm,激励次数为4次,FOV为160 mm×160 mm。IVIM-DWI序列为矢状位(TR 3 000 ms,TE 50 ms),共14个b值(b=0、10、20、30、40、50、80、100、150、200、400、600、800、1 000),层厚3 mm,层间距1 mm,激励次数为2次,FOV为17 cm×17 cm。DCE-MRI序列为矢状位(TR 6.5 ms,TE 1.4 ms),层厚3 mm,激励次数为 2 次,FOV为20 cm×20 cm;选择8°、 10°、 12°翻转角各采集1 个时相的图像作为预扫描,最终选择12°翻转角进行多期动态增强扫描,共扫描50个时相,第2个时相结束时立刻应用双筒高压注射器经兔耳缘静脉先注射钆喷葡酸胺(Gd-DTPA,Bayer Schering,Germany)2 mL/kg,流量1.5 mL/s,随后立即注射生理盐水12 mL。
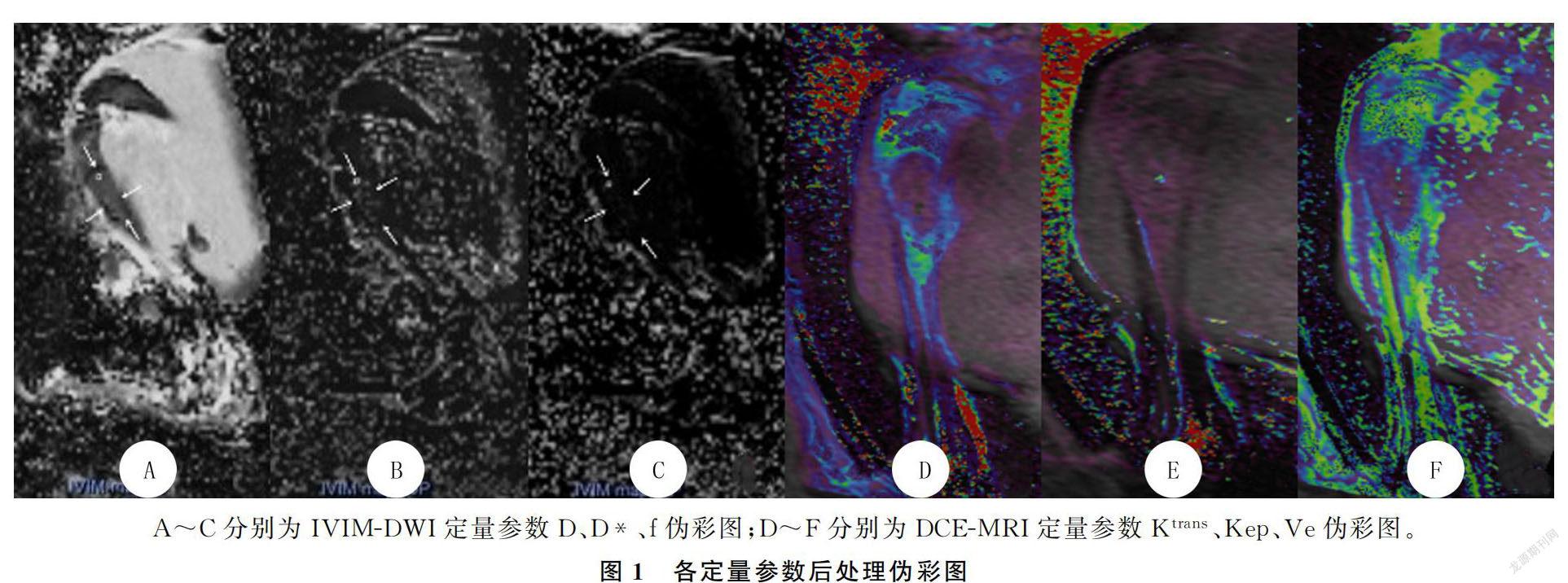
原始DICOM图像导入 Siemens Syngo via.后处理工作站进行后处理,感兴趣区(ROI)放置及参数测量均由两位3年以上年资的骨关节放射科医师进行,意见不同时协商解决。ROI选择:对照病理切片及MRI平扫TWI和TIRM图像选取IVIM-DWI及DCE-MRI矢状位肿瘤的最大径层面勾画ROI,尽量避开坏死区及大血管,ROI=2 mm,共选择3个ROI,参数取平均值。IVIM-DWI图像后处理选择MR Body Diffusion后处理软件,通过双指数模型计算生成IVIM-DWI参数真性扩散系数(D)、假性扩散系数(D*)、扩散分数(f)及伪彩图;DCE-MRI图像后处理选择 Tissue 4D 模块,进行图像运动校正以后,通过血流动力学双室模型计算生成DCE-MRI定量参数组织容积转移常数(K)、速率转运常数(Kep)、组织细胞外血管外容积分数(Ve)及伪彩图。
1.5 组织病理学检查
完成全部磁共振检查后,立即经耳缘静脉注射过量麻醉剂处死模型兔,将股骨下端及踝关节处离断,确保胫骨完整并保留周围软组织,大体标本置于40 g/L中性甲醛溶液中暂存。使用硬组织切片机将标本切成厚度约为3 mm的组织片,最佳组织片包含肿瘤的最大范围区域,而后置于40 g/L中性甲醛溶液中固定,固定好的组织片在EDTA脱钙液中脱钙2周,脱钙完成后进行石蜡包埋、切片,行苏木精-伊红(HE)染色。
1.6 统计学处理
采用SPSS 26.0软件进行统计学分析。IVIM-DWI及DCE-MRI定量参数值符合正态分布,数据以±s表示,两组放疗后参数的比较采用独立样本t检验。绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC),根据Youden指数获得各参数诊断的灵敏度及特异度,分析各参数单独及联合评估恶性骨肿瘤放疗早期疗效的诊断效能,获得最佳诊断界值。检验水准α=0.05,P<0.05 表示差异具有统计学意义。
2 结 果
2.1 两组IVIM-DWI及DCE-MRI定量参数比较
IVIM-DWI及DCE-MRI各参数后处理伪彩图见图1,两组放疗后IVIM-DWI及DCE-MRI定量参数结果见表1。放疗后实验组IVIM-DWI参数的D值明显高于对照组,D*值明显低于对照组,两组间差异具有统计学意义(t=-7.927、4.246,P<0.05);实验组DCE-MRI参数的K值明显低于对照组,两组间差异具有统计学意义(t=9.313,P<0.05)。
2.2 组织病理学观察
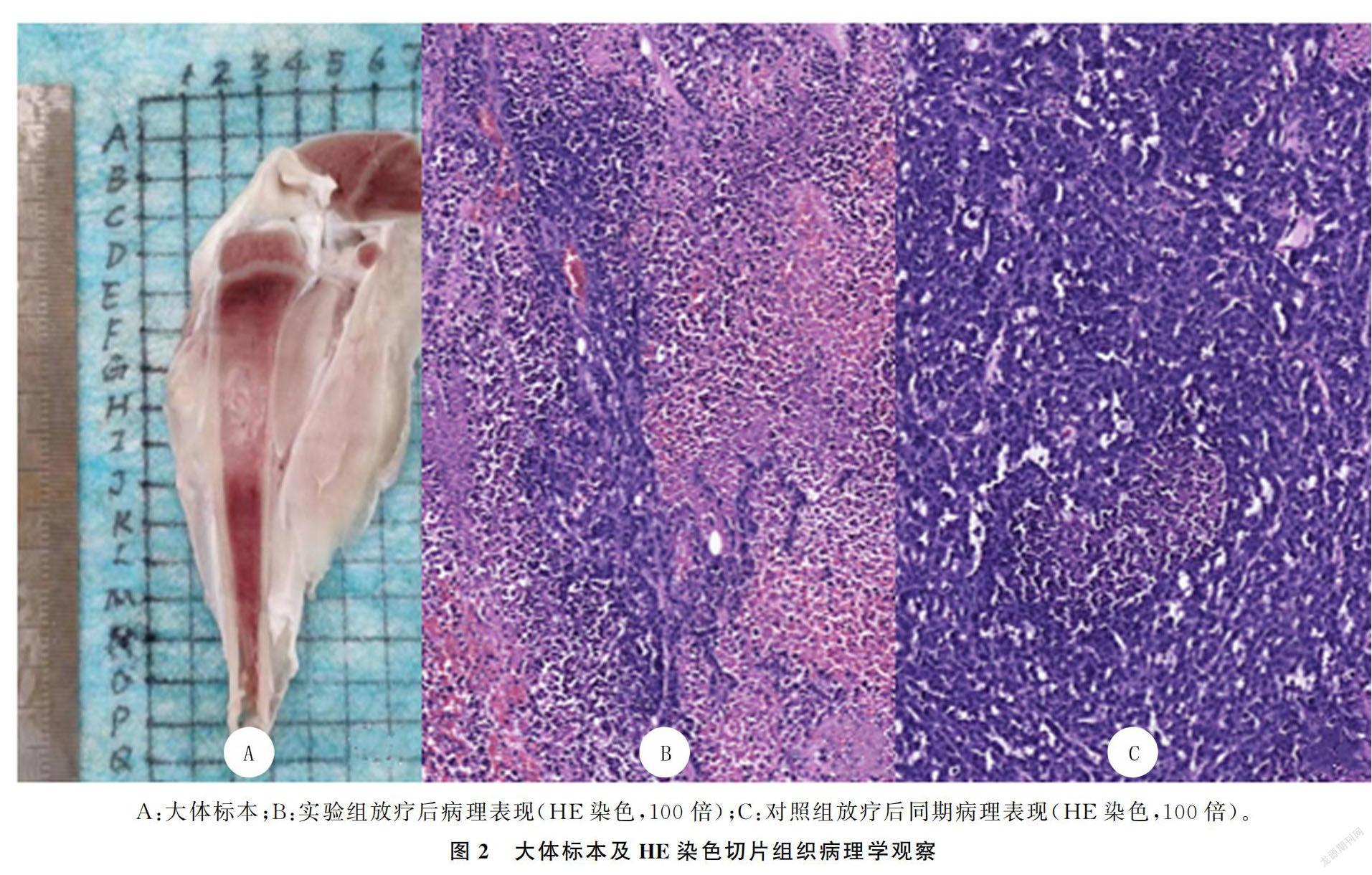
肉眼观察显示,肿瘤沿骨髓长轴生长,边界与正常骨髓组织分界尚清,无包膜,瘤体中心可见不同程度白色坏死组织。HE染色观察显示,对照组肿瘤实性区肿瘤细胞数量增多,排列紊乱密集,细胞核异型性明显,核质比大,坏死不明显;实验组肿瘤实性区肿瘤细胞数量明显减少,残存肿瘤细胞仍可见异型性,但不及对照组明显,瘤巢周围可见大片坏死区。见图2。
2.3 各定量参数ROC曲线分析
ROC曲线分析的结果显示,K值和D值的AUC、灵敏度和特异度均高于其他参数,其中D值的特异度最高(100.00%),而K值的灵敏度最高(93.30%)。见图3和表2。
3 讨 论
常规MRI平扫只能反映组织形态学改变,不能反映肿瘤组织内部的早期微观改变,对于肿瘤疗效的监测具有局限性。近年来快速发展的磁共振灌注成像、功能成像技术等,能够在无创条件下反映肿瘤组织内部微观变化,为肿瘤治疗后早期疗效评估及疗效动态监测提供了可能。IVIM-DWI技术是LE BIHAN等最早提出的描述体素内信号衰减程度与b值间关系的一种MRI技术,采用多b值DWI成像,用于量化分析组织中水分子的扩散和灌注两种运动成分。DCE-MRI技术利用TOFTS等提出的双室药代动力学模型,用于量化分析组织血管通透性和组织灌注情况。目前IVIM-DWI和DCE-MRI序列已广泛应用于多种疾病的实验及临床疗效评估研究中。
IVIM-DWI无需注射外源性对比剂,利用自体水分子基于双指数模型进行运算,反映组织灌注信息及扩散信息,其定量参数值的改变也可被用来进行量化评估。D值反映真实的组织扩散情况,其大小主要受组织细胞内外间隙比值的影响,细胞密集程度大,细胞外间隙体积就相对减小,组织内水分子扩散运动受限,D值相应减小。本研究结果显示,放疗后实验组大白兔D值較对照组明显增大,差异具有统计学意义,与NOUGARET等利用IVIM-DWI评估直肠癌化疗效果的研究结果一致。分析原因可能为:VX2恶性骨肿瘤细胞对放疗敏感,从而使实验组肿瘤细胞密集程度不及对照组(病理结果显示放疗后实验组肿瘤细胞较对照组明显减少,且坏死区增多),细胞外间质体积相对增加,组织内水分子扩散程度增加,故D值增大。D*值代表灌注相关的扩散系数,其大小与肿瘤组织内微血管形成相关。本文的研究结果显示,放疗后实验组D*值较对照组减小,这可能与放疗后肿瘤新生毛细血管减少、毛细血管内皮细胞凋亡以及毛细血管内血栓形成等导致血液灌注减少有关。f值表示单个体素内微循环灌注容积占总体灌注容积的比值。ZHU等对于宫颈癌放化疗疗效评估的研究结果表明,f值易受多种内外界环境因素的影响,因此评估价值有限。
DCE-MRI通过静脉注射对比剂后对ROI进行连续动态图像采集,获得ROI内所有体素的时间-信号强度曲线(TIC),选取Tofts模型对曲线进行分析获得定量参数,是目前临床最常见的无创性评价组织血流灌注的MR技术。K值为对比剂从血管渗漏进入周围组织间隙的转运常数,反映血管的通透性,诸多研究表明K值与组织新生毛细血管密度密切相关。本研究结果表明,放疗后实验组K值较对照组明显减小,分析原因可能是由于放疗导致肿瘤组织新生毛细血管减少、毛细血管壁变性或坏死导致新生毛细血管密度减低,肿瘤组织血管灌注减少、血管通透性减低。Kep值代表对比剂反向渗透进入血管内的反向速率常数,同样受到血流量、血管内皮通透性等因素的影响。COENEGRACHTS等的研究表明,Kep值可作为预测肿瘤疗效的指标之一。但本研究未显示两组间Kep值差异具有统计学意义,可能与肿瘤的异质性有关。Ve值代表血管外细胞外间隙中的对比剂体积占单位体积的比例。部分学者认为,Ve值受到肿瘤细胞密度、肿瘤细胞分化程度、对比剂在血管内外交换速率等多重因素的影响,因此在肿瘤的疗效评估方面无明显价值。这与本研究的结果相一致,Ve值能否应用于肿瘤疗效评估还有待进一步研究探讨。
本研究應用ROC曲线对K、Kep、Ve、D、D*及f值的诊断效能进行分析,结果显示,D值的诊断效能最高(AUC=0.978),其对应的灵敏度、特异度分别为86.70% 和100.00%;K值的诊断效能次之(AUC=0.969),其对应的灵敏度、特异度分别为93.30%和93.30%。
本研究具有以下不足之处:①观察期较短,仅研究放疗后3 d恶性骨肿瘤IVIM-DWI及DCE-MRI定量参数变化,对于放疗后不同时期定量参数的动态变化有待进一步研究;②放疗方法为单次大剂量放疗,临床根据病人不同情况常采用多次小剂量放疗方案,对于两种放疗方案治疗后各定量参数的比较有待进一步研究。
综上所述,IVIM-DWI定量参数D值对于恶性骨肿瘤放疗早期疗效评估具有较高的灵敏度,DCE-MRI定量参数K值则具有较高的特异度,IVIM-DWI联合DCE-MRI可为放疗早期疗效的评估提供有效的检测手段。
[参考文献]
[1]ROSEN G, TAN C, SANMANEECHAI A, et al. The ratio-nale for multiple drug chemotherapy in the treatment of osteogenic sarcoma[J]. Cancer,1975,35(3 suppl):936-945.
[2]LE BIHAN D, BRETON E, LALLEMAND D, et al. MR imaging of intravoxel incoherent motions: application to diffusion and perfusion in neurologic disorders[J]. Radiology,1986,161(2):401-407.
[3]LI J L, YE W T, LIU Z Y, et al. Comparison of microvascular perfusion evaluation among IVIM-DWI, CT perfusion imaging and histological microvessel density in rabbit liver VX2 tumors[J]. Magnetic Resonance Imaging, 2018,46:64-69.
[4]GAETA M, BENEDETTO C, MINUTOLI F, et al. Use of diffusion-weighted, intravoxel incoherent motion, and dynamic contrast-enhanced MR imaging in the assessment of response to radiotherapy of lytic bone metastases from breast cancer[J]. Academic Radiology, 2014,21(10):1286-1293.
[5]TOFTS P S, BRIX G, BUCKLEY D L, et al. Estimating kinetic parameters from dynamic contrast-enhanced T-weighted MRI of a diffusable tracer: standardized quantities and symbols[J]. Journal of Magnetic Resonance Imaging,1999,10(3):223-232.
[6]SHINMOTO H, TAMURA C, SOGA S, et al. An intravoxel incoherent motion diffusion-weighted imaging study of prostate cancer[J]. AJR American Journal of Roentgenology, 2012,199(4):W496-W500.
[7]SIGMUND E E, CHO G Y, KIM S, et al. Intravoxel incohe-rent motion imaging of tumor microenvironment in locally advanced breast cancer[J]. Magnetic Resonance in Medicine, 2011,65(5):1437-1447.
[8]王洁琼. 定量DCE-MRI在前列腺癌雄激素阻断疗法疗效评价中的应用[J]. 医学影像学杂志, 2018,28(10):1705-1708.
[9]林蒙,张琪,孔月,等. 子宫颈癌IVIM与DCE-MRI灌注相关性研究[J]. 磁共振成像, 2018,9(5):354-359.
[10]何陈伟,陈亚君,邹靖,等. 动态对比增强磁共振成像在局部晚期宫颈癌同步放化疗效果评估中的价值[J]. 分子影像学杂志, 2021,44(1):74-77.
[11]ICHIKAWA S, MOTOSUGI U, ICHIKAWA T, et al. Intravoxel incoherent motion imaging of the kidney: alterations in diffusion and perfusion in patients with renal dysfunction[J]. Magnetic Resonance Imaging, 2013,31(3):414-417.
[12]FEDERAU C, O'BRIEN K, MEULI R, et al. Measuring brain perfusion with intravoxel incoherent motion (IVIM): initial clinical experience[J]. Journal of Magnetic Resonance Imaging: JMRI, 2014,39(3):624-632.
[13]趙晓艳,赵鑫,张小安,等. IVIM-DWI与DCE-MRI对宫颈癌的诊断价值和相关性研究[J]. 实用放射学杂志, 2018,34(5):717-720.
[14]NOUGARET S, VARGAS H A, LAKHMAN Y, et al. Intravoxel incoherent motion-derived histogram metrics for assessment of response after combined chemotherapy and radiation therapy in rectal cancer: initial experience and comparison between single-section and volumetric analyses[J]. Radiology, 2016,280(2):446-454.
[15]MILLIAT F, FRANĢOIS A, TAMARAT R, et al. Role of endothelium in radiation-induced normal tissue damages[J]. Annales De Cardiologie Et D’Angeiologie, 2008,57(3):139-148.
[16]GOLDIN-LANG P, PELS K, TRAN Q V, et al. Effect of ionizing radiation on cellular procoagulability and co-ordinated gene alterations[J]. Haematologica, 2007,92(8):1091-1098.
[17]CUI Y F, ZHANG C Y, LI X M, et al. Intravoxel incoherent motion diffusion-weighted magnetic resonance imaging for monitoring the early response to ZD6474 from nasopharyngeal carcinoma in nude mouse[J]. Scientific Reports, 2015,5:16389.
[18]ZHU L, ZHU L J, SHI H, et al. Evaluating early response of cervical cancer under concurrent chemo-radiotherapy by intravoxel incoherent motion MR imaging[J]. BMC Cancer, 2016,16:79.
[19]SOURBRON S P, BUCKLEY D L. On the scope and interpretation of the Tofts models for DCE-MRI[J]. Magnetic Resonance in Medicine, 2011,66(3):735-745.
[20]ROBERTS C, ISSA B, STONE A, et al. Comparative study into the robustness of compartmental modeling and model-free analysis in DCE-MRI studies[J]. Journal of Magnetic Resonance Imaging: JMRI, 2006,23(4):554-563.
[21]FRANIEL T, HAMM B, HRICAK H. Dynamic contrast-enhanced magnetic resonance imaging and pharmacokinetic models in prostate cancer[J]. European Radiology, 2011,21(3):616-626.
[22]赵斌. 磁共振灌注成像临床应用及进展[J]. 磁共振成像, 2014,5(S1):46-50.
[23]宋媛,丁爽,贾文霄. DCE-MRI评价肿瘤血管生成的实验研究[J]. 放射学实践, 2014,29(6):640-643.
[24]王莉莉,林江,吕鹏,等. IVIM及DCE-MRI与非小细胞肺癌免疫组化指标MVD、EGFR和Ki67相关性的研究[J]. 中国CT和MRI杂志, 2017,15(5):60-63,封3.
[25]袁灼彬,郑晓林,邹玉坚,等. 肝癌的DCE-MRI定量成像与微血管密度、Ki-67相关性研究[J]. 临床放射学杂志, 2017,36(11):1648-1652.
[26]ZHOU N, CHU C, DOU X, et al. Early evaluation of irradiated parotid glands with intravoxel incoherent motion MR imaging: correlation with dynamic contrast-enhanced MR imaging[J]. BMC Cancer, 2016,16(1):865.
[27]CUENOD C A, BALVAY D. Perfusion and vascular permeability: basic concepts and measurement in DCE-CT and DCE-MRI[J]. Diagnostic and Interventional Imaging, 2013,94(12):1187-1204.
[28]COENEGRACHTS K, BOLS A, HASPESLAGH M, et al. Prediction and monitoring of treatment effect using T-weighted dynamic contrast-enhanced magnetic resonance imaging in colorectal liver metastases: potential of whole tumour ROI and selective ROI analysis[J]. European Journal of Radiology, 2012,81(12):3870-3876.
[29]AHN S J, KOOM W S, AN C S, et al. Quantitative assessment of tumor responses after radiation therapy in a DLD-1 colon cancer mouse model using serial dynamic contrast-enhanced magnetic resonance imaging[J]. Yonsei Medical Journal, 2012,53(6):1147-1153.
[30]LEI J, HAN Q, ZHU S C, et al. Assessment of esophageal carcinoma undergoing concurrent chemoradiotherapy with quantitative dynamic contrast-enhanced magnetic resonance imaging[J]. Oncology Letters, 2015,10(6):3607-3612.
(本文編辑 马伟平)
