乳腺叶状肿瘤影像表现对照病理分析
2022-07-09张丽萍吴秀丽刘晓霞黄宝生
张丽萍,吴秀丽,刘晓霞,黄宝生
(河西学院附属张掖人民医院影像科,甘肃 张掖 734000)
乳腺叶状肿瘤是一种由上皮和纤维两种组织构成的具有双相分化的特殊类型乳腺肿瘤,占乳腺肿瘤的0.3%~1.5%,纤维上皮性肿瘤的2%~3%,主要发生在40~50 岁的女性。乳腺叶状肿瘤分良性、交界性和恶性3 个亚型,良性与交界性五年生存率约83%~95%,而恶性五年生存率仅为65%,不论良、恶性术后都有转移和复发的可能,手术切除仍然是此类肿瘤的主要治疗方式。首次术式的选择与转移、复发率密切相关[1],本研究回顾分析32 例乳腺叶状肿瘤的影像学表现,以病理为基础,总结各种影像学特征性表现,提高术前诊断的准确率。
1 资料与方法
1.1 一般资料
收集河西学院附属张掖人民医院2015 年9 月—2019 年4 月乳腺叶状肿瘤患者32 例,均为女性,年龄37~69 岁,平均(48.46±11.4)岁。包括复发病例3 例。所有病例因无痛性乳腺肿块前来就诊,25 例肿块在近3~5 月内突然增大。病程(44.7±11.5)月,最短6 个月。体格检查:肿块最小的约2.2 cm×1.8 cm,最大的约14.5 cm×13 cm,肿块活动度良好。实验室检查均无异常记载。
1.2 仪器与方法
1.2.1 仪器
超声使用日立图腾(HI VISION Ascendus)彩色多普勒超声仪,探头频率11.0 MHz。X 线钼靶摄影使用上海联影医疗公司生产的数字乳腺X 线摄影系统。磁共振成像(MRI)应用西门子1.5T Aera 双梯度MRI 扫描,4 通道相控阵乳腺表面线圈。
1.2.2 方法
超声检查由1 名具有乳腺疾病五年诊断经历的主治医师操作完成,1 名副主任医师复核。患者为仰卧位,常规对乳腺及双腋下连续扫查。先用二维超声观察肿块部位、大小、形态、包膜、边缘及内部回声、后方回声是否衰减、纵横比、有无钙化。再用彩色多普勒观察肿块内部、周边有无血流及血流分布情况,检测并记录肿块血流的收缩期峰值(PVS)、阻力指数(RI)及搏动指数(PI)。按照Adler 等半定量血流分级方法进行评价[2]。X 线钼靶摄影由1 名有经验的主管技师完成,1 名主治医师阅片,1 名副主任医师审核。X 线钼靶摄影患者采取站立位,常规摄取头尾位及内外侧斜位摄片40°~45°。MRI 检查患者取俯卧位,双侧乳腺置于4 通道相控阵表面线圈内。扫描序列包括:常规轴位FSE T1WI(TR675 ms,TE11.5 ms,FOV34 cm,激励次数2,层厚4 mm,间隔,1 mm),矢状位压脂T2WI(TR3800 ms,TE85 ms,FOV23 cm,激励次数2,层厚4 mm,间隔1 mm),轴位STIR(TR5000 ms,TE42 ms,视野34 cm,激励次数2,层厚4 mm,间隔1 mm);轴位DWI:采用单次激发平面回波系列(Single-Shot Spin-Ccho Ccho-Planar,SS-SE-EP),TR4.2 ms,TE1.58 ms FOV34 cm,b=50 400,800 s/mm2,层厚5 mm;动态增强采用3D FSE序列扫MIAO(TR5.4 ms,TE2.8 ms,FOV34 cm,激励次数0.8,层厚3 mm,间隔0 mm),每个时相采集52 s,共采集12 个时相。动态增强扫描蒙片后用高压注射器通过肘正中静脉团注钆双胺(GE 药业),注射剂量按0.2 mmol/kg 计算,流率3 mL/s,随后注射生理盐水20 mL,注射结束后立即动态增强扫描。MRI图像由1 名具有五年专业阅片经验的主治医师阅片并书写诊断报告,1 名副主任医师复核。3 种影像评价均采用美国放射协会提出的“乳腺影像报告与数据系统(BI-RADS)第5 版的分类标准进行分类[3]。
2 结果
2.1 超声、乳腺X 线摄影及MRI 影像学表现
2.1.1 超声表现
32 例超声检查均为单发肿块,肿块切面轮廓呈不同程度的分叶,周围腺体组织被推压,部分肿块内部回声欠均匀,内见形状、大小不一的液性暗区。肿块<5 cm 的5 例,其边缘光整,内部回声均匀,包膜完整,与周围腺体分界清晰,血流分级以Ⅱ级为主,动脉阻力指数(RI)为0.61±0.03,收缩期峰值流速(Vmax)为12.71±2.13。肿块5~10 cm 的17 例,呈椭圆形10 例,不规则形7 例,边界不清呈分叶状,包膜不完整,内部回声不均匀,其中2 例见粗大钙化高回声影,血流分级以Ⅱ级、Ⅲ级为主,后方回声衰减,动脉阻力指数(RI)值0.65±0.03,收缩期峰值流速(Vmax)值15.59±3.95;肿块>10 cm 的10 例,最大直径14.5 cm,肿块呈不规则形或分叶状,与周围腺体分界清,未见包膜回声,内部回声不均匀并见囊变、坏死,血流分级以Ⅲ级为主,后方回声衰减;动脉阻力指数(RI)为0.69±0.05,收缩期峰值流速(Vmax)值为18.38±5.73。
2.1.2 乳腺X 线摄影表现
32 例病灶呈高密度肿块影,椭圆形17 例,不规则形15 例,边缘清楚,周围腺体推压、移位,肿瘤周围见晕环征,皮肤、皮下脂肪间隙清晰,双侧乳头形态正常。肿块<5 cm 的5 例,边缘光整,可见晕环征,与周围腺体分界清晰,密度均匀,其中2 例呈浅分叶;肿块在5~10 cm 的17 例,呈椭圆形或不规则形,其中14 例边缘模糊,周围腺体呈推移状,内部密度不均匀,似多个肿块重叠,肿块边缘见深分叶,3 例见粗大钙化;肿块>10 cm 的10 例,肿块以不规则形为主,其中5 例边缘不清,病灶几乎占据患侧整个乳房,病灶最大径约14.5 cm,肿瘤周围见较多迂曲血管影,2 例见小结节及斑片状钙化影。
2.1.3 MRI 表现
叶状肿瘤内部信号多混杂不均,以T1WI 低信号,T2WI 高信号为主,T2WI 信号强度、ADC 值大小和肿瘤的组织分级有相关性,组织分化越差,T2WI 信号强度越高,相应ADC 值变小。本研究病灶<5 cm 的5例,呈边缘清晰的类圆形,T1WI 呈等或稍低信号,T2WI呈高信号,DWI(b=800)呈高信号,ADC 值(1.37~1.66)×10-3mm2/s;动态增强扫描呈均匀强化,时间-信号强度曲线(DCE-TIC)呈流入型;肿块在5~14 cm 的27 例T1WI 呈不均匀低信号,其中3 例病灶内杂有斑片状高信号,T2WI 呈混杂高信号,8 例病灶内部见明亮高信号,DWI(b=800)呈高信号,ADC 值(1.04~1.35)×10-3mm2/s,15 例病灶见裂隙状囊腔,分隔在T1WI、T2WI 均呈低信号,动态增强扫描肿瘤内部强化不均匀,囊壁明显强化,分隔及中心区无强化,(DCE-TIC)以平台型为主。
2.2 超声、x 线钼靶和MRI 诊断符合率
超声、X 线钼靶、MRI 检查结果及诊断准确率对比见表1。
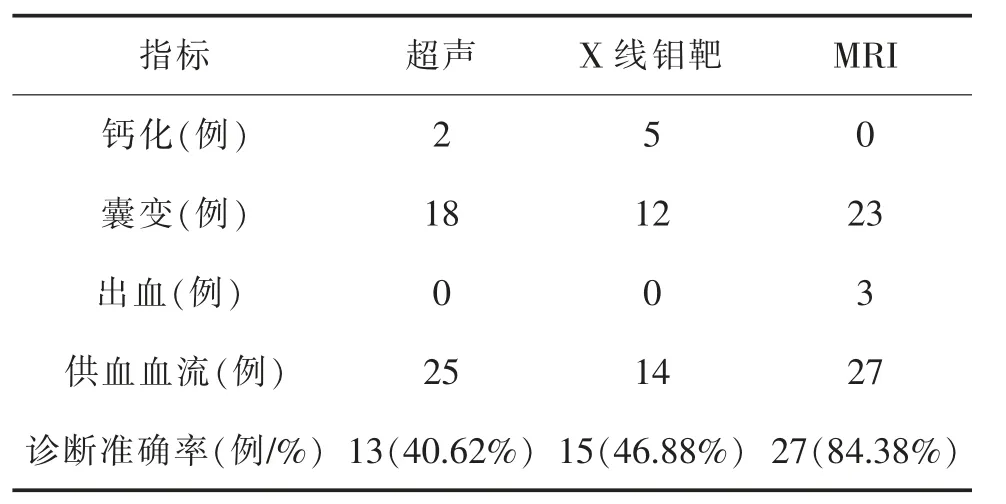
表1 超声、X 线钼靶、MRI 检查结果及诊断准确率对照表
2.3 超声、X 线钼靶及MRI 表现及病理表现对照
32 例患者均经手术病理证实,其中良性19 例,交界性10 例,恶性3 例。病理组织学分类标准依据间质高细胞性、核分裂、边缘浸润、间质结构、局部复发危险性、转移率、间质细胞多形性及异源性间质分化状况等方面。超声、乳腺X 线摄影及MRI 表现与病理表现对照见表2—表4。
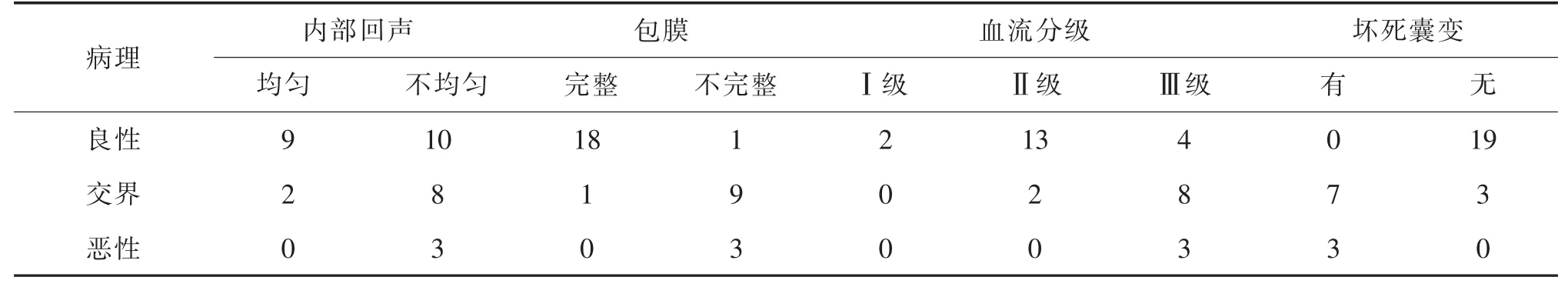
表2 超声表现与病理结果对照表(例)

表3 X 线钼靶与病理结果对照表(例)
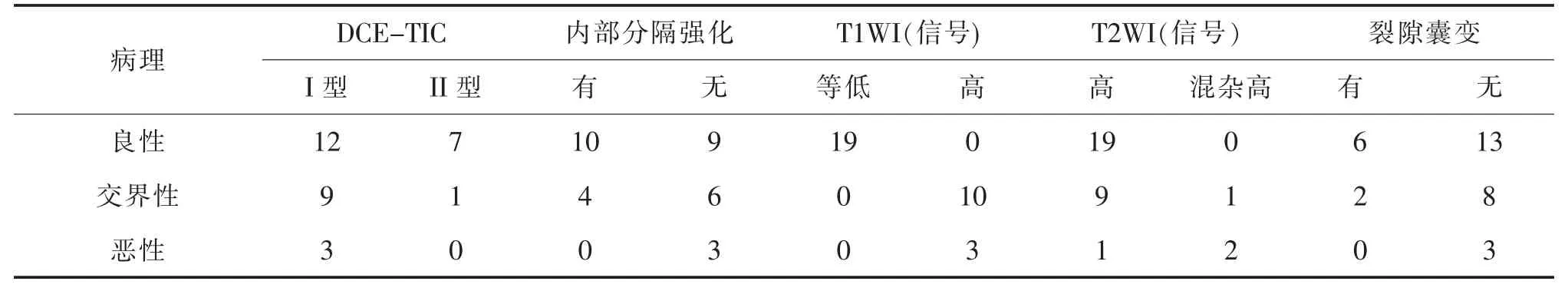
表4 MRI 表现与病理结果对照表(例)
3 讨论
3.1 乳腺叶状肿瘤临床及生物学行为特征
乳腺叶状肿瘤属于罕见乳腺纤维上皮型肿瘤,该肿瘤首先由Muller 于1938 年描述并命名[4]。世界卫生组织(WHO)于1981 年和2003 年将其命名为叶状肿瘤[5],病因不详,多发于40~50 岁中年妇女。肿瘤多为单发,肿块大小不一,多呈圆形或椭圆形,触诊质地柔韧,无痛感,与皮肤无粘连。大的病灶可呈分叶状或多个肿块堆积而成,皮下可见增粗、增多血管影。肿瘤生长缓慢,自临床发现与第一次治疗之间的间隔差异极大,肿块在短期内迅速增大。本组32例患者中发病年龄37~69 岁(平均48.46±11.4 岁),显著高于纤维腺瘤发病年龄,其中25 例肿块在近3~5个月突然增大。叶状肿瘤呈膨胀性生长,边缘光整、锐利,与皮肤分界清,其生物学行为难以预测,肿瘤为双组织源性肿瘤,来自乳腺的上皮结缔组织,与纤维腺瘤的区别在于间质细胞密度增高且经常有上皮的高度增生。组织病理学上皮和间质成分的出现是诊断叶状肿瘤必需的,间质是肿瘤性成分,它决定病理行为,因其复发、转移程度不一,临床治疗方式不同,良性叶状肿瘤<5 cm 的肿块在治疗中首选手术切除,切缘阴性>1 cm,良性叶状肿瘤>5 cm 及恶性、交界性选择部分乳腺切除或全乳切除,文献报告其放化疗疗效不确定,所以术前及术后均不做辅助治疗[6]。
3.2 鉴别诊断
3.2.1 与纤维腺瘤鉴别
纤维腺瘤病人相对较年轻,发病高峰年龄15~39岁;肿瘤直径很少超过5 cm;肿块呈等密度/等信号或回声均匀,边界光整无分叶,部分病灶内部可有爆米花样钙化;肿块内部囊变、坏死少见,可见纤维分隔;肿瘤周围增粗、迂曲血管少见;彩色多普勒血流显像(CDFI)显示血流不丰富;在MRI 增强后,纤维腺瘤呈渐进性均匀强化,分隔后期强化,时间-信号强度曲线以流入型为主;叶状肿瘤病人年龄偏大,肿块短期内迅速增大,肿块密度均较高、较大,肿块边缘光滑有分叶或有多个结节堆积;肿瘤内部易出现囊变、坏死及出血,CDFI 显示血流丰富;MRI压脂T2WI 裂隙状囊变是特征性改变,增强后肿瘤呈不均匀强化,囊壁明显强化,分隔不强化是特点,时间-信号强度曲线以平台型为主[7]。本组<5 cm 肿块,由于其边缘光整、内部密度/信号均匀,未见坏死及囊变,血流信号不丰富。本研究中X 线钼靶及超声5 例均误诊为纤维腺瘤;MRI 2 例误诊为纤维腺瘤。
3.2.2 与非特殊型浸润性导管癌鉴别
浸润性乳腺癌肿块呈不规则形,内部或周围见微细钙化、局部皮肤增厚、牵拉,肿块边缘见毛刺改变;超声表现:肿块纵径常大于横径,可有强回声钙化伴声影;CDFI 显示肿块供血丰富,以Ⅲ级血流为主;脉冲多普勒:动脉阻力指数(RI)及收缩期峰值流速Vmax 值高;MRI 动态增强,其时间-信号强度曲线以平台型或流出型为主,DWI 上呈较高信号且ADC值大多降低,MRS 可见明显升高的Cho 峰;叶状肿瘤肿块呈膨胀性生长,边缘光整见分叶,钙化少见,多为斑片状不均质钙化,周围无浸润恶性征象,腋下无肿大淋巴结,MRI 动态增强,其时间-信号强度曲线以平台型为主[8]。超声主要表现为圆形或卵圆形肿块,边界清呈分叶状的低回声实性肿块或内部回声不均匀囊实性肿块。本组病例中误诊为浸润性乳腺癌X 线钼靶6 例,超声5 例、MRI 3 例。
4 结论
乳腺叶状肿瘤是少见乳腺纤维上皮型肿瘤,在临床上有一定特点,无痛性肿块,触诊柔韧,短期内迅速增大,不伴有腋窝淋巴结肿大等[9]。由于河西学院附属张掖人民医院地处大西北,患者思想保守、经济落后,对该病认识不够,肿瘤检查时都已较大,本组32 例病例中<5 cm 的肿块5 例,>5 cm 的肿块27例。有文献报道叶状肿瘤大于5 cm 的恶性程度较大,姜霞和肖虹[10]认为肿块大小不能作为判定良恶性的依据;本组病例中,<5 cm 的肿块1 例为恶性;>5 cm恶性2 例,10 例交界性肿块大小为9~14.5 cm,最大的直径为14.5 cm,就本组数据显示肿块大小对良恶性判定有一定的参考价值。
本研究对比、分析3 种影像检查在叶状肿瘤诊断准确率,结果表明MRI 术前诊断准确率最高,X 线钼靶居中,超声最低。X 线钼靶检出病灶是依据病变与正常腺体组织的密度差,在脂肪型乳腺中检出病灶敏感性高,在不均匀致密型及极度致密型乳腺检出病灶敏感性低,肿块边缘由于与周围腺体相重叠显示边缘模糊,本组病例21 例边缘模糊;超声显示肿块边界模糊不清包膜不完整有13 例,病理结果:交界性10 例,恶性3 例,从本组数据表明肿瘤边界不清提示恶性度较高,与王霈等[11]的研究结果一致。超声及MRI 因其成像原理不同在病灶细微结构显示上有一定优越性,尤其是MRI 具有多参数、多方位、多模态成像方式,在显示肿瘤边缘、内部情况、供血血管及病灶与周围腺体关系方面具有特定的优势;本组15 例肿块内部回声及信号不均匀,T1WI 以等低信号为主,T2WI 以高、明显高信号,这与肿瘤内囊变、坏死、黏液样变有关[12];本组病例10 例交界性,3 例恶性均出现裂隙样囊变坏死,充分说明在诊断判定肿瘤良恶性时,裂隙样变及增强扫描肿瘤内部分隔及中心区无强化,是MRI 特异性表现,与谢东等[13]报道相一致。肿瘤边缘的分叶是叶状肿瘤特征性表现,深分叶>3 mm,浅分叶<3 mm,本组病例良性19例,深分叶13 例,交界性10 例,深分叶6 例,恶性3例,深分叶2 例,就分析显示肿瘤分叶的深浅度与判定肿瘤良恶性无相关性;在钙化检测上X 线钼靶优于超声及MRI。肿块内的钙化较少见,本组病例4例肿块内见粗大不均质钙化,1 例为细小钙化,其中交界性2 例,良性3 例。术前细小钙化误诊为乳腺癌,术后病理为良性叶状肿瘤;就本组数据显示钙化在良恶性判定上指导意义不大,与汪思娜等[14]认为细小钙化对判定肿瘤良恶性有一定价值不相符,期待有更大样本资料确实。
综上所述,中年女性发现乳腺边界清晰肿块,并在短期内迅速增大,首先要考虑叶状肿瘤可能;比较三种影像学检查方法,MRI 在诊断叶状肿瘤准确率占首位,在显示肿块边缘及内部结构具有明显优势。其弥散成像能反应间质细胞形成的程度。裂隙征及多结节融合是MRI 重要特征,也是与纤维腺瘤鉴别要点。掌握这些特征,能提高叶状肿瘤术前诊断率,但确诊仍需病理及免疫组化[15]。
