高频rTMS对健康大鼠认知功能与运动皮质LTP变化的相关性研究
2022-05-20徐兴俊戴文骏章天娇
徐兴俊,沈 滢,,伍 琦,朱 奕,郭 川,戴文骏,章天娇,王 彤*
1南京医科大学康复医学院,江苏 南京 211166;2南京医科大学第一附属医院康复医学科,江苏 南京 210029
经颅磁刺激(transcranial magnetic stimulation,TMS)是一种神经调控技术,它通过时变的脉冲磁场,在大脑皮质内产生感应电流,介导神经元膜电位改变,从而影响神经电生理活动和脑内代谢[1]。重复经颅磁刺激(repetitive TMS,rTMS)是TMS 最常用的一种刺激方式,根据刺激参数的不同可产生不同的治疗效应,其中高频rTMS(频率>1 Hz)可以提高刺激区域皮质的兴奋性,产生突触传递功能的长时程增强(long⁃term potentiation,LTP)样效应,并且能使刺激区域脑血流量增加,且通过被刺激脑区的神经网络连接可以影响到远隔区域的大脑功能,产生远隔效应[2-5]。
高频rTMS 在认知功能障碍的治疗方面显示出一定优势。近年来,大量临床研究显示以背外侧前额叶皮质为靶点的高频rTMS 可以改善正常人以及认知功能障碍患者的认知功能,但是其作用机制尚不清楚[6]。LTP 和长时程抑制(long⁃term potiation,LTD)样效应是大脑突触可塑性的主要表现形式,与认知功能密切相关,可能是rTMS改变认知功能的主要原因[7]。体外研究发现,高频rTMS可以通过介导突触前膜和突触后膜的同时去极化,导致突触后膜N⁃甲基⁃D⁃天冬氨酸受体(N⁃methyl⁃D⁃aspartic acid re⁃ceptor,NMDAR)钙离子通道开放,大量快速钙离子流入突触后神经元内,从而诱发LTP效应[8-9]。体内实验发现高频rTMS可以增强皮层下LTP效应[10-13]。研究证明,阿尔兹海默症(Alzheimer disease,AD)患者存在包括初级运动皮层(primary cortex,M1)在内的广泛皮质可塑性受损,且其M1皮质可塑性和认知功能正相关,可以辅助检测及预测其认知功能[14]。TMS联合肌电图可以非侵入性的检测M1区LTP样可塑性,适用于临床预测认知功能障碍患者的认知功能[14]。本研究拟探讨高频rTMS对健康大鼠大脑认知功能的影响及大脑运动皮质LTP样可塑性的改变,并分析运动皮质LTP样可塑性与认知功能改善的相关性。
1 材料和方法
1.1 材料
健康SPF 级雄性成年SD 大鼠24 只,随机分为control 组和rTMS 组(n=12),每组6只大鼠用于空间情景记忆检测,之后进行M1 区LTP 样可塑性检测;每组6只大鼠用于Westen blot检测。大鼠体重350~400 g[南京医科大学实验动物中心提供,动物许可证号:SYXK(苏)2018⁃20020;动物实验伦理号:2007005⁃1]。所有动物均饲养于南京医科大学SPF级实验环境中,采用已消毒实验动物饲料喂养,饲养环境温度控制在20~25 ℃,自然光条件下自由摄食及饮水。严格按照中华人民共和国《实验动物管理条例》进行实验动物相关工作。
YRD CCY⁃IA型磁场刺激仪(武汉依瑞德),最大磁场强度为3.5 T。Morris水迷宫(北京吉安得尔科技有限公司),一抗anti⁃NMDAR 2B 抗体(1∶1 000,4207S,Cell Signal Technology 公司,美国),anti⁃NM⁃DAR 2A 抗体(1∶1 000,ab124913,Abcam 公司,美国),anti⁃NMDAR1 抗体(1∶1 000,5704S,Cell Signal Technology公司,美国),anti⁃β⁃actin 抗体(1∶25 000,wx488142,ABclonal 公司,美国),小鼠抗兔二抗(1∶5 000,sc⁃2357,Santa Cruz Blotechnology 公司,美国),水合氯醛(C11597902,麦克林)。
1.2 方法
1.2.1 rTMS治疗
rTMS组所有大鼠均在清醒状态下接受rTMS干预。使用依瑞德3号圆形动物线圈(外径5.8 cm,内径1.8 cm)进行rTMS,线圈中点放于大鼠双侧内眦连线中点,刺激频率为10 Hz,刺激强度为80%平均静息运动阈值[10],刺激10 min,总共刺激1 000 个脉冲,1 d 1 次,1 周5 次,共刺激4 周。control 组仅接受假刺激:将TMS 线圈翻转90°,垂直于大鼠头皮,其余刺激参数与rTMS 组一致。
1.2.2 运动诱发电位(motor evoked potential,MEP)
记录电极和参考电极的位置分别为大鼠右侧腓肠肌肌腹和肌腱,地线电极置于大鼠脊柱旁肌肉,电极采用25 G针电极。通过触摸伸展的大鼠右侧后肢确定肌肉位置。大鼠进入深度麻醉之后,在其左侧M1 区行单次TMS,记录由磁刺激诱发出的肌电图信号,肌电图信号被放大×1 000,带通滤波10~1 000 Hz,采样频率为50 Hz。
1.2.3 静息运动阈值(resting motor threshold,RMT)
分别在rTMS组和对照随机选出6只大鼠,进行RMT测量。10%水合氯醛麻醉(0.3 mL/100 g),深度麻醉后对大鼠左侧M1区进行单脉冲TMS,同时采集右侧腓肠肌的MEP,10次刺激中有5次能诱发MEP波幅超过50 μV 的最小刺激强度为RMT。测得12 只鼠的平均RMT为1.4 T。
1.2.4 运动皮质LTP样可塑性
两组大鼠,每组6只,在进行情景记忆检测后对TMS响应(能得到运动诱发电位)的大鼠进行M1区LTP 样可塑性的检测,10%水合氯醛麻醉(0.3 mL/100 g),大鼠进入深度麻醉状态后在左侧M1区给与刺激强度为120%RMT的TMS,同时记录右侧腓肠肌肌电图,连续进行10次刺激,作为基线。基线测定后对M1 区进行高频rTMS 干预,频率为10 Hz,串时程10 s,串间歇5 s,总时间10 min,总脉冲数为1 000 个,分别在刺激后0、10、15、30 min这4个时间点采集运动诱发电位,分别采集10 条。高频rTMS 干预前后MEP的波幅的增幅用于测定M1区的LTP样可塑性。
1.2.5 Morris水迷宫
采用Morris 水迷宫进行空间情景记忆的检测,Mirrois 水迷宫的直径1.5 m、高0.5 m、水深0.22 m,共分为NE、NW、SE、SW 4 个象限,实验时水池温度控制在22~24 ℃,实验过程中保持安静。两组大鼠,每组6只进行情景记忆的检测,历时5 d。实验分为定位航行和空间探索阶段,在定位航行阶段,将固定平台放于SE象限正中,隐藏于被黑墨水染色的水下2 cm处,将大鼠依次从4个象限面壁放入水中,记录其找到平台的时间,记为逃避潜伏期。第5 天为探索阶段,将平台从水池中取出,并将大鼠从NW象限放入,记录其在60 s 内在平台所在象限探索的时间,以及穿过平台的次数。
1.2.6 Western blot
大鼠在进行rTMS治疗后立即行乙醚麻醉,并断头处死,取双侧M1区组织,RIPA中度裂解液中剪碎匀浆提取组织蛋白,经BCA 试剂盒蛋白定量后,加入DTT(7 μL/100 μL)和上样缓冲液,涡旋仪混匀后煮沸,冷却至室温,在-20 ℃冰箱中保存。SDS⁃PAGE 凝胶电泳后,转移到PVDF 膜上,之后封闭2 h。将膜取出,加入一抗,4°孵育过夜;TBST 洗膜10 min×3 次;将膜转入二抗孵育2 h;用化学发光法显色、曝光、显影定影。所得条带使用Image J 图像分析软件分析。
1.3 统计学方法
在统计分析中数据均以均数±标准误(standard error,SEM)来表示。M1 区LTP 样改变和空间情景记忆均用SPSS 22.0软件进行重复测量的方差分析,Mauchly 检验是否满足球形假设,有交互作用时分析各因素的单独效应,无交互作用时,分析各效应的主效应;运用Spearman 相关分析M1 皮层LTP 样改变和空间情景记忆之间的相关性,独立样本t检验分析干预后NR1、NR2A 及NR2B 的蛋白表达水平,P<0.05为差异有统计学意义。
2 结果
2.1 空间情景记忆
干预前control 组和rTMS 组空间情景记忆无统计学差异(P>0.05,图1A、D、G),4周rTMS干预后,统计分析发现定位航行阶段(0~4 d)每天的平均逃避潜伏期经重复测量的方差分析并未有交互效应(F=0.820,P>0.05),遂对各个时间点采用单因素方差分析。干预前后control 组和rTMS 组大鼠游泳速度的差异均不具有统计学意义(P>0.05,图1C)。在水迷宫的定位航行阶段(0~4 d)时,control 组和rTMS 组平均逃避潜伏期的差异不具有统计学意义(P>0.05,图1B)。在空间探索阶段(第5 天)时,与control 组相比,rTMS 组穿过平台的次数增加,且具有统计学意义(P<0.05,图1H),但探索的时间增加不明显(P>0.05,图1E),证明前额叶高频rTMS 可以改善健康大鼠的空间情景记忆。
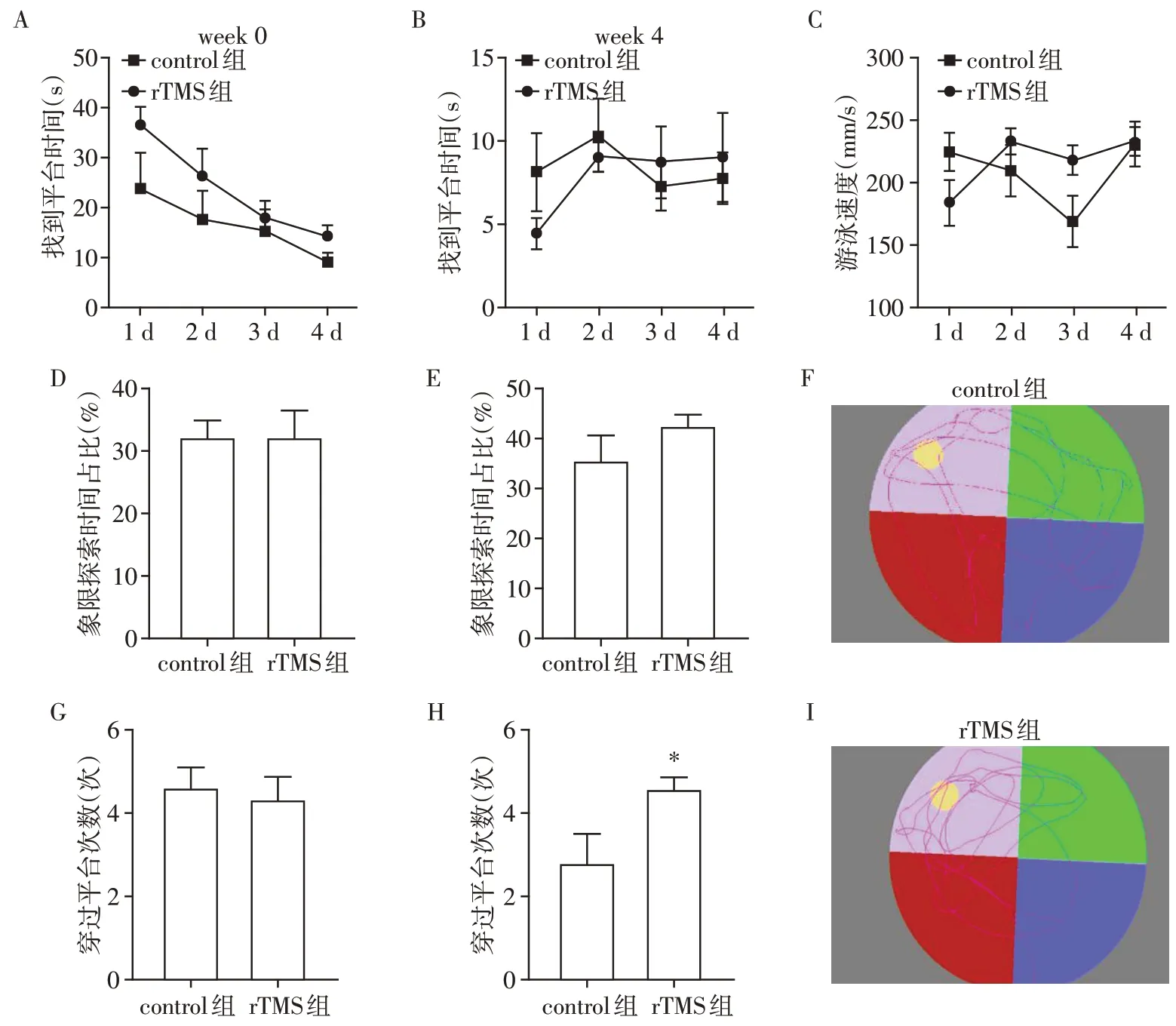
图1 水迷宫检测空间情景记忆Figure 1 Water mazes test spatial episodic memory
2.2 健康大鼠M1区LTP样改变
干预前control组和rTMS组的M1区LTP样改变无统计学差异(P>0.05,图2A);干预后,与control组相比rTMS 组M1 区LTP 样改变增强,且具有统计学意义(P<0.05,图2B)。
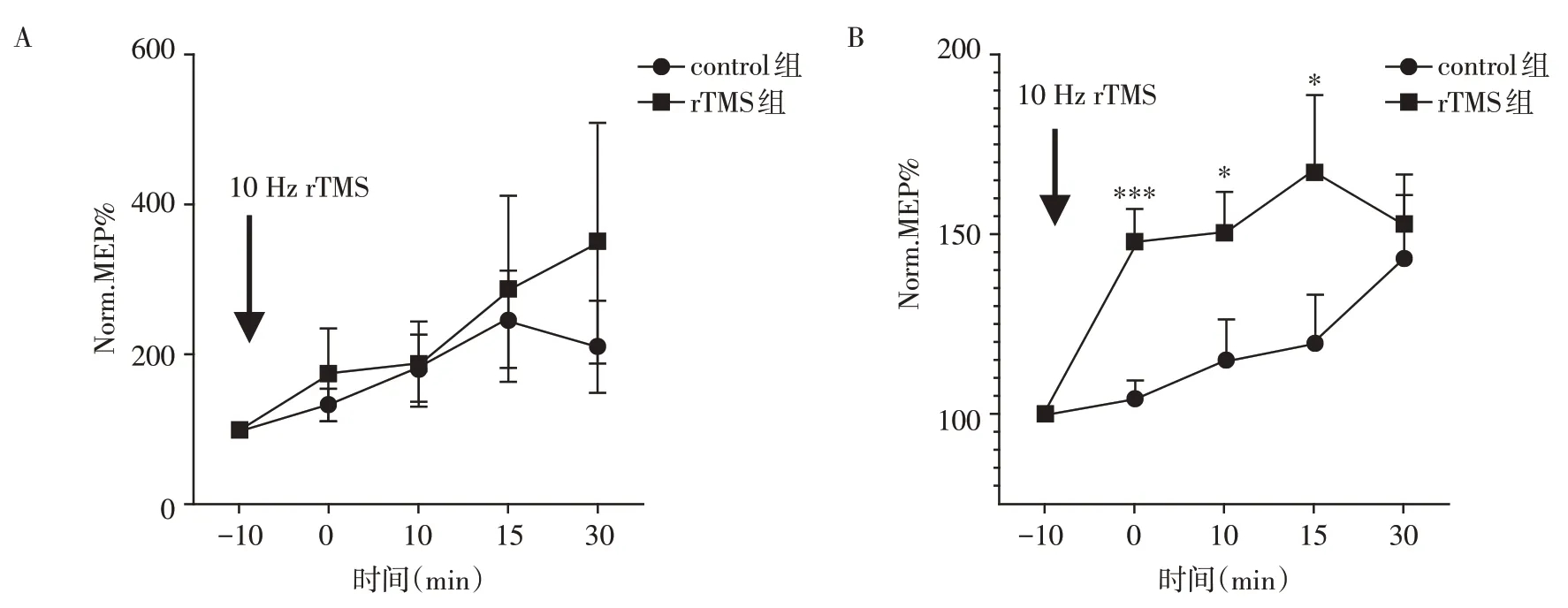
图2 M1区LTP样可塑性改变Figure 2 Changes in LTP⁃like plasticity in the M1 region
2.3 健康大鼠M1区LTP样改变与认知功能相关性分析
4 周rTMS 干预前、后M1 区0 min 的LTP 样改变与其空间情景记忆正相关,且具有统计学意义(P<0.05,图3A、B)。
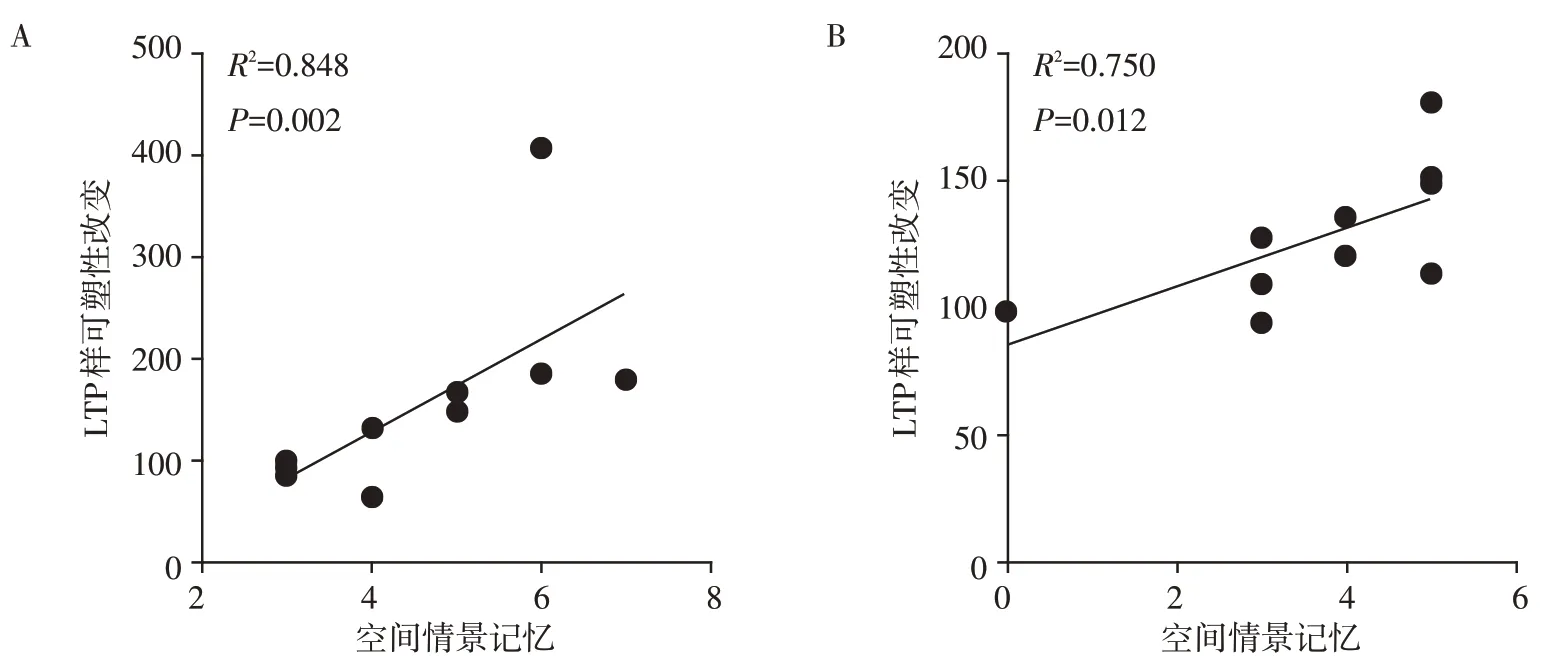
图3 空间情景记忆和M1区LTP样改变的相关性Figure 3 Correlation between spatial episodic memory and LTP⁃like changes in M1 region
2.4 M1区NR1、NR2A、NR2B蛋白的表达
4周高频rTMS干预后,与control组相比rTMS组M1 区NR1 和NR2A 蛋白表达上调(P<0.05、P<0.01,图4A、B),但是两组NR2B 的表达差异不具有统计学意义(P>0.05,图4A、B)。
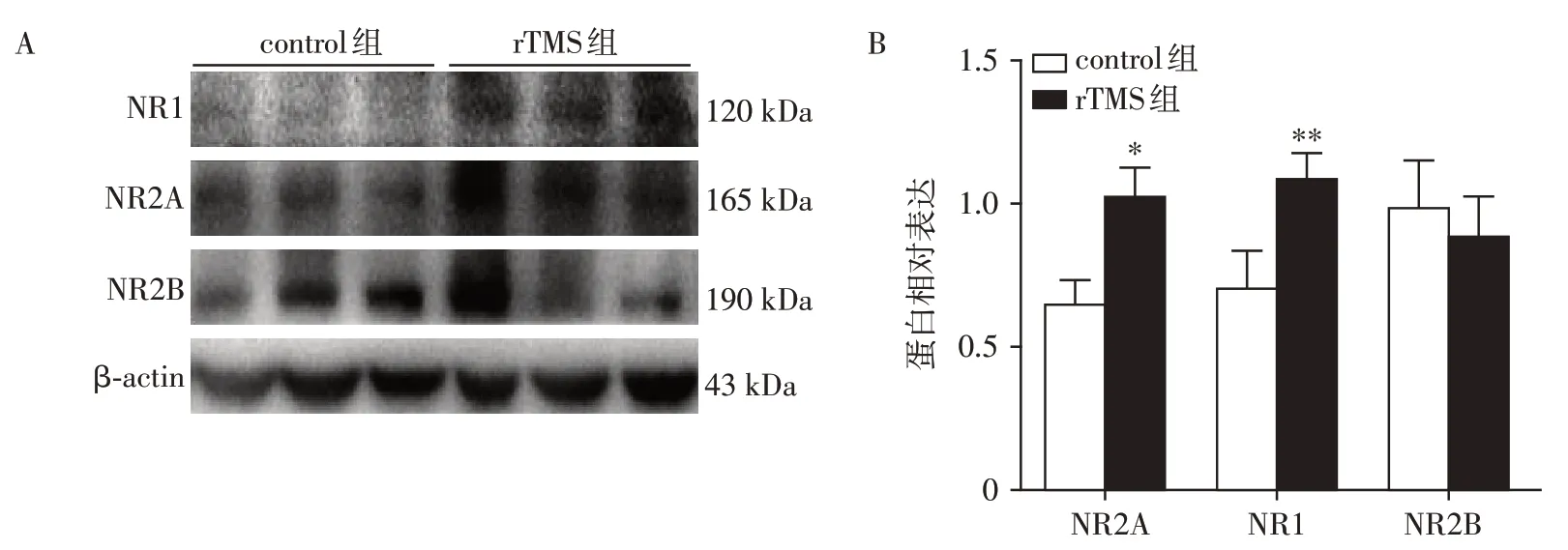
图4 Western blot检测M1区NR1、NR2A和NR2B蛋白表达改变Figure 4 Protein expression changes of NR1,NR2A and NR2B in M1 region
3 讨论
可塑性是根据外界刺激或一段时间的训练学习重建神经之间的信号连接,它是大脑实现自身重建的能力。神经系统可塑性的功能性改变,包括突触间分子水平的改变、突触膜上的改变、神经元水平的改变以及神经网络间信号传递过程改变四个水平[15-16]。LTP效应表示突触之间的连接强度增强,其与学习和记忆密切相关,而LTD则与LTP相反,与神经元死亡和突触之间的连接强度下降有关[16]。研究发现药物或基因修饰阻断LTP,会造成记忆和学习能力的严重缺陷,但通过一段时间的学习训练可以增强大脑LTP[16]。研究表明AD患者存在M1皮质LTP样可塑性损害,且认知功能和LTP样可塑性正相关,因此LTP样可塑性可以用于预测AD患者认知功能[14]。
皮质可塑性已经成为近年来非侵入性治疗认知功能障碍的重要靶点,已有研究发现作用于前额叶的高频rTMS 可以改善AD 患者的认知功能,且发现M1皮质可塑性改善和认知功能正相关[14]。功能核磁共振的研究发现,以背外侧前额叶为靶点的高频rTMS不仅可以激活背外侧前额叶,还可以激活包括海马区、下丘脑、小脑在内的其他脑区,产生远隔效应,改善认知功能[2-5]。本研究发现前额叶高频rTMS治疗4周后,健康大鼠空间情景记忆能力和M1区LTP样可塑性改善,且认知功能的改善和M1皮质可塑性正相关。同时本研究发现rTMS干预后M1区NMDAR 亚基NR1 和NR2A 表 达上调。NMDAR 依赖的LTP是大脑中LTP的主要模式,NMDAR表达上调介导LTP 效应的增强,NMDAR 是NMDAR 依赖LTP 效应的“开关”,其开放条件是突触后膜去极化的基础上结合谷氨酸以及D⁃丝氨酸或甘氨酸[2-5]。NMDAR 在突触后膜的表达上调是LTP 样可塑性增强的主要表现[17]。本研究发现前额叶高频rTMS 治疗4 周后M1 区NR1 和NR2A 的蛋白表达上调,从分子机制证明了高频rTMS 可以通过上调突触上NMDAR,改善皮质LTP 样可塑性。本研究结果在M1 区发现了皮质LTP 样可塑性的提高,支持高频rTMS 的作用并不仅仅局限于干预靶点所在的脑区,还可以通过脑网络连接产生远隔效应。考虑到NMDAR 2B主要分布在突触外,rTMS介导的LTP效应主要在突触水平,这可能本研究中rTMS干预后NMDAR 2B并未表达上调的原因。
动物实验证明,AD 可以导致大脑广泛性损害。研究发现4.0~4.5 月龄APP/PS1 小鼠出现M1区、内侧前额叶以及海马区LTP损害,并开始出现情景记忆的损害[18]。同时临床研究证明,AD 早期患者M1 区LTP 样可塑性受损,且独立于发病年龄,和认知受损密切相关[19]。另外,一项4 年的前瞻性研究发现,M1区LTP样可塑性可以预测轻度认知障碍患者认知下降的进程,即M1区LTP样可塑性较好的患者发展为AD的概率更小[20]。TMS结合肌电图评估M1 区可塑性目前已在临床广泛应用,本研究通过行为学和神经电生理评估发现健康大鼠干预后的认知功能与运动皮质LTP 样可塑性呈正相关,并从分子机制加以证明,为使用M1区皮质LTP样可塑性来评估认知功能提供了理论支撑。
然而本研究仍然存在局限性。首先,在进行M1区LTP 样可塑性检测时,使用了水合氯醛作为麻醉剂,麻醉状态会影响LTP样可塑性的检测,所以本研究为了保证均一性,两组大鼠均在深度麻醉状态后进行LTP 样可塑性的检测。第二,本研究采用的是直径为5.8 cm 的圆形线圈,而大鼠头部体积相对较小,使得本研究与相关的人类实验存在差异,但是目前并未有直径和大鼠头部体积匹配的动物线圈。第三,认知功能相关的脑区很多,因此对于认知功能的rTMS干预可能还存在其他有效靶点,而本研究未设立以其他脑区作为刺激靶点的对照,因此无法比较rTMS在不同脑区的作用差异。最后,本研究未从细胞水平检测M1区LTP样可塑性,未来将进行形态学分析,以提供更多维度的证据。
