高脂饮食影响小鼠空回肠上皮功能的差异性研究
2022-05-20丁国宪
金 燚,俞 静,夏 凡,丁国宪
南京医科大学第一附属医院老年医学科,江苏 南京 210029
随着社会经济的发展,高能量、高脂肪、低膳食纤维食物摄入显著增加,导致全球肥胖及2 型糖尿病、冠心病、脑卒中等并发症发病率逐年上升,带来了沉重的社会和经济负担。肥胖是由于长期能量摄入过多,超过能量消耗导致的。而几乎所有的能量摄入都发生在肠道[1]。目前关于高脂饮食(high fat diet,HFD)对肠道功能影响的研究,结果不完全一致[2-3]。
肠道是接触食物的重要器官,因此肠道功能紊乱是HFD 导致疾病发生的主要原因[4]。然而,许多研究忽略了肠道是由不同的区域组成,具有不同的解剖和生理功能特征。因肠道组织结构及肠道菌群分布的差异,不同肠段对营养物质的吸收也各不相同[5],空肠是营养吸收的主要区域,而回肠在免疫调节中起更重要的作用[6]。目前尚无关于HFD对不同部位小肠功能影响的研究。
本研究通过对小鼠空回肠上皮绒毛、隐窝形态、杯状细胞数量和功能、干细胞增殖分化能力的研究,初步探讨HFD 对不同部位小肠功能的影响,为空回肠在HFD 导致的肥胖及炎症中的不同作用和机制研究提供基础。
1 材料和方法
1.1 材料
雄性C57BL/6J 小鼠40 只,8 周龄(江苏集萃药康生物科技股份有限公司),SPF级环境,温度(23±1)℃。荧光定量PCR 仪ABI7000 StepOne⁃Plus(ABI公司,美国)。生长因子EFG、R⁃spondin 1、Noggin 和Wnt3a(Pepro Tech 公司,美国),3D 培养基质Matri⁃gel 356231(Corning公司,美国)。
1.2 方法
1.2.1 构建HFD小鼠模型
将小鼠随机分配到正常饮食组(normal chow diet,NCD,n=20)或HFD 组(n=20),分别喂养3 个月。HFD热卡来源组成:60%由脂肪提供,20%由碳水化合物提供,20%由蛋白质提供。小鼠自由饮水,每周测量体重,记录摄食情况。
1.2.2 小肠上皮组织分离
脱颈法处死小鼠后取出整个肠道(小肠:从幽门至回盲部连接;十二指肠:距幽门5 cm;空肠:中间段小肠的中间部10 cm,回肠:靠近回盲肠部的10 cm)。
1.2.3 石蜡切片及HE染色
4%甲醛固定24 h,修剪组织后脱水,依次进行75%酒精4 h→85%酒精2 h→90%酒精1 h→无水乙醇Ⅰ30 min→无水乙醇Ⅱ30 min→醇苯5~10 min→二甲苯Ⅰ5~10 min→二甲苯Ⅱ5~10 min→蜡Ⅰ1 h→蜡Ⅱ1 h→蜡Ⅲ1 h。常规包埋。将包埋好的蜡块置于切片机上切片,4℃冰箱保存。取石蜡切片,常规脱蜡,苏木素染液3~5 min,然后伊红染液中染色5 min。常规脱水后用中性树胶封片。每组于光学显微镜下随机选取3个HE染色的区域进行观察。
1.2.4 过碘酸希夫(periodic acid⁃Schiff,PAS)糖原染色
取小鼠小肠组织石蜡切片,常规包埋、复水。样品滴加1%阿利新蓝染液(pH 2.5),室温放置10~20 min,冲洗1次,再用蒸馏水浸洗2次。滴加高碘酸溶液,室温放置10 min。再次冲洗1次,再用蒸馏水浸洗2 次。滴加Schiff 试剂,室温放置10~15 min。纯水冲洗。逐级常规乙醇脱水后中性树胶封固。每组于光学显微镜下随机选取3个PAS 染色的组织隐窝区域进行观察。
1.2.5 实时荧光定量PCR
取小鼠小肠组织,提取组织RNA,并测定RNA的含量和纯度。将RNA逆转成cDNA 为模板,用相关引物进行RT⁃PCR 扩增。实时定量PCR(ABI7000,StepOne⁃Plus,美国)。总反应体系为10 μL,反应条件:95 ℃预变性5 min;94 ℃变性15 s,60 ℃退火延伸15 s,40 个循环;72~94 ℃,每升高0.5 ℃读1 次制备熔解曲线。以actin 基因作为内参,引物序列详见表1。

表1 PCR 引物序列Table 1 PCR primer seguences
1.2.6 小肠上皮分离隐窝及3D类器官培养
小鼠处死后冰上分离出10 cm肠管并纵行切开,将小肠腔面的黏液及绒毛完整刮除后,用含100 U/mL青霉素,10 mg/mL链霉素的DPBS清洗4~5次直至上清液澄清。将处理过的小肠组织放入2 mmol/L EDTA消化液中,4 ℃摇床孵育直至充分螯合(60 min),用5 mL 移液枪用力吹打,直至50%~80%的隐窝单位从固有层脱落,收集富集隐窝的吹打液,70 μm过滤,4 ℃300g离心5 min,获得隐窝沉淀。将隐窝沉淀与液体状态的基质胶Matrigel按1∶2混合,将含有隐窝单位的Matrigel 滴在24 孔培养板的孔中心,形成半球状,聚合成固态的3D立体结构。加入现配的完全培养液DMEM/F12(Gibco 公司,美国)、N2 Sup⁃plement(Life Technologies 公司,美国)、B27 Supple⁃ment(Life Technologies公司,美国)、GlutaMAX(Gibco公司,美国)、1 μmol/L N⁃乙酰半胱氨酸(Sigma⁃Al⁃drich公司,美国)、100 U/mL青霉素、100 μg/mL 链霉素(Gibco 公司,美国)、50 ng/mL EGF、1 μg/mL R⁃spondin1和100 ng/mL Noggin[7]。置于5%CO2,37 ℃细胞孵育箱培养,每天观察,每48 h更换1次培养液。
1.3 统计学方法
用GraphPad Prism 8 统计软件进行分析,数据以均数±标准差()表示,采用t检验进行两组比较。P<0.05为差异有统计学意义。
2 结果
2.1 HFD导致小鼠体重显著增加
为了明确HFD 诱导的肥胖小鼠模型是否构建成功,对小鼠每周进行称重,结果显示随着HFD 时间的增加,小鼠体重明显增加,与正常饮食组有明显统计学差异(图1)。

图1 小鼠体重Figure 1 Weight of mice
2.2 HFD影响小鼠空回肠绒毛、隐窝形态
为了研究HFD是否改变小肠上皮形态,对小鼠空回肠上皮组织进行HE染色,发现与NCD组相比,HFD组小鼠尽管空回肠的绒毛长度没有明显改变,但空回肠的隐窝深度均明显变浅(P<0.001,图2)。与NCD组相比,HFD组小鼠的空肠回肠单位面积内杯状细胞数量无明显变化(图3)。上述结果表明HFD影响了小肠上皮形态。

图2 小肠上皮组织HE染色Figure 2 HE staining images of small intestinal epithelium
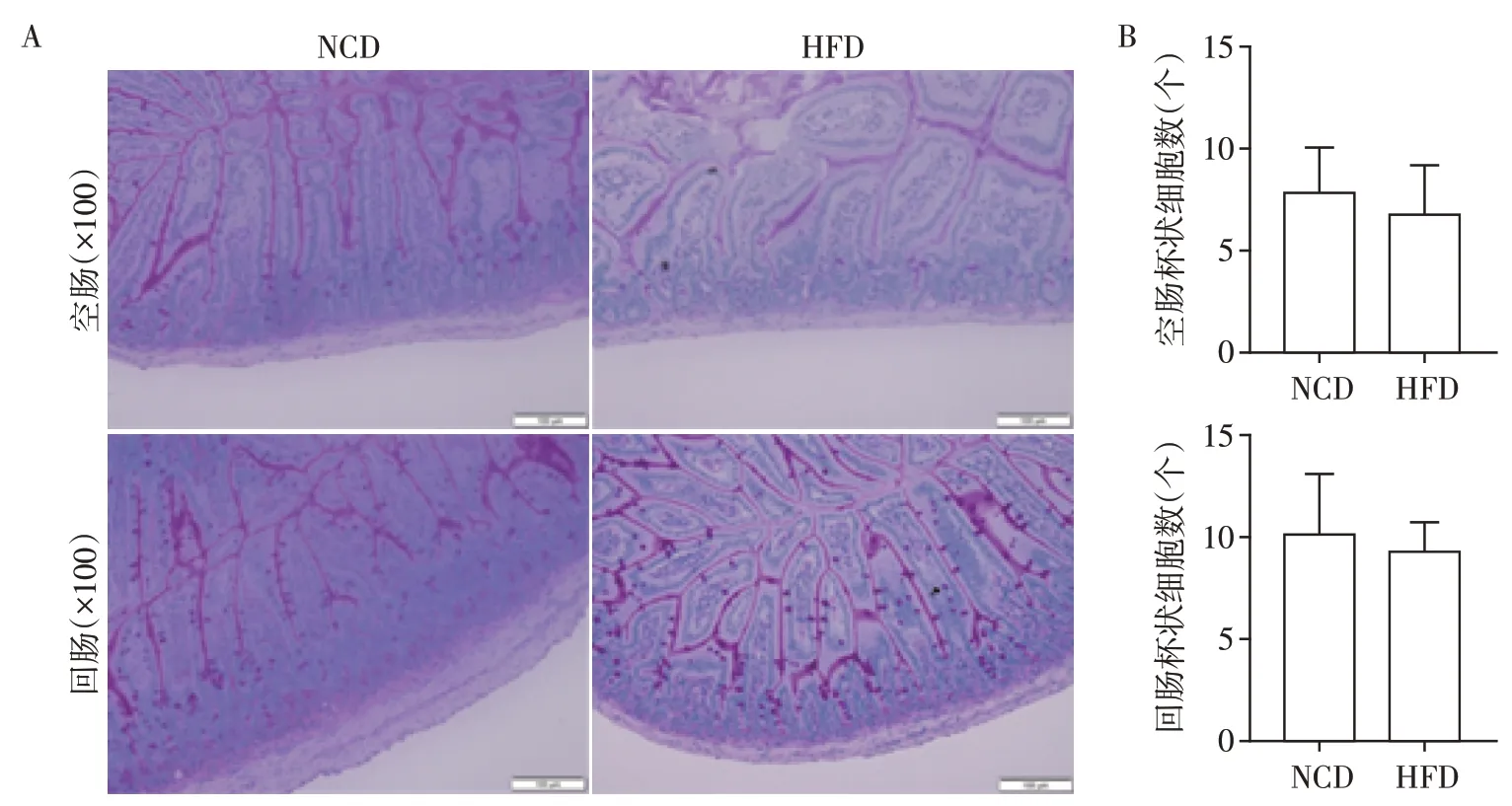
图3 小肠杯状细胞PAS染色Figure 3 PAS staining images of goblet cells
2.3 HFD影响小鼠空回肠干细胞的增殖分化能力
肠道上皮隐窝底部含有活跃的肠道干细胞,是肠道上皮在成体哺乳动物各器官中更新最快的基础[8]。为探究HFD对小鼠空回肠上皮干细胞增殖分化能力的影响,利用3D类器官原代培养技术进行了体外研究(图4A)。结果显示,与NCD 组比较,培养3 d后HFD组小鼠空肠形成类器官的类隐窝区域数目减少(P<0.05,图4B),而回肠形成类器官的类隐窝区域数目有增高趋势(图5B)。培养5 d 后,HFD组小鼠空肠形成类器官的类隐窝区域数目仍减少(图4C),而回肠形成类器官的类隐窝区域数目明显增加(P<0.05,图5C)。以上结果表明HFD对不同区域小肠上皮干细胞增殖分化能力的影响不同。
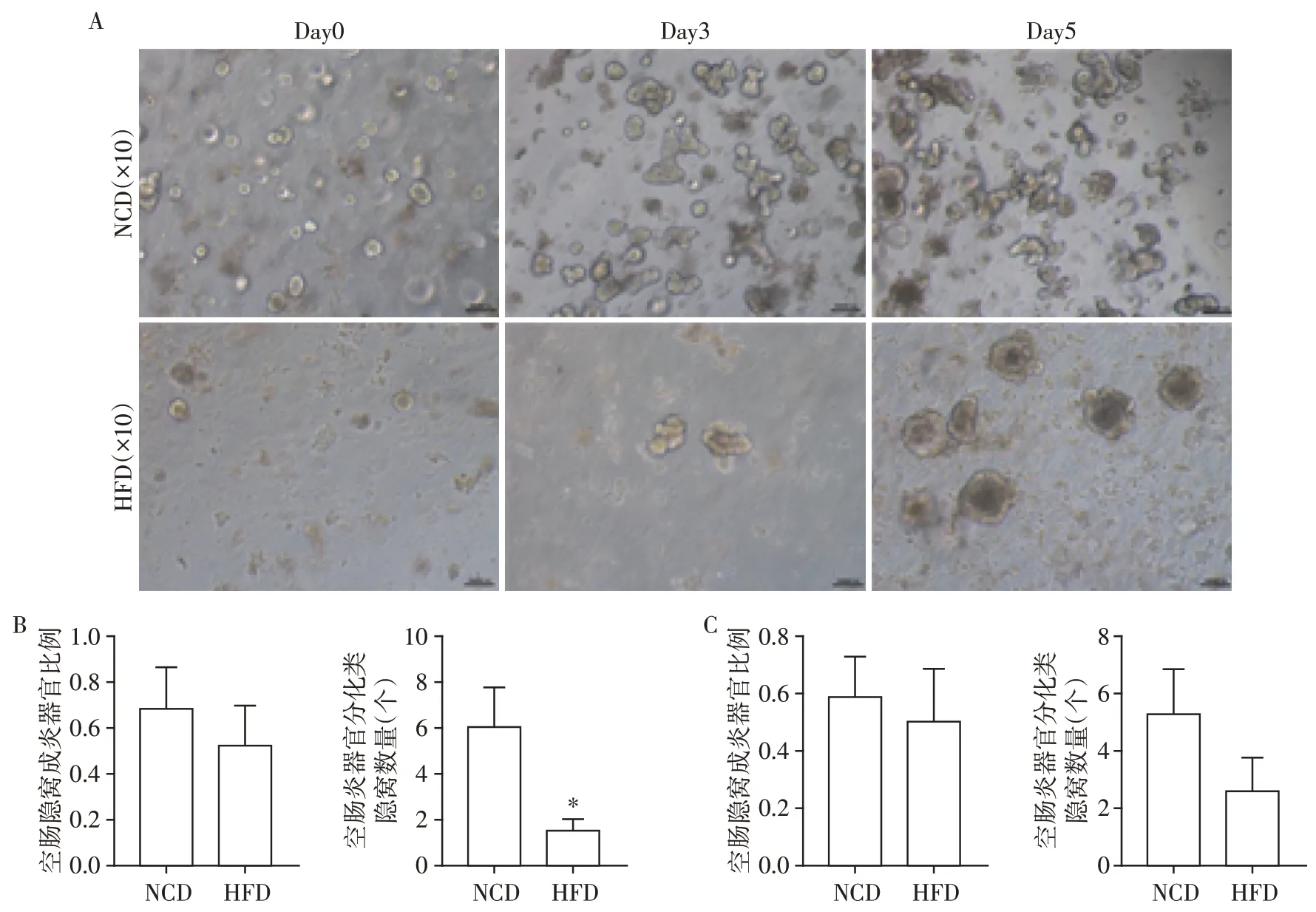
图4 空肠3D类器官培养及形态分析Figure 4 3D organiod culture and morphological analysis of jejunum organoids
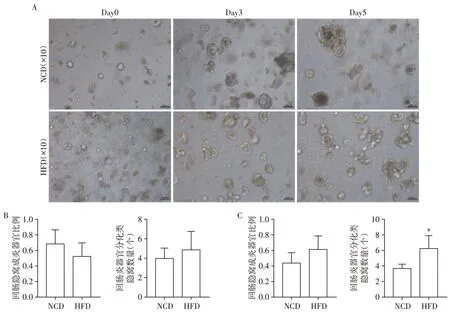
图5 回肠3D类器官培养及形态分析Figure 5 3D organoid culture and morphological analysis of ileum organoids
2.4 HFD导致小鼠空回肠上皮凋亡基因表达改变
DNA 损伤或细胞应激诱导P53 的表达,并导致细胞周期停滞、凋亡[9]。为明确HFD 对空回肠上皮细胞凋亡的作用,利用荧光定量PCR检测相关基因表达。结果发现,HFD 组小鼠空肠细胞凋亡基因P53 的表达较NCD 组显著下降(P<0.001,图6A),而回肠细胞凋亡基因P53的表达较对照组无明显差异。回肠细胞凋亡基因Bbc3、H2afx的表达较对照组显著下降(P<0.001、P<0.01,图6B),而空肠凋亡基因Bbc3、H2afx的表达较对照组无明显差异(图6A),表明HFD导致小肠上皮细胞凋亡改变。
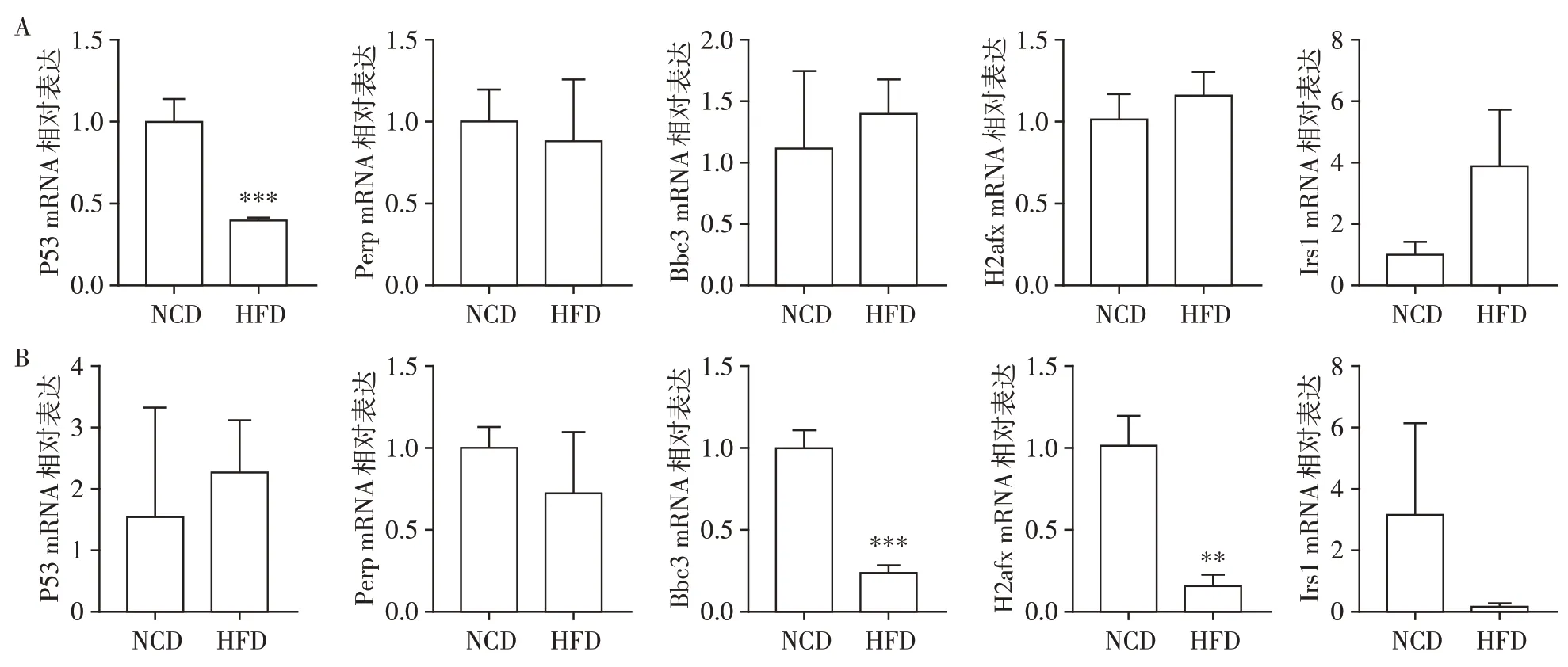
图6 小鼠空回肠凋亡基因表达Figure 6 Apoptosis gene expression in jejunum and ileum of mice
3 讨论
目前,HFD对小肠形态和功能影响的研究结果不完全一致。Beyaz等[3]发现,HFD喂养的小鼠小肠绒毛长度减少,隐窝深度增加,干细胞的数量增加、自我更新能力增强。也有研究发现,在HFD喂养的Sox9⁃EGFP小鼠空肠绒毛长度增加而隐窝深度无明显变化,杯状细胞数量减少,致使位于肠上皮表面的黏液层变薄,进而使肠道屏障保护功能下降[2]。这些不一致的研究结果可能与小鼠的品系、年龄、HFD喂养时间、含量等不同有关。
不仅如此,众所周知,小肠的不同区域具有不同的生理功能。十二指肠和空肠中的绒毛长,大部分食物的消化吸收多发生于此。而回肠绒毛较短,除了吸收胆汁盐和维生素B12 外,较少参与其他营养物质吸收[10]。与空肠相比,回肠上皮的特征是存在Peyer 斑块,含有大量淋巴细胞和其他免疫细胞的淋巴滤泡,因此在免疫学上非常活跃[6]。在本研究中发现,HFD 组空回肠的隐窝深度均明显变浅。同时,HFD 组小鼠空肠干细胞培养3 d 后分化能力下降,凋亡相关基因P53的表达显著下降,而回肠干细胞培养5 d后分化能力增加,凋亡相关基因Bbc3、H2afx表达显著下降。证实HFD不仅导致小肠对营养物质吸收代偿性减少,对空回肠干细胞增殖能力也存在差异。
小肠是人体中固定细胞更新率最快的部位之一,小肠上皮细胞不断脱落更新,并且由隐窝底部的增殖层引导[11]。而小肠上皮细胞的更新是由小肠上皮细胞凋亡,小肠干细胞的增殖和分化共同调节的。小肠干细胞的数量和功能对于小肠健康起着至关重要的作用[12]。在3D培养系统中,小肠干细胞发育成由多个细胞组成的类器官球形结构,反映了小肠干细胞的存活和增殖。并且,随着培养时间的增加,类器官生长并形成更复杂的结构,显示出腔及类隐窝,包含干细胞和所有分化的肠上皮细胞[13]。因此,类器官是评价小肠干细胞增殖和分化能力的标准。本实验通过空回肠类器官的分别培养,对不同区域小肠干细胞增殖分化能力的差异进行了研究。
已有研究表明,HFD可影响小肠干细胞微环境,导致小肠干细胞和部分祖细胞的功能发生改变[14]。小肠干细胞位于小肠隐窝基底部,隐窝深度可反映小肠干细胞活性和功能,同时小肠干细胞受隐窝及其周边细胞组成的生态位的多种信号调控[15-16]。本研究发现,虽然HFD使小鼠空回肠的隐窝深度均明显变浅,但在体外类器官培养中空回肠干细胞增殖能力无明显变化,空肠干细胞分化能力下降,而回肠干细胞分化能力增加。这种体内外研究结果的不一致,可能是小肠干细胞功能在体内时还受到周边细胞组成的生态位影响。而类器官由多种不同细胞组成,并模拟体内上皮的再生过程,更可以产生黏液,具有吸收和分泌的功能[17]。因此,相比于隐窝深度,类器官更能评估小肠干细胞的功能。饮食与肠道微生物的相互作用是通过肠道上皮实现的。本研究阐明HFD 对不同部位小肠功能的影响存在差异,为具体机制的研究提供警示,同时对后期定点监测、靶向干预饮食诱导的小肠功能改变提供理论基础。
