游离脂肪酸通过IRE1/XBP1 通路调控高甘油三酯血症性急性胰腺炎肾损伤的机制研究
2022-05-20彭云鹏朱小乐侯超群
郁 蓉,彭云鹏,朱小乐,侯超群,苗 毅,李 强
南京医科大学第一附属医院胰腺中心,江苏 南京 210029
重症急性胰腺炎(severe acute pancreatitis,SAP)是胰腺的一种具有高发病率和高死亡率的急性炎症性疾病,通常伴有全身炎症反应综合征,甚至多器官功能障碍综合征[1-2]。据报道,在过去十年里,高甘油三酯血症成为仅次于胆结石和酒精的急性胰腺炎(acute pancreatitis,AP)第三大病因,且高甘油三酯血症性急性胰腺炎(hypertriglyceridemic pancreati⁃tis,HTGP)在急性胰腺炎中的发病率增至25.6%[3]。HTGP 患者更容易发生胰腺外器官损伤,最常见的是急性肺损伤,其次是肾损伤[4]。急性肾损伤不仅会加重胰腺炎的病情,还会发展为急性肾功能衰竭,增加患者的病死率[5]。然而,目前HTGP 相关肾损伤的具体机制尚不清楚。
HTGP 导致肾损伤的机制很复杂,但已有研究发现肾小管上皮细胞凋亡坏死、炎症、内质网的功能紊乱等在急性肾损伤发病机制中起重要作用[6]。内质网是一种特殊的细胞器,负责分泌蛋白和膜蛋白的合成、包装和组装。内质网的有效功能对细胞功能和生存至关重要。一些干扰内质网功能的刺激会破坏内质网内环境稳定,随后内质中未折叠或错误折叠的蛋白质出现异常蓄积,从而导致内质网应激,内质网应激反过来会激活未折叠蛋白反应和细胞凋亡[7-8]。肌醇需要酶1(inositol⁃requiring en⁃zyme⁃1,IRE1)/X 盒结合蛋白1(X⁃box binding pro⁃tein 1,XBP1)通路是激活未折叠蛋白反应的通路之一。IRE1是最保守的内质网应激传感器,是调节细胞功能障碍的关键分子。XBP1是IRE1α RNA酶活性靶向的RNAs 之一,活化IRE1α切割XBP1 mRNA产生转录活性形式(XBP1s),有助于恢复蛋白质稳态并促进细胞保护[9-10]。
长期摄入高脂饮食可引起外源性脂肪吸收增加,导致高脂血症,血清甘油三酯、游离脂肪酸水平升高[11]。急性胰腺炎时,在多种炎症介质的作用下,患者机体大多处于全身炎症反应的高代谢状态,热量与蛋白质供给不足,垂体肾上腺轴功能改变,胰岛素分泌减少,胰高血糖素升高导致糖利用率下降,此时脂肪代谢轻度亢进,且由胰腺自身消化后产生少量游离脂肪酸进入血液,从而导致游离脂肪酸的升高[12]。另外,胰腺外分泌腺泡细胞中富含脂肪酶,可水解甘油三酯生成游离脂肪酸和甘油。高浓度的游离脂肪酸具有脂肪毒性,既引起炎症反应,又对胰腺腺泡和血管内皮细胞造成损伤[13]。同时,游离脂肪酸水平升高还可触发氧化应激和内质网应激[14-15]。CD36,又称游离脂肪酸转运蛋白,是一种单链跨膜表面糖蛋白,属于B 类清道夫受体家族[16-17]。CD36在肾脏内的各种细胞类型中表达,包括近端肾小管上皮细胞、足细胞和系膜细胞[17]。CD36作为一个多功能受体,与长链游离脂肪酸配体结合后可介导脂质摄取、细胞凋亡[18]。因此猜测CD36 介导游离脂肪酸摄取诱发的内质网应激可能是HTGP相关肾损伤的重要发病机制。
本实验通过建立动物模型,运用组织形态学、免疫荧光等技术检测重要的内质网应激相关因子的表达,进一步探讨高甘油三酯血症性急性胰腺炎中游离脂肪酸如何调控内质网应激而加重肾损伤。
1 材料和方法
1.1 材料
SPF 级别雄性C57BL/6 小鼠48 只,3~4 周龄、体重20~25 g,由南京医科大学实验动物中心提供。所有动物实验按照南京医科大学动物伦理和福利委员会的指导方针进行的(批准编号为IACUC⁃1902019)。高脂对照饲料(10%kcal 脂肪热量)、高脂饲料(60%kcal脂肪热量)(Research Diets 公司,美国)。雨蛙素和脂多糖(Sigma⁃Aldrich 公司,美国)。磺基⁃N⁃琥珀酰亚胺基油酸酯(sulfo⁃N⁃succinimidyl oleate,SSO)(MedChemExpress 公司,美国)。IRE1抗体、XBP1 抗体和DAPI(Abcam 公司,英国);CD36抗体(Proteintech 公司,美国);全自动生化分析仪(Olympus 公司,日本);ELISA 试剂盒(南京建成公司);光学显微镜(Nikon 公司,日本);石蜡切片机(Leica公司,德国)。
1.2 方法
1.2.1 小鼠分组及处理
在实验之前所有小鼠均接受适应性饲养1 周,按照实验中心SPF 级别饲养条件饲养。48 只小鼠随机分为对照组(CON组)、SAP组、HTGP组和CD36抑制剂组(SSO组),每组12只。CON组和SAP组小鼠均予高脂对照饲料(10%kcal 脂肪热量)喂养,而HTGP 组和SSO 组予高脂饲料(60%kcal 脂肪热量)喂养。喂养8 周后开始造模,模型建立前小鼠禁食12 h,但可自由饮水。将配制好的雨蛙素和脂多糖稀释复温,以待腹腔注射。SAP 组小鼠腹腔注射雨蛙素(50 μg/kg),每小时1次,共7次,并在最后一次注射雨蛙素1 h后追加腹腔注射一次脂多糖(10 mg/kg)。CON 组用等量生理盐水代替雨蛙素和脂多糖。HTGP组、SSO组的雨蛙素和脂多糖的注射剂量和方法同SAP 组,SSO 组在最后一次追加注射脂多糖后予溶于1%DMSO 的CD36 特异性抑制剂SSO,以50 mg/kg的剂量单次灌胃给药。造模成功后,在第一次注射雨蛙素24 h后,对所有小鼠实施安乐死,获得血样本、胰腺组织、肾组织以进一步分析。
1.2.2 血清学检测
所有血样本室温静置30 min 后在离心机上以3 000 r/min离心10 min,收集上清并-80 ℃保存。血清游离脂肪酸、甘油三酯、淀粉酶采用全自动生化分析仪进行测定。血清肿瘤坏死因子⁃α(TNF⁃α)、白细胞介素⁃6(IL⁃6)和白细胞介素⁃1β(IL⁃1β)水平根据制造商的方案使用酶联免疫吸附试验(ELISA)试剂盒进行定量。
1.2.3 组织病理学分析
将石蜡包埋的胰腺和肾脏标本切成4 μm 厚的切片,并进行HE 染色。所有组织切片均由两名对实验不知情的病理学家在400倍放大的光学显微镜下观察,根据之前制定的评分标准对胰腺和肾组织的病理学变化进行评估[19-20]。
1.2.4 免疫荧光检测CD36、IRE1和XBP1的表达
肾标本石蜡切片脱蜡、水合、抗原修复后冷却至室温。用PBS稀释的3%BSA阻断30 min,然后与一抗4 ℃孵育过夜,PBS冲洗3次后与相应荧光素偶联的二抗孵育。核用DAPI 复染,封片。在荧光显微镜下观察并采集图像,然后通过Image Pro Plus 6.0软件进行分析。
1.3 统计学分析
2 结果
2.1 各组小鼠血清甘油三酯和游离脂肪酸水平
四组小鼠的血清甘油三酯和游离脂肪酸水平测量结果如表1 所示,予高脂饲料喂养的HTGP 组和SSO组小鼠的血清甘油三酯含量相较于高脂对照饲料喂养的CON 组和SAP 组小鼠明显增高。这表明高甘油三酯血症小鼠模型的成功构建。与CON组相比,SAP 组有较高的游离脂肪酸水平,而HTGP组血清游离脂肪酸水平含量更高。但使用CD36抑制剂SSO 的HTGP 小鼠,其血清甘油三酯和游离脂肪酸水平与HTGP组没有显著差异(P>0.05)。

表1 血清甘油三酯和游离脂肪酸水平Table 1 Serum levels of triglyceride and free fatty acids
2.2 高甘油三酯血症加重SAP小鼠的胰腺、肾损伤及全身炎症反应
CON 组、SAP 组和HTGP 组小鼠胰腺组织病理学变化如图1A所示,SAP组小鼠胰腺可见组织结构破坏、炎性细胞浸润、出血和腺泡细胞坏死,而CON组胰腺组织病理大体正常。与SAP 组相比,HTGP组结构损伤更明显,更多炎性细胞浸润伴坏死、出血增加。根据Schmidt评分标准,SAP组的组织学评分也显著高于CON组,而与SAP组比,HTGP组评分更高。血清淀粉酶是急性胰腺炎诊断的重要生化指标,也是衡量造模是否成功的标志之一。与CON组比,SAP 组和HTGP 组的血清淀粉酶水平显著升高,而SAP 组和HTGP 组的血清淀粉酶没有显著差异(图1B)。血清炎症因子IL⁃1β、IL⁃6、TNF⁃α水平是急性胰腺炎严重程度的衡量指标,也是全身炎症反应的标志物。如图1C 所示,相比SAP 组,HTGP组小鼠血清IL⁃1β、IL⁃6、TNF⁃α水平明显增高,差异有统计学意义。上述结果表明SAP及HTGP小鼠模型的成功构建,且高甘油三酯血症可加重SAP 导致的胰腺损伤甚至全身炎症反应。肾损伤是发生SAP 时常见的胰外并发症之一,其发生率仅次于肺损伤[4]。比较3 组小鼠模型的肾组织病理改变,图1D 显示与CON 组相比,SAP 组肾小管上皮细胞肿胀、刷状缘缺失、间质水肿、细胞质空泡化、细胞坏死和肾小管腔内出现坏死细胞碎片,而HTGP组的肾损伤严重程度和肾组织学评分明显高于SAP 组。因此,高甘油三酯血症可加重胰腺炎相关肾损伤。
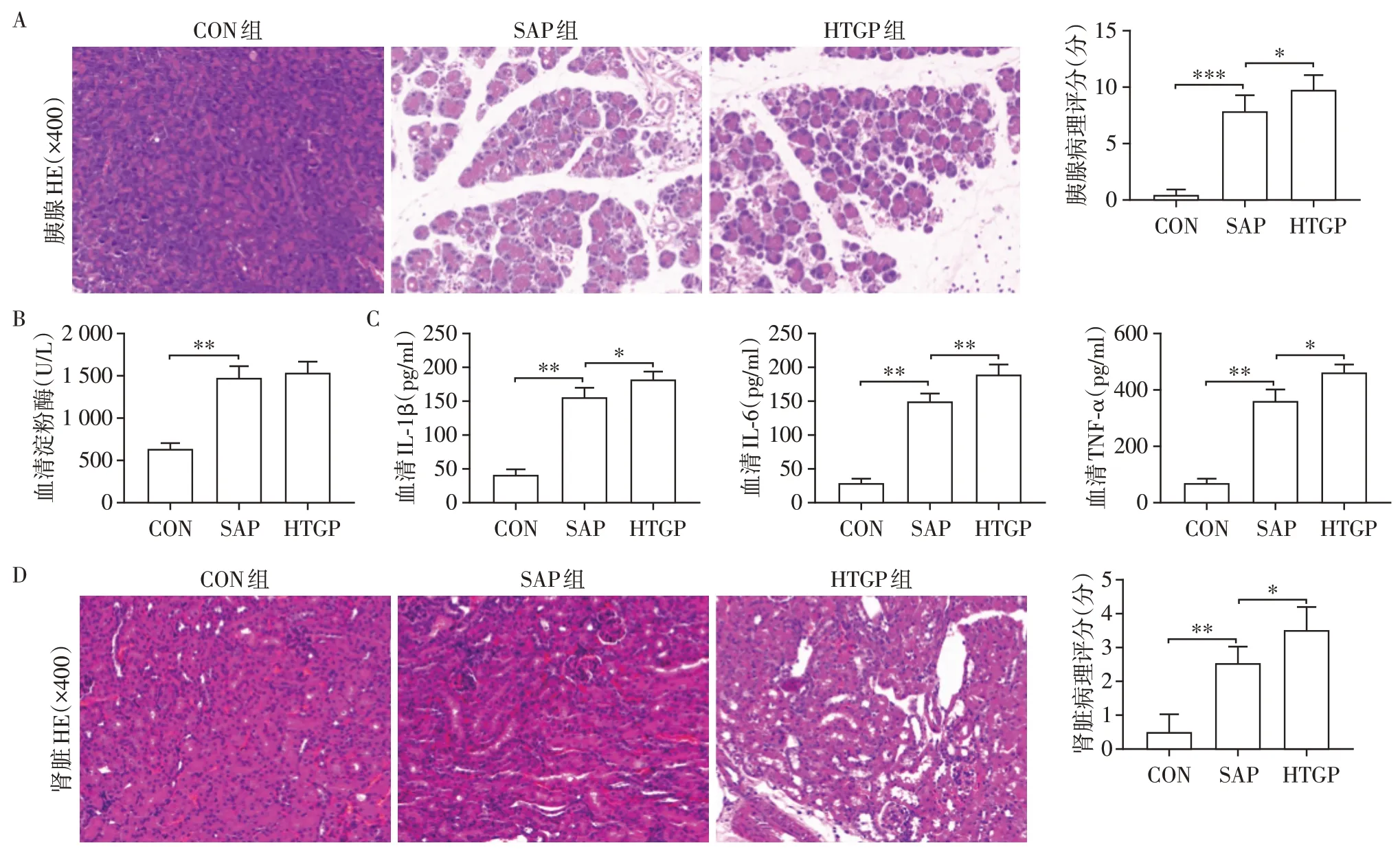
图1 高甘油三酯血症对SAP小鼠胰腺、肾损伤、血清淀粉酶水平及炎症因子的影响Figure 1 Effects of hypertriglyceridemia on pancreatic and renal injuly,serum amylase and inflammatory factors in SAP mice
2.3 高甘油三酯血症促进重症急性胰腺炎小鼠肾组织中IRE1及XBP1表达
游离脂肪酸被广泛认为是HTGP的发病机制之一,存在于胰腺腺泡细胞中的脂肪酶可将甘油三酯水解成游离脂肪酸和甘油[13]。游离脂肪酸是评价脂代谢紊乱的重要指标,是启动内质网应激的重要因素[21-22]。IRE1、XBP1是内质网应激的相关通路蛋白,采用免疫荧光染色评估IRE1 和XBP1 在肾组织中的表达水平。如图2 所示,CON 组的IRE1 和XBP1蛋白未见明显表达,SAP组和HTGP组的IRE1和XBP1 表达水平都显著升高,但SAP 组和HTGP组这两组间相比,HTGP 组肾组织中IRE1 和XBP1表达水平进一步升高。由此可知,高甘油三酯血症增加了重症急性胰腺炎小鼠肾组织中的内质网应激。
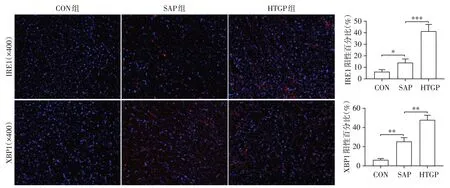
图2 CON组、SAP组和HTGP组肾组织中IRE1、XBP1的免疫荧光染色及阳性百分比Figure 2 Immunofluorescence staining and positive percentage of IRE1 and XBP1 in renal tissue of CON group,SAP group and HTGP group
2.4 CD36 介导的游离脂肪酸可能通过激活IRE1/XBP1通路加重HTGP肾损伤
CD36是代谢组织中脂肪酸摄取的主要参与者,CD36 介导的内吞作用可将脂肪酸转运到细胞[23]。免疫荧光染色法检测肾小管细胞上CD36的表达水平。结果如图3 所示,CON 组中几乎没有阳性表达的CD36,SAP 组和HTGP 组CD36 阳性表达明显,且相比SAP组,HTGP组的CD36阳性率更高。
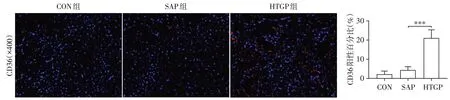
图3 CON组、SAP组和HTGP组肾组织中CD36的免疫荧光染色及阳性百分比Figure 3 Immunofluorescence staining and positive percentage of CD36 in renal tissue of CON group,SAP group and HTGP group
为了进一步探索是否是CD36介导的游离脂肪酸激活内质网应激加重HTGP 肾损伤,在HTGP 模型上利用CD36 特异性抑制剂SSO 验证。根据组织病理学改变、淀粉酶及炎症因子水平评估小鼠模型的建立以及SSO对HTGP小鼠肾损伤的影响。如图4A⁃C 所示,虽然两组血清淀粉酶水平没有显著差异,但使用CD36抑制剂SSO后HTGP小鼠胰腺病理损伤减轻,血清中炎症因子IL⁃1β、IL⁃6 和TNF⁃α水平显著降低。此外,SSO 组的肾损伤严重程度也明显减轻(图4D)。比较HTGP 组和SSO 组IRE1 及XBP1的表达水平。结果发现,使用了SSO的HTGP小鼠肾组织中IRE1、XBP1 的表达水平较未使用SSO 的HTGP 小鼠显著降低(图5)。结合以上结果,发现CD36介导游离脂肪酸的摄取可能激活了内质网应激IRE1/XBP1通路,从而加重HTGP相关肾损伤。
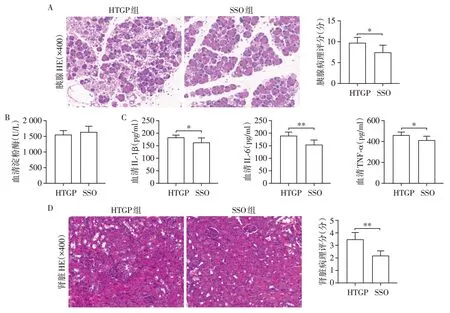
图4 CD36抑制剂SSO对HTGP小鼠胰腺、肾损伤、血清淀粉酶水平及炎症因子的影响Figure 4 Effects of CD36 inhibitor SSO on pancreatic and renal injuly,serum amylase and inflammatory fators in HTGP mice
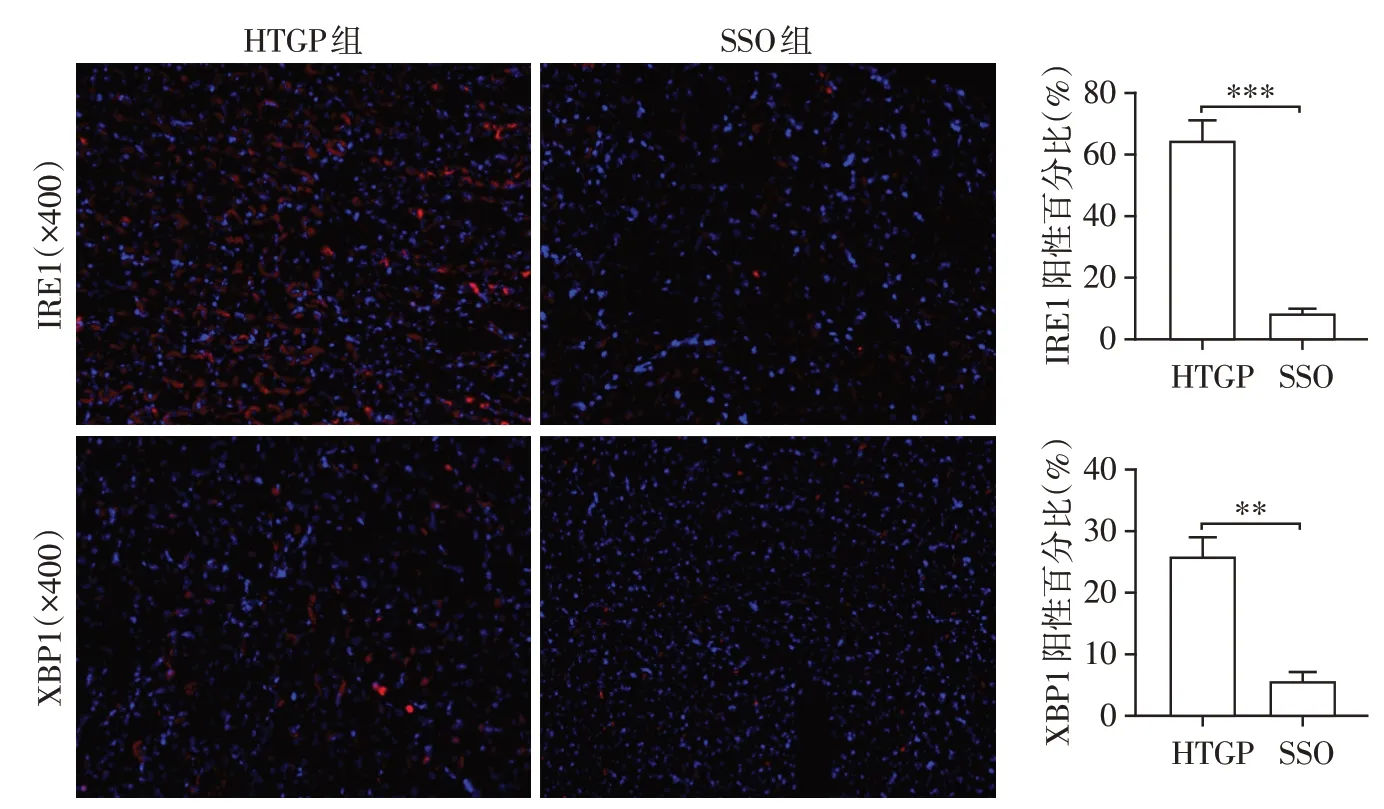
图5 HTGP组和SSO组肾组织中IRE1和XBP1的免疫荧光染色及阳性百分比Figure 5 Immunofluorescence staining and positive percentage of IRE1 and XBP1 in renal tissue of HTGP group and SSO group
3 讨论
SAP 是一种致命性的急腹症,常伴有多器官衰竭,且死亡率较高。当SAP 合并肾功能衰竭时,患者死亡率上升到75%[24]。既往研究表明,HTGP 患者早期更容易出现胰腺外器官损伤,其中肾损伤的发生率约为40%,仅次于肺损伤[25]。然而,对于HT⁃GP 相关的肾损伤却很少被阐述。因此本研究是建立在HTGP 的模型上对肾损伤的机制进行探索,为这一并发症的治疗提供潜在靶点和预防策略。
在当前研究中,首先在高脂饲料喂养后联合应用雨蛙素和脂多糖建立HTGP小鼠模型并诱导肾损伤。本研究发现SAP 组和HTGP 组的血清甘油三酯、淀粉酶水平显著增加,胰腺损伤加重,表明成功诱导了HTGP 模型。与SAP 组相比,HTGP 组血清TNF⁃α、IL⁃1β和IL⁃6水平显著增加表明高甘油三酯血症加重了SAP 的全身炎症反应。此外,HTGP 组的肾组织病理学改变也提示HTGP小鼠肾损伤更严重。游离脂肪酸的积聚被认为是引发HTGP发病机制的关键因素之一,高浓度的游离脂肪酸具有很强的细胞毒性和脂毒性[13]。此外,脂肪酸可在肾小管上皮细胞中诱导内质网应激,长期或严重的内质网应激可诱导肾小管上皮细胞凋亡[26]。既往研究报道,内质网应激参与急性肾损伤的发生发展,在肾功能紊乱中起重要作用[27]。内质网应激传感器PERK、IRE1α或ATF6 介导的3 种内质网应激相关途径已被证实参与了细胞凋亡的诱导[10]。XBP1 是ATF6 通路和IRE1 通路共同作用位点。在IRE1/XBP1 通路中,IRE1α介导XBP1 mRNA 表达产生有效的转录激活剂XBP1,激活编码内质网伴侣的基因,降低内质网应激[28]。分析每组小鼠血清中游离脂肪酸水平,结果显示HTGP 小鼠血清游离脂肪酸水平相比SAP 小鼠显著升高。免疫荧光染色法评估3 组小鼠肾组织中IRE1 和XBP1 的表达水平,结果显示高脂喂养的HTGP 小鼠肾脏中IRE1和XBP1的表达水平明显高于非高脂喂养的SAP 组。CD36是一种B 类清道夫受体,是介导肾小管细胞中游离脂肪酸摄取的主要受体,两者结合后可导致脂质积累和细胞损伤[29]。免疫荧光染色检测3组小鼠肾小管细胞中与游离脂肪酸结合的CD36受体的表达水平,提示HTGP小鼠肾组织中CD36的表达比SAP组明显增加。由此猜测,CD36介导游离脂肪酸转运到细胞可能激活内质网应激加重HTGP肾损伤。进一步在HTGP小鼠模型上用CD36抑制剂SSO验证,结果发现抑制CD36后HTGP肾组织中内质网应激蛋白IRE1、XBP1表达水平明显降低,且肾损伤程度减轻。
综上所述,本研究表明在实验性HGTP模型中,高甘油三酯血症加重了SAP相关肾损伤,其可能的发病机制是高甘油三酯血症促进了由CD36介导的游离脂肪酸的摄取,高浓度的游离脂肪酸激活IRE1/XBP1通路,进而增强内质网应激加重HGTP相关肾损伤。因此,本研究也许可以为高甘油三酯血症性急性胰腺炎伴肾损伤患者缓解病情提供了一个很好的治疗策略,但仍存在一些限制,没有验证另外两条内质网应激通路,以及没有探索游离脂肪酸参与HTGP肾损伤的其他机制,这有待于今后进一步研究。
