淫羊藿次苷Ⅱ对H2O2 诱导N2a 细胞损伤的保护作用研究
2022-05-12肖洪贺陈吉聪赵宇萌田晋明杨静娴
田 雨,肖洪贺,陈吉聪,赵宇萌,李 贺,田晋明,杨静娴
(辽宁中医药大学 药学院,辽宁 大连 116600)
阿尔茨海默病(Alzheimer’s disease,AD)是一种中枢神经系统退行性疾病,β-淀粉样蛋白沉积、神经纤维缠结和神经元凋亡是其最主要的病理改变[1]。研究表明[2],AD 患者脑内存在的大量活性氧可导致患者脑内神经细胞的脂质过氧化,进而诱导神经元的凋亡,加速AD 进程。因此减少脑内神经元的凋亡,改善脑内氧化应激水平是治疗AD 的有效途径。
B 细胞淋巴瘤/白血病-2(B-cell lymphonda/leukemia 2,bcl-2)和bcl2-相关X蛋白(bcl2-associated X protein,Bax)是细胞凋亡信号转导途径中关键的一对调控基因。Caspase 3 是胱天蛋白酶凋亡亚型中的一种,具有剪切细胞蛋白的作用,可直接诱导细胞发生凋亡。其中,bcl-2、Bax 是线粒体膜通透性改变的重要调控因素,Bax 的过表达能促使细胞色素c的释放,促进下游蛋白Caspase 3 蛋白的活化,从而诱导细胞凋亡[3]。
淫羊藿次苷Ⅱ(Icariside Ⅱ,ICS Ⅱ)是中药淫羊藿的主要活性成分之一,相关研究表明,其具有抗炎、抗肿瘤和神经保护等药理作用[4]。另外,本课题组前期研究结果显示[5],以ICS Ⅱ为主要药效成分的参枣健脑口服液能有效减少AD 小鼠脑内的神经元凋亡并激活其内源性神经再生。基于上述研究结果,我们推测ICS Ⅱ能通过改善脑内氧化应激水平,抑制神经细胞凋亡来发挥抗AD 作用。因此,本实验拟用H2O2诱导N2a 细胞构建体外细胞模型,采用免疫荧光化学、Western Blot 等方法探究ICS Ⅱ对H2O2-N2a 的保护作用及其潜在的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验试剂 淫羊藿次苷Ⅱ(113558-15-9,纯度≥98%)购于四川省维克奇生物科技有限公司;胎牛血清(批号:19110505)购于浙江天杭生物科技股份有限公司;青-链双抗(批号:J190007)购于美国Hyclone 公司;兔抗Caspase 3 蛋白抗体(WL02117)、兔抗Bax 蛋白抗体(WL01637)、兔抗bcl-2 蛋白抗体(WL03847)、兔抗GAPDH 蛋白抗体(WL01114)、HRP 标记山羊抗兔lgG(WLA023)和Hoechst 33258 染色液(WLA036a)均购于沈阳万类生物技术有限公司;兔抗小鼠CyTM3 标记二抗(bs-0368R-Cy3)购于北京博奥森生物技术有限公司;CCK-8 细胞增殖检测试剂盒(C0037)购自上海碧云天生物技术有限公司;LDH 乳酸脱氢酶试剂盒(A020-2-2)、SOD 超氧化物歧化酶测定试剂盒(A001-1-2)和MDA 丙二醛测定试剂盒(A033-1-2)购于南京建成生物工程研究所。
1.1.2 实验仪器 Ti-S 型荧光显微镜(日本尼康株式会社);C00I01HW 型CO2培养箱(北京东联哈尔仪器制造有限公司);MR-96A 型酶标仪(深圳迈瑞生物医疗电子股份有限公司);Powerpac HC 型电泳仪、 Trans-Blot SD Cell 型半干式蛋白转膜仪(Bio-Rad 公司);SH-510 型凝胶成像系统(杭州申花科技有限公司)。
1.1.3 实验细胞 小鼠神经瘤母细胞(批号:210409G61)购于赛业(苏州)生物科技有限公司。
1.2 实验方法
1.2.1 淫羊藿次苷Ⅱ的配制 精密称取0.1 mg ICSⅡ,溶于194 μL DMSO 中,制成浓度为10 mmol/L 的ICS Ⅱ母液,加H-DMEM 稀释至浓度为2.5 μmol/L的 ICS Ⅱ工作液,-20℃冻存备用。
1.2.2 H2O2-N2a 细胞模型的构建 将N2a 细胞以5 × 103cell/孔的密度接种于96 孔板中,培养30 h 后,分别加入浓度为62.5、125、250、500、1 000 μmol/L的H2O2损伤1.5 h[6]。随后每孔加入10 μL CCK-8 溶液,37 ℃孵育1.5 h,检测A450。重新铺板30 h 后,以H2O2最佳的损伤浓度分别作用N2a 细胞1、2、3、4、5 h,并利用CCK-8 法检测细胞存活率。
1.2.3 CCK-8 法检测细胞存活率 取N2a 细胞以5 × 103cell/孔的密度接种于96 孔板中,待细胞贴壁后,给药组分别加入不同浓度的ICS Ⅱ(0.062 5、0.125、0.25、0.5、1 μmol/L)预保护24 h,随后将培养基更换为H-DMEM 基础培养基,模型组和给药组给予500 μmol/L H2O2,2 h 后使用CCK-8 法检测细胞存活率。
1.2.4 微板法检测LDH 释放量 取N2a 细胞以5 ×103cell/孔的密度接种于96 孔板中,待细胞贴壁后,给药组给予0.25 μmol/L ICS Ⅱ预保护24 h,随后将培养基更换为H-DMEM 基础培养基,模型组和给药组给予500 μmol/L H2O2,2 h 后收集上清液,并根据试剂盒使用说明检测LDH 释放量。
1.2.5 TBA 法检测MDA 含量 取N2a 细胞以2 ×104cell/孔的密度接种于24 孔板中,待细胞贴壁后,给药组给予0.25 μmol/L ICS Ⅱ预保护24 h,随后将培养基更换为H-DMEM 基础培养基,模型组和给药组给予500 μmol/L H2O2。2 h 后弃去培养基,每孔加入500 μL1% TritonX-100 溶液破碎细胞30 min,反复冻融细胞3 次,随后根据MDA 试剂盒使用说明进行检测。
1.2.6 羟胺法检测SOD 活性 细胞分组、铺板、给药、破碎等步骤同“1.2.5”,破碎细胞后按照SOD试剂盒说明书操作。
1.2.7 Hoechst 33258 染色检测细胞凋亡 细胞分组、铺板、给药、造模等步骤同“1.2.4”。弃培养基,每孔加入100 μL 4%多聚甲醛溶液固定细胞10 min。弃固定液,PBS 清洗5 min,重复两次。加入100 μL Hoechst 33258染色液,并置于摇床上低速染色5 min。弃染色液,PBS 清洗5 min,滴加抗淬灭封片液封片,荧光显微镜下拍照观察。
1.2.8 免疫荧光化学法检测细胞凋亡 细胞分组、铺板、给药、造模等步骤同“1.2.4”。弃培养基,PBS 清洗10 min。弃PBS,加入100 μL 4%多聚甲醛溶液固定细胞30 min。PBS 清洗5 min,洗2 次。弃PBS,加入100 μL 0.5% TritonX-100 溶液透化细胞15 min。弃透化液,加入50 μL 5% BSA 溶液封闭30 min。弃封闭液,PBS 清洗5 min。弃PBS,加入兔抗Caspase 3 一抗(1 ∶150 稀释),4 ℃孵育过夜。回收一抗,加PBS 清洗10 min。弃PBS,加入50 μL CyTM3 标记二抗(1 ∶300 稀释)室温避光孵育1 h。回收二抗,PBS 清洗10 min。弃PBS,加入50 μL细胞核染料DAPI 溶液染核2 min。弃去DAPI 溶液,滴加抗淬灭封片液封片,荧光显微镜下拍照观察。
1.2.9 Western Blot 法 检 测bcl-2、Bax 和Caspase 3蛋白的表达情况 取N2a 细胞以1 × 106cell/mL 的密度接种于6 孔板中,细胞分组、给药、造模等步骤同“1.2.4”。弃培养基,使用预冷的PBS 洗涤3 次,并根据全蛋白试剂盒说明书提取蛋白。使用BCA 蛋白定量试剂盒检测蛋白浓度。加入5 × Loading Buffer制备上样缓冲液,随后进行SDS-PAGE 凝胶电泳并转膜。使用5%的脱脂奶粉常温封闭2 h,加入兔抗bcl-2、Bax、Caspase 3 和GAPDH 蛋白抗体,4 ℃孵化过夜;次日加入CyTM3 标记的山羊抗兔二抗孵育PVDF 膜。滴加超敏ECL 化学发光液,并置于凝胶成像仪中显影。用Image J分析条带并计算相对灰度值。
1.2.10 统计学方法用SPSS 22.0 软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用方差分析。以P< 0.05 为差异具有统计学意义。
2 结果与分析
2.1 成功建立H2O2-N2a 细胞模型
实验结果表明,N2a 细胞分别与62.5、125、250、500、1 000 μmol/L H2O2共孵育1.5 h 后,与对照组相比,各组细胞存活率均明显下降且呈剂量依赖性(P< 0.01);其中以500 μmol/L H2O2的损伤程度适中,故选择此浓度进行后续实验,见图1。为了进一步确定H2O2损伤N2a 细胞的最佳时间,将N2a 细胞与500 μmol/L H2O2分别共孵育1、2、3、4、5 h,与500 μmol/L H2O2共孵育2、3、4、5 h 后,与对照组相比,N2a 细胞的存活率明显下降且呈时间依赖性(P< 0.01),见图2。且500 μmol/L H2O2损伤N2a细胞2 h 的细胞存活率基本维持在60%,损伤程度适中,故选择500 μmol/L H2O2损伤N2a 细胞2 h 作为后续实验的造模条件。
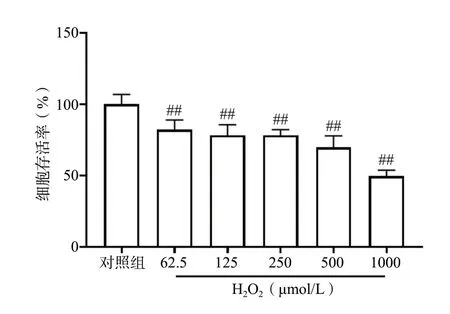
图1 CCK-8 法检测不同浓度H2O2 对N2a 细胞存活率的影响(n = 6)Fig. 1 The effect of different concentrations of H2O2 on the survival rate of N2a cells by CCK-8 assay(n = 6)
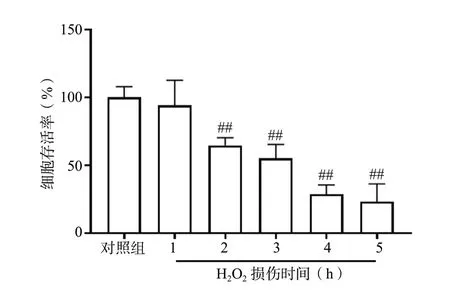
图2 CCK-8 法检测H2O2 作用不同时间对N2a 细胞存活率的影响 (n = 6)Fig. 2 The effect of different contact time of H2O2 on the survival rate of N2a cells by CCK-8 assay(n = 6)
2.2 ICS Ⅱ提升H2O2-N2a 的细胞存活率并改善形态
CCK-8 实验结果见图3,使用500 μmol/L H2O2损伤N2a 细胞2 h 后,与对照组比较,模型组细胞的存活率明显下降(P< 0.01);而经不同浓度ICS Ⅱ预保护24 h 后,细胞存活率都有不同程度的提升,且与模型组之间的差异明显(P< 0.05,P< 0.01)。其中,以0.25 μmol/L ICS Ⅱ组细胞的存活率最高,故选择0.25 μmol/L ICS Ⅱ预保护24 h 作为后续实验的给药浓度。对照组细胞胞体饱满,细胞呈长梭形,而经H2O2损伤后,模型组细胞胞体明显皱缩;添加0.25 μmol/L ICS Ⅱ预保护24 h 后,细胞胞体皱缩情况明显改善,部分细胞呈长梭形,见图4。以上结果表明,ICS Ⅱ预保护能有效提升H2O2-N2a 的细胞存活率并改善形态。
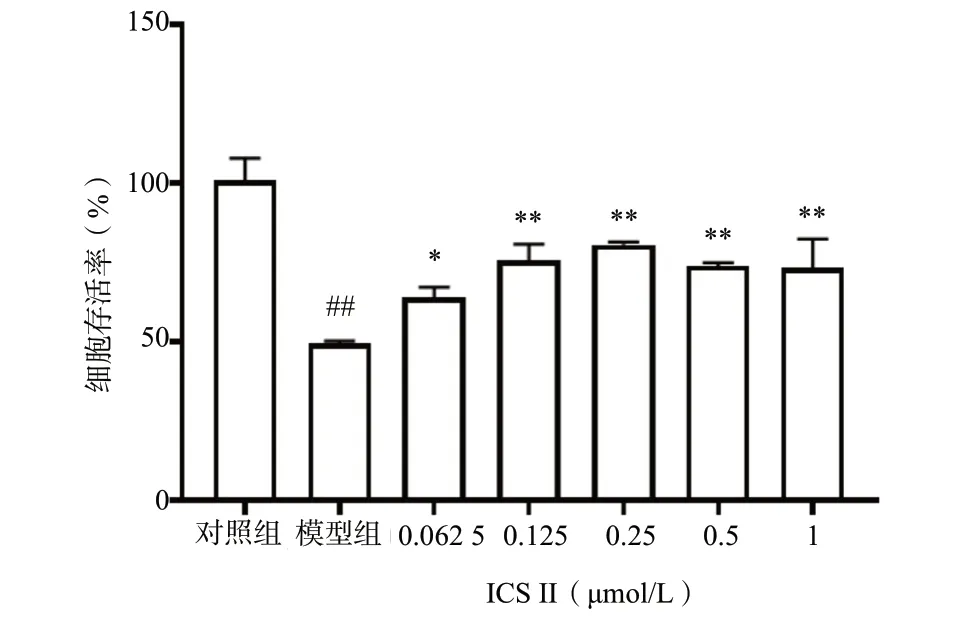
图3 CCK-8 法检测ICS Ⅱ对H2O2-N2a 细胞存活率的影响(n = 6)Fig. 3 The effect of ICS Ⅱ on the survival rate of H2O2-induced N2a by CCK-8 assay(n = 6)
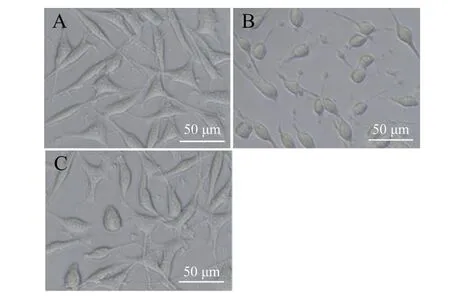
图4 ICS Ⅱ对H2O2-N2a 细胞形态的影响Fig. 4 The effect of ICSⅡ on the morphology of N2a cells injured by H2O2
2.3 ICS Ⅱ减少H2O2-N2a 的氧化损伤
经H2O2损伤后,与对照组比较模型组细胞LDH释放量明显增加(P< 0.01);而经ICS Ⅱ预保护24 h后,与模型组比较给药组细胞LDH 释放量明显下降(P< 0.01);提示ICS Ⅱ预保护能有效减少H2O2对于细胞的损伤,见图5A。经H2O2损伤后,模型组细胞内MDA 含量较对照组有明显上升(P< 0.01);而经ICS Ⅱ预保护24 h 后,与模型组比较,给药组细胞内MDA 含量明显降低(P< 0.05),见图5B。经H2O2损伤后,与对照组比较模型组细胞内SOD 活性明显下降(P< 0.01);而经ICS Ⅱ预保护24 h 后,与模型组比较,给药组细胞内SOD 活性明显上升(P< 0.01),见图5C。以上结果证明,ICS Ⅱ能有效改善H2O2对N2a 细胞的氧化应激损伤。

图5 ICS Ⅱ对H2O2-N2a 的LDH 释放量和细胞内MDA、SOD水平的影响(n = 6)Fig. 5 The effects of ICS Ⅱ on the level of LDH, MDA and SOD in N2a cells injured by H2O2 (n = 6)
2.4 ICS Ⅱ减少H2O2-N2a 的凋亡
Hoechst 33258 染色结果见图6、图7,经H2O2损伤后模型组细胞凋亡率明显上升(P< 0.01);而给予ICS Ⅱ预保护24 h 后,与模型组比较,给药组细胞的凋亡率下降(P< 0.01)。使用免疫荧光化学法检测各组细胞Caspase 3 蛋白的表达情况,见图8、9。与对照组比较,经H2O2损伤后模型组细胞Caspase 3 阳性细胞个数明显上升(P< 0.01);而经ICS Ⅱ预保护后,与模型组相比,给药组细胞Caspase 3 阳性细胞个数明显下降(P<0.01)。以上结果表明,ICS Ⅱ预保护能有效降低H2O2诱导的细胞凋亡。
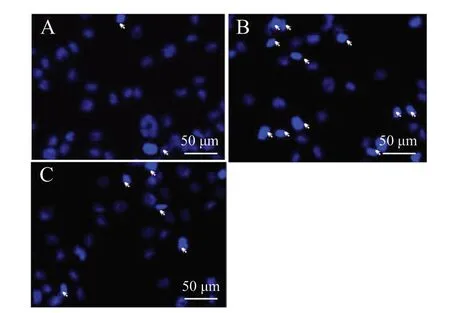
图6 Hoechst 33258 法检测细胞凋亡Fig. 6 Cell apoptosis detected by Hoechst 33258 assay

图7 Hoechst 33258 阳性细胞率统计图(n = 3)Fig. 7 Statistical plot of Hoechst 33258 positive cells rate(n = 3)
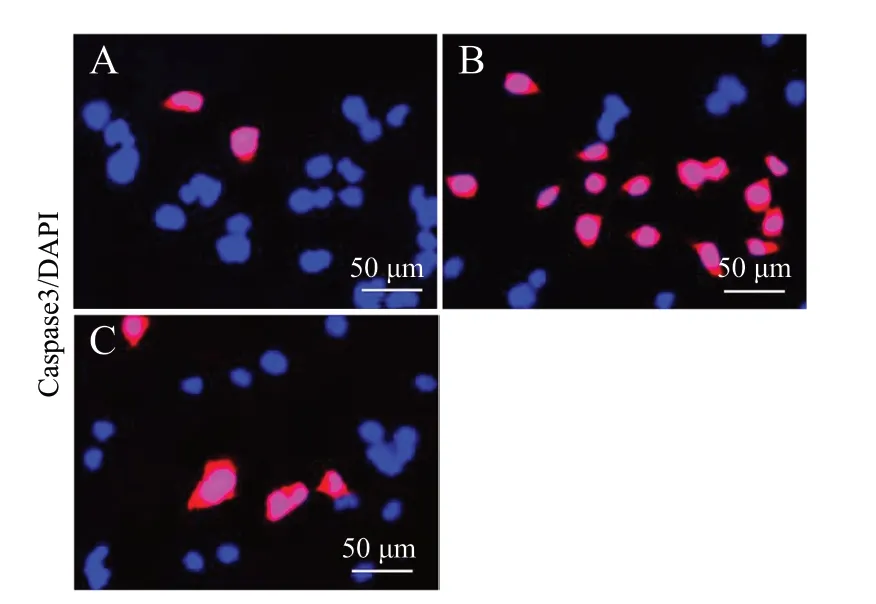
图8 免疫荧光染色法检测Caspase 3 阳性细胞的表达Fig. 8 The expression of Caspase 3 positive cells detected by immunofluorescence staining
2.5 ICS Ⅱ下调H2O2-N2a 内Bax/bcl-2、Caspase 3蛋白的表达
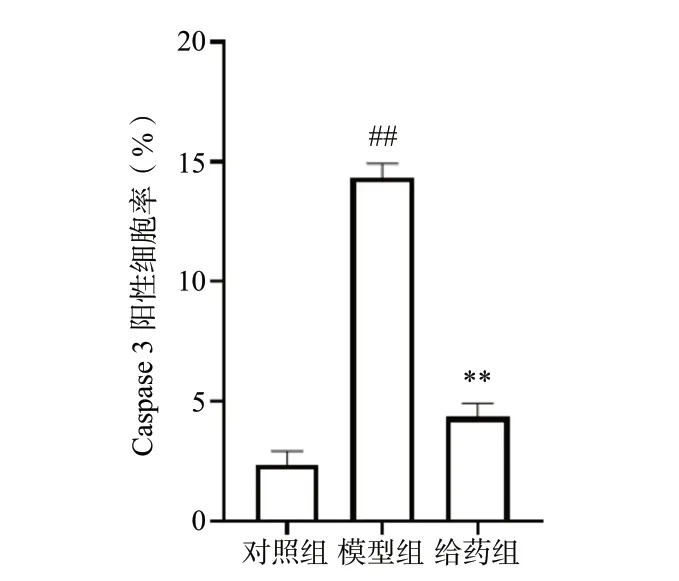
图9 Caspase 3 阳性细胞率统计图(n = 3)Fig. 9 Statistical plot of Caspase 3 positive cells rate(n = 3)
为了进一步探讨ICS Ⅱ抑制H2O2诱导的N2a 细胞凋亡的作用机制,利用Western Blot 实验以GAPDH作为内参蛋白,检测了bcl-2、Bax 和Caspase 3 的蛋白表达情况,见图10、图11。经H2O2损伤后,与对照组比较,模型组细胞Bax、Caspase 3 蛋白表达量明显升高,bcl-2 蛋白表达量明显下降(P<0.01);而给予ICS Ⅱ预保护24 h 后,与模型组比较,给药组细胞Bax、Caspase 3 蛋白表达量明显下降,bcl-2 蛋白表达量明显上升(P< 0.05,P< 0.01)。综上所述,ICS Ⅱ能通过抑制Caspase 3/Bax/bcl-2 信号通路减少H2O2诱导的N2a 细胞凋亡。
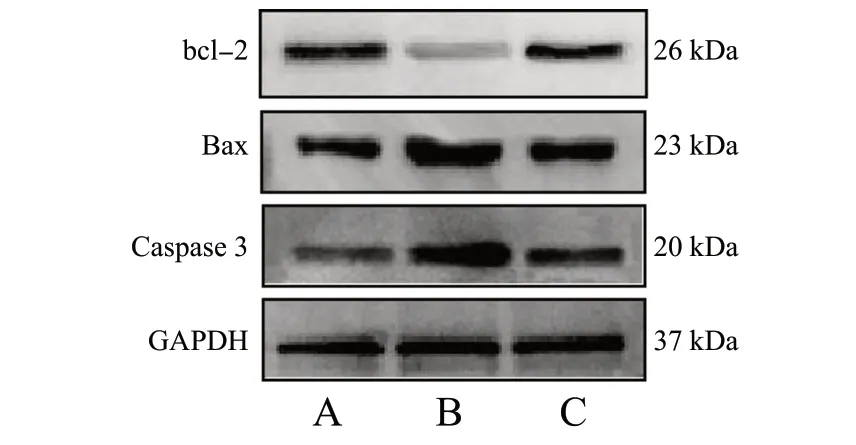
图10 Western Blot 条带图Fig. 10 Western Blot strip plot
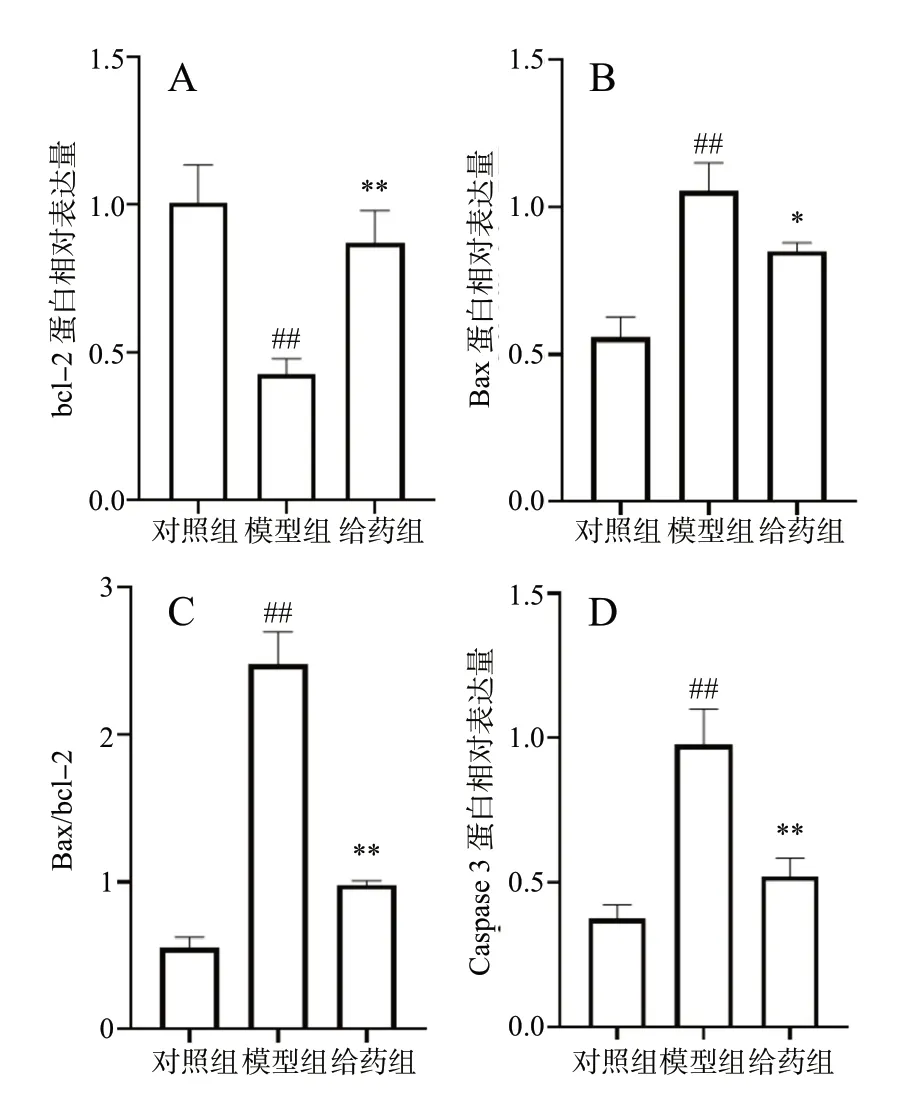
图11 Western blot 条带定量统计图(n = 3)Fig.11 Quantitative statistical plot of Western blot bands(n = 3)
3 讨论
氧化应激引发的神经细胞凋亡是导致阿尔茨海默病等神经退行性疾病发病的重要原因。相关研究表明[7-9],H2O2能有效的诱导细胞氧化应激损伤,造成细胞凋亡,因此本实验采用CCK-8 法摸索H2O2损伤N2a 细胞的最佳条件,结果显示,与500 μmol/L H2O2共孵育2 h 是N2a 细胞造模的最佳条件。而高健美等[10]的研究表明,200 μmol/LH2O2作用24 h 是建立SH-SY5Y 细胞凋亡模型合适的条件;易鹏吉等[11]的研究结果显示,500 μmol/LH2O2作用6 h 能建立PC12 细胞损伤模型。基于此,我们认为利用H2O2诱导不同种类的细胞需要不同的条件。
通常,机体内源性的自由基清除系统如SOD 等能够清除氧化应激所产生的MDA,并且自由基的产生与清除处于一种动态平衡;而当细胞受到氧化应激损伤时,大量产生的自由基会打破这种平衡进而导致细胞凋亡。本研究结果表明,经H2O2诱导之后的N2a 细胞MDA 含量显著升高、SOD 活性明显下降;而ICS Ⅱ预保护能明显降低H2O2-N2a 细胞的氧化应激水平。这与ICS Ⅱ对过氧化损伤的SH-SY5Y 细胞的作用结果是一致的[10],两项研究结果共同证明了ICS Ⅱ具有良好的抗氧化作用。
越来越多的证据表明,氧化应激诱导神经元凋亡会进一步加速AD 的认知障碍,因此减少氧化应激介导的神经元凋亡具有重要意义。Hoechst 33258 染色和免疫荧光染色被用来检测ICS Ⅱ对H2O2-N2a 细胞凋亡的影响,结果表明,ICS Ⅱ能有效降低Hoechst 33258、Caspase 3 阳性细胞数量。为了进一步阐述ICS Ⅱ减少H2O2导致N2a 细胞凋亡的潜在机制,Western Blot 法被用来检测Caspase 3/Bax/bcl-2 信号通路上关键蛋白的表达,结果发现ICS Ⅱ能够明显减少H2O2损伤后N2a 细胞的Bax/bcl-2、Caspase 3蛋白表达量。因此,我们推测ICS Ⅱ可以通过能抑制Caspase 3/Bax/bcl-2 信号通路从而减少H2O2诱导的N2a 细胞的凋亡。
综上所述,本研究以N2a 细胞为研究对象,利用H2O2构建AD 细胞模型,发现ICS Ⅱ降低H2O2-N2a 的氧化应激水平、减少细胞凋亡可能与抑制Caspase 3/Bax/bcl-2 信号通路有关。本研究阐释了ICS Ⅱ减少H2O2诱导的细胞凋亡新机制,并丰富了其用于治疗AD 的实验基础。
4 结论
本研究利用H2O2损伤N2a 细胞构建体外细胞模型,从抑制氧化损伤、减少神经凋亡的角度出发,探究ICS Ⅱ对AD 神经细胞的保护作用。实验结果证明了ICS Ⅱ能通过改善氧化应激水平,抑制Caspase 3/Bax/bcl-2 信号通路减少H2O2-N2a 细胞的凋亡,这将为ICS Ⅱ用于治疗AD 提供实验基础。此外,ICSⅡ能通过抑制Caspase 3/Bax/bcl-2 信号通路减少神经细胞凋亡,而发挥抗AD 作用这一结论仍需通过动物模型进行进一步验证。
