卡伍尔氏链霉菌NA4生物合成巴弗洛霉素前体甲氧基丙二酰ACP来源的研究
2022-04-11鲍秀艳姚雪春史美君胡江春潘华奇
鲍秀艳, 姚雪春, 史美君, 胡江春, 潘华奇*
(1.中国科学院 沈阳应用生态研究所,辽宁 沈阳 110016;2.中国科学院大学,北京 100049)
巴弗洛霉素是一类核心骨架经I型聚酮合成酶装配合成的十六元大环内酯,该家族化合物结构多样,是液泡型H+-ATPase的高效特异性抑制剂,已被广泛应用于该酶的研究[1]。液泡型H+-ATPase参与了真核细胞的多种生理过程,因此巴弗洛霉素具有广泛的生物活性,包括抗菌、抗病毒、抗肿瘤、抗骨质疏松等[2-5],是一类研发农药和医药的良好先导化合物。中国科学院沈阳应用生态研究所农业微生物组(本课题组)前期从来源于我国南海1 464 m深海沉积物的卡伍尔氏链霉菌NA4(StreptomycescavourensisNA4)发酵液中,分离鉴定了两个巴弗洛霉素单体化合物 bafilomycins B1和C1(图1),特别是bafilomycin B1 对许多镰刀菌的抑制活性强于阳性对照药物两性霉素B[2]。在体内盆栽实验显示巴弗洛霉素活性提取物对黄瓜霜霉病等防效显著,其防效和对照药剂稀酰吗啉相当,有进一步研制成生物杀菌剂的潜力。然而较低的发酵单位是限制其产业化生产的瓶颈。目前,巴弗洛霉素类抗生素的生物合成基因簇已经被鉴定[6-7],其骨架由5个不同ORF含有的12个PKS模块组成,以丁酰CoA等为起始单元,依次缩合丙二酰CoA、甲基丙二酰CoA和甲氧基丙二酰ACP形成线性聚酮链(图1),然后在末端硫酯酶TE结构域催化下,该聚酮链从PKS上解离下来,环化形成十六元环骨架——中间体bafilomycin A1,并最终经氧化和环化等修饰机制形成复杂多样的衍生物[8]。本课题组前期对野生株NA4进行了全基因组测定,通过生物信息学分析定位了巴弗洛霉素的生物合成基因簇(图2),并且利用SuperCos I构建了野生株NA4的基因组文库和建立了基因改造的遗传操作体系[9]。
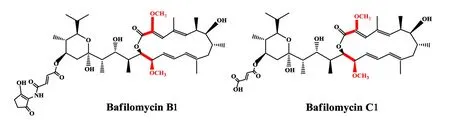
图1 巴弗洛霉素B1和C1的化学结构Fig.1 Structures of bafilomycins B1 and C1红色标记为甲氧基丙二酰ACP前体来源的巴弗洛霉素延伸单元Red: bafilomycin extender unit from methoxymalonyl-ACP precursor
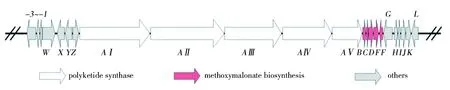
图2 巴弗洛霉素生物合成基因簇中甲氧基丙二酰ACP生物合成位点及侧翼区域Fig.2 Genetic organization of the methoxymalonyl-ACP biosynthesis locus and the flanking regions in bafilomycin biosynthetic gene cluste
聚酮类化合物的产量往往受到前体供应的限制,通过强化前体供应提高聚酮类化合物的产量是常用策略。因此,明确重要前体的供应途径是高产菌株构建的基础。巴弗洛霉素骨架结构的生物合成前体3个酰基CoA单元和1个甲氧基丙二酰ACP。其中3个酰基CoA前体单元都可以通过微生物中心代谢产物乙酰CoA途径合成,而通过许多研究表明前体甲氧基丙二酰ACP由FkbG、FkbH、FkbI、FkbJ和FkbK同源蛋白催化合成[10-11]。值得注意的是一些甲氧基丙二酰ACP的合成途径并不在聚酮类化合物的合成基因簇内[12],野生株NA4的巴弗洛霉素合成基因簇外是否存在其他甲氧基丙二酰ACP合成途径。同时羟基丙二酰CoA或甲氧基丙二酰CoA是否可以替代甲氧基丙二酰ACP参入到聚酮链的延伸中仍需要更多的证据。为此,构建了ΔbafB-E突变株以研究野生株NA4合成巴弗洛霉素时关键前体甲氧基丙二酰ACP的来源。
1 材料与方法
1.1 材料
1.1.1 菌种来源 从中国南海(E 111°36.160′,N 17°59.928′)水深1 464 m的海底沉积物中分离得到卡伍尔氏链霉菌 NA4(StreptomycescavourensisNA4)[2]。遗传操作过程中所使用的大肠埃希菌菌株(Escherichiacoli)和相关质粒均由中国科学院南海海洋研究所鞠建华研究员赠予,保存于中国科学院沈阳应用生态研究所农业微生物组,见表1。

表1 菌株与质粒
1.1.2 培养基 ①LB固体培养基;②SFM固体培养基:黄豆饼粉20 g,甘露醇20 g,自来水1 L,琼脂2%;③NM2培养基:葡萄糖1 g,乳糖10 g,甘油20 mL,大豆蛋白胨5 g,硝酸铵1.5 g,酵母粉3 g,1倍微量元素液(FeSO4·7H2O 0.1 g,MnCl2·4H2O 0.1 g,ZnSO4·7H2O 0.1 g,蒸馏水1 L)0.2 mL,蒸馏水1 L,pH 6.0;④TSB培养基:大豆蛋白胨5 g,胰蛋白胨15 g,葡萄糖2.5 g,K2HPO42.5 g,NaCl 5 g,自来水1 L,pH 7.0。
1.1.3 试剂与仪器 RNAiso Plus,PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit、TaKaRaTaq、SYBR Green Real-time PCR Master Mix购自Takara;抗生素购自上海生工生物工程技术服务有限公司,工作浓度分别为阿泊拉霉素(Apramycin, Apr)50 mg/L、氨苄青霉素(Ampicillin, Amp)50 mg/L、氯霉素(Chloramphenicol, Chl)50 mg/L、卡那霉素(Kanamycin, Kan)50 mg/L、三甲氧苄胺嘧啶(Trimethoprim, TMP)100 mg/L。PCR仪(Eppendorf, Mastercycler gradient);恒温摇床(DHZ-C,太仓市实验仪器有限公司);低温高速离心机(3K-15,Sigma);核酸/蛋白质检测仪(NanoDrop 2000,ThermoFisher);荧光定量PCR仪(LightCycler 96,Roche);高效液相色谱仪(Ultimate-3000,Dionex)。
1.2 方法
1.2.1 引物设计与合成 根据巴弗洛霉素生物合成基因簇的BafB-E的序列设计敲除引物,引物长58/59 bp,其中引物5′端39 bp与目的序列同源,3′端20 bp或19 bp序列与pIJ773 Apr抗性基因两侧序列同源;设计靶向BafB-E侧翼序列的基因敲除检测引物,野生株NA4与突变株PCR产物长度分别为3 798 bp及1 812 bp;设计靶向基因BafB的mRNA检测引物,采用Primer 5.0软件在线设计引物(引物序列见表2)。引物由上海生工生物工程技术服务有限公司合成。

表2 引物
1.2.2 利用PCR-targeting 技术构建重组质粒 PCR-targeting技术操作方法见参考文献[13]。本课题组前期筛选出覆盖bafB-E基因的pC28-15D1为用于PCR-targeting的阻断粘粒[9]。以质粒pIJ773为模板,C28-baf_bafB-E_delF/R为引物,采用rTaqDNA聚合酶进行PCR扩增得到aac(3)Ⅳ+oriT片段(含Apr抗性基因序列),胶回收扩增DNA片段备用;同时将覆盖bafB-E基因的pC28-15D1转化入E.coliBW25113/pIJ790中;接下来将aac(3)Ⅳ+oriT片段转化入BW25113/pIJ790/pC28-15D1感受态细胞;在含Amp、Apr、Kan的LB平板上筛选转化子,提取质粒,重组为含Apr抗性片段的载体,命名为pC28-15D1-bafB-E,其中bafB-E基因被Apr抗性基因所取代;将pC28-15D1-bafB-E转化入E.coliET12567/pUZ8002感受态细胞中,获得ET12567/pUZ8002/pC28-15D1-bafB-E目标供体菌。
1.2.3 接合转移 接合转移操作方法参见文献[14],并做少量改良。E.coliET12567/pUZ8002/pC28-15D1-bafB-E在7 mL含Kan、Chl、Apr的LB液体培养基中,200 r/min、37 ℃生长过夜,按2%(体积分数)接种量接种于50 mL 含Kan、Chl、Apr 的LB液体培养基的250 mL三角瓶中,37 ℃生长至OD600为0.6时,离心收集菌体,用LB液体培养基清洗2遍,重悬于1 mL LB培养基中,作为接合转移的供体菌;取甘油冻存的野生株NA4孢子,5 000 r/min离心8 min,弃上清,用TSB培养基洗涤2次除去甘油,重悬于TSB培养基,50 ℃热激10 min,28 ℃、180 r/min振荡培养3 h进行预萌发,作为受体菌;取供体菌和受体菌各500 μL混合,涂布于SFM平板上,28 ℃培养16 h后,用1 mL含2.5 mg Apr和1 mg的TMP的无菌水覆盖,吹干,28 ℃培养4 d。
1.2.4 重组菌株的PCR鉴定 需鉴定的大肠埃希菌蘸取少量单克隆菌体,野生株NA4及ΔbafB-E突变株用牙签直接刮取少量孢子,以上样品置于含20 μL Lysis Buffer for Microorganism to Direct PCR的PCR管中,用PCR仪对样品进行裂解,作为模板,裂解程序为80 ℃ 15 min,98 ℃ 15 min,4 ℃保存;然后利用PCR扩增进行鉴定。PCR体系:上下游引物(10 μmol/L)各0.5 μL;模板1 μL;dNTP(2.5 mmol/L)1.5 μL;rTaq酶0.15 μL;10×buffer 1.5 μL;DMSO 1 μL;ddH2O补齐至15 μL。PCR反应条件:第一阶段(1个循环),95 ℃ 5 min;第二阶段(30个循环),95 ℃ 40 s、58 ℃ 40 s、72 ℃ 2 min;第三阶段(1个循环),72 ℃ 10 min。
1.2.5 荧光定量PCR检测 收集培养16~72 h后野生株NA4及ΔbafB-E突变株的菌体,按照说明书,采用Trizol法提取总RNA,进行反转录,得到cDNA,以此为模板进行Real-Time PCR检测。PCR体系:上下游引物(10 μmol/L)各0.8 μL,模板1 μL,TB GreenPremix Ex TaqⅡ(Tli RNaseH Plus)(2×)10 μL,RNase Free H2O补齐至20 μL。PCR反应条件:第一阶段(1个循环),95 ℃ 30 s;第二阶段PCR反应(40个循环),95 ℃ 5 s、55 ℃ 30 s、72 ℃ 1 min;第三阶段熔解曲线(1个循环),95 ℃ 10 s、65 ℃ 60 s、97 ℃ 1 s。
1.2.6 野生株NA4和ΔbafB-E突变株的发酵及HPLC分析 将野生株NA4孢子和ΔbafB-E突变株孢子接种于50 mL NM2培养基中,28 ℃、180 r/min发酵7 d,发酵液加入等体积丁酮超声萃取40 min,挥干,溶于100 μL甲醇中,进行HPLC-UV检测。分析条件:YMC-Pack ODS 色谱柱(4.6 mm×250 mm, 5 μm);流动相A相:100%色谱甲醇;流动相B相:超纯水(含0.05%的三氟乙酸);梯度分析程序:0~30 min,A相/B相(体积比)为10∶90~98∶2;30~35 min,A相/B相(体积比)为98∶2~98∶2;35~40 min,A相/B相(体积比)为10∶90~10∶90。
2 结果与分析
2.1 ΔbafB-E突变株的构建与鉴定
ΔbafB-E突变株的构建示意图如图3,当使用检测引物C28-baf_bafB-E_testF/R进行PCR扩增时,野生株NA4有一条3 798 bp的条带,而目标重组载体和ΔbafB-E突变株条带为1 812 bp。首先以质粒pIJ773为模板,C28-baf_bafB-E_delF/R为引物,扩增Apr抗性基因片段,采用PCR-targeting技术获得bafB-E基因被Apr抗性基因替换的E.coliBW25113/pIJ790/pC28-15D1-bafB-E工程菌株,菌落PCR鉴定结果显示获得目标阳性重组载体(图4A)。然后提取pC28-15D1-bafB-E阳性重组子,成功转化至E.coliET12567/pUZ8002中,得到ET12567/pUZ8002/pC28-15D1-bafB-E供体菌(图4B)。最后将该供体菌与受体菌卡伍尔氏链霉菌 NA4接合转移后涂布于含抗生素的SFM平板上,以Apr抗性基因筛选标记在培养4 d后生长出阳性接合子,以野生株NA4为对照,挑取4个ΔbafB-E突变株进行PCR鉴定,结果显示ΔbafB-E突变株构建成功(图4C)。
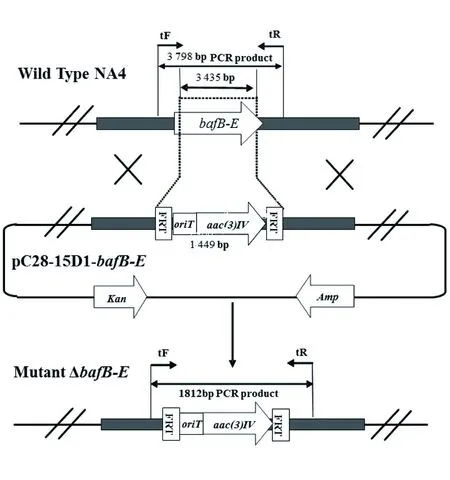
图3 ΔbafB-E突变株构建策略Fig.3 Construction of ΔbafB-E mutant
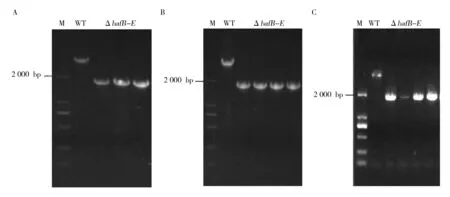
图4 重组载体及ΔbafB-E突变株电泳检测图Fig.4 Gel electrophoresis analyses of the recombinant cosmid and ΔbafB-E mutantA:PCR-targeting 获得重组载体验证结果;B:重组载体转化E.coli ET12567/pUZ8002验证结果;C:ΔbafB-E突变株验证结果;ΔbafB-E:重组载体/突变株;WT:野生株NA4;M:DNA Marker(DL 2000)A: Recombinant plasmids were obtained by PCR-targeting; B:Recombinant plasmids were transformed into E. coli ET/pUZ8002; C:ΔbafB-E mutant; ΔbafB-E: recombinant plasmids/mutant; WT: wild stain NA4; M: DNA Marker (DL 2000)
2.2 转录水平验证ΔbafB-E突变株
以野生株NA4为对照,挑取3个ΔbafB-E突变株在SFM平板上培养4 d,接种于NM2液体培养基,发酵16~72 h,取菌体提取总RNA,反转录为cDNA。以C28-baf_bafB-E_mRNAF/R为引物,以cDNA为模板进行Real-Time PCR检测。实验结果发现,野生株NA4中bafB基因在24 h时开始大量表达,特别在发酵48 h后巴弗洛霉素生物合成关键时期表达持续增强;而在ΔbafB-E突变株中,几乎检测不到bafB基因的表达(图5)。以上结果说明重组载体pC28-15D1-bafB-E通过接合转移导入野生株NA4中,发生了预期的同源重组,成功地获得了bafB-E基因缺失的双交换株。
2.3 bafB-E基因缺失对巴弗洛霉素生物合成的影响
进一步研究甲氧基丙二酰ACP生物合成基因缺失对卡伍尔氏链霉菌NA4中巴弗洛霉素生成的影响。以野生株NA4为对照,挑取3个ΔbafB-E突变株在SFM平板上培养4 d,接种于NM2液体培养基,发酵7 d后,HPLC分析bafB-E基因缺失对巴弗洛霉素产量的影响。如图6所示,在相同的发酵条件、萃取方法和分析条件下,ΔbafB-E突变株发酵产物中巴弗洛霉素几乎不产生,说明卡伍尔氏链霉菌NA4中bafB-E基因不仅参与了巴弗洛霉素生物合成,而且是野生株NA4生物合成巴弗洛霉素过程中甲氧基丙二酰ACP前体的唯一来源。
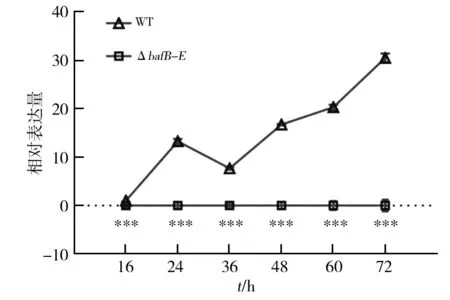
图5 bafB基因mRNA表达水平Fig.5 The mRNA expression of bafB gene in strains***: 与对照组相比,P<0.001***: Compared with the control group P<0.001
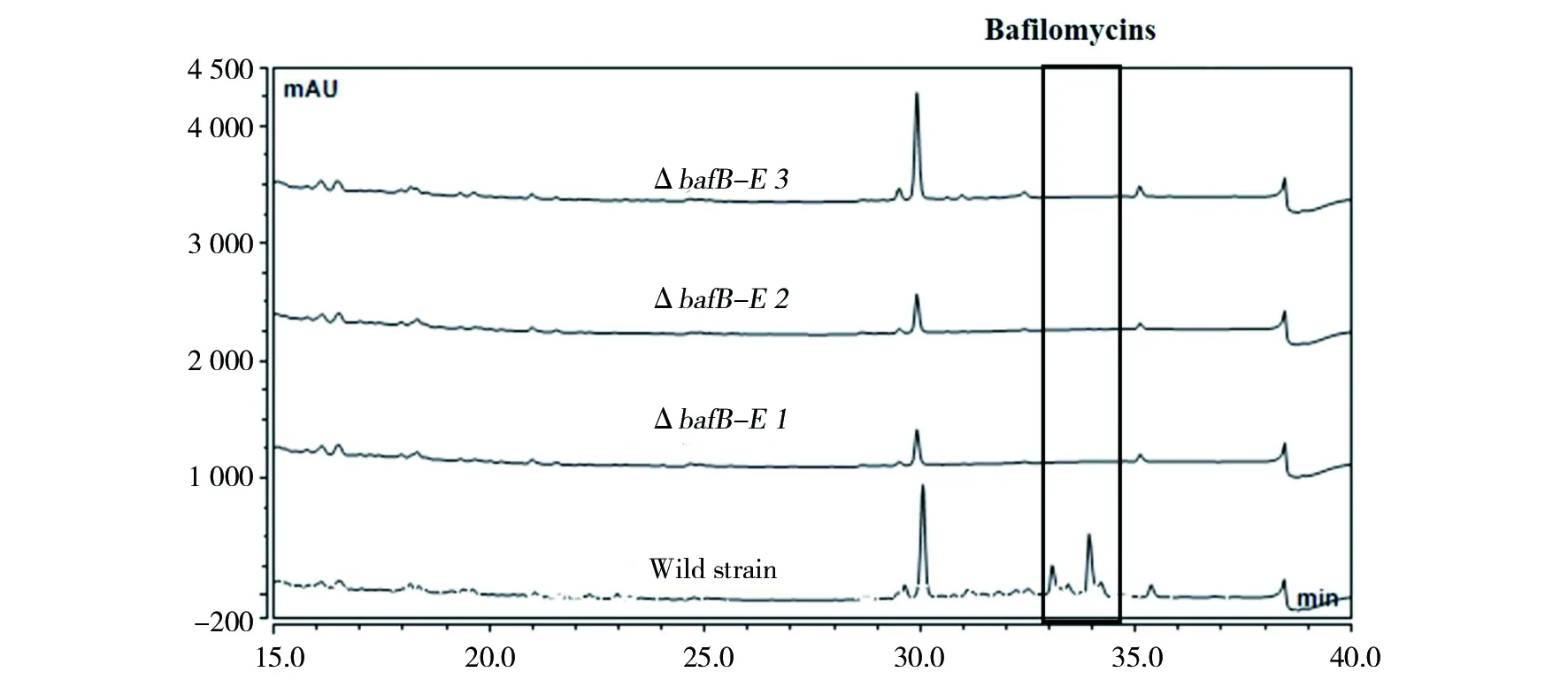
图6 野生型菌株及bafB-E基因缺失突变株发酵产物中巴弗洛霉素的HPLC分析图谱Fig.6 HPLC analysis of bafilomycins from the wild strain and bafB-E mutant
3 讨 论
巴弗洛霉素家族的化合物结构多样,生物活性广泛,因此吸引了众多科学家的关注。然而较低的发酵产量是限制巴弗洛霉素产业化生产的瓶颈,因此越来越多的学者通过对巴弗洛霉素生物合成相关调控基因的改造,以期影响其发酵产量。γ-丁内酯在大多数链霉菌中诱导次级代谢和产孢,AfsA家族蛋白是合成γ-丁内酯的关键酶。研究发现afsA同源基因stcA基因缺失菌株中,不仅影响了气生菌丝形成和产孢能力,而且几乎完全消除了巴弗洛霉素的产生[15]。在海洋来源链霉菌ATCC BAA-1276中发现了一个luxR家族调控基因orf1和一个afsR家族调控基因bafG,通过基因失活和过表达,揭示了orf1和bafG对巴弗洛霉素生物合成的正向调控作用[16]。强化前体供应是理性构建高产菌株的重要策略,当前尚无报道在构建巴弗洛霉素的高产菌株时使用该策略。
本研究通过构建ΔbafB-E突变株,明确了野生株NA4生物合成巴弗洛霉素过程中bafB-F基因负责编码催化甲氧基丙二酰ACP前体的唯一来源,没有发现巴弗洛霉素生物合成基因簇外其他补偿途径的存在。这与已报道由1,3-二磷酸甘油酸生成甲氧基丙二酰ACP的生物合成途径相同[11]。因此,推测在野生株NA4中,BafC作为一个离散的酰基载体蛋白,装载由BafE酶氧化甘油获得的甘油酸脂。生成甲氧基丙二酸的后续步骤都被BafC的中间体进行催化。BafB将3-羟基氧化成醛,随后醛转化为羧酸,这种转化是由酰基ACP脱氢酶BafD催化的。最后在BafF作用下甲基化生成甲氧基丙二酰ACP(图7)。上述结果为巴弗洛霉素高产菌株的构建提供理论支持。
羟基丙二酰ACP作为稀有的聚酮链延伸单元前体也时有报道,在zwittermicin A的生物合成基因簇中以1,3-二磷酸甘油酸为底物,依次由酰基载体蛋白ZmaD、去磷酸化酶ZmaN、NAD依赖的脱氢酶ZmaG和FAD依赖的脱氢酶ZmaE催化形成羟基丙二酰ACP单元[10]。在野生株NA4 巴弗洛霉素生物合成基因簇中,bafBCDEF编码的途径不仅可以生成最终的甲氧基丙二酰ACP,也可以形成羟基丙二酰ACP。本研究在实验设计时将合成羟基丙二酰ACP的连锁编码基因bafB-E整体用Apr抗性替换,可以实现对巴弗洛霉素基因簇外其他来源的羟基丙二酰ACP和甲氧基丙二酰ACP做到同时验证。本研究表明野生株NA4中不存在其他羟基丙二酰ACP生成的补偿途径,也没有发现在甲氧基丙二酰ACP供应中断时,有羟基丙二酰CoA或甲氧基丙二酰CoA参与到巴弗洛霉素合成中的现象。
丙二酰-CoA、甲基丙二酰-CoA、乙基丙二酰-CoA和甲氧基丙二酰ACP是PKS聚酮化合物生物合成过程中最常见的4种前体。甲氧基丙二酰ACP参与了多种聚酮类化合物的合成过程,包括apoptolidins、galbonolides、oxazolomycin等[12,17-18]。增加甲氧基丙二酰ACP的供应可以显著提高聚酮化合物的产量。如Rodriguez等[19]将吸水链霉菌中甲氧基丙二酰ACP生物合成通路特异性基因fkbG-K导入弗氏链霉菌染色体,使弗氏链霉菌中产生了1 g/L的聚酮化合物midecamycin类似物。FK506是一种有效的免疫抑制剂,具有广泛的临床应用。甲氧基丙二酰ACP是FK506生物合成过程中模块型PKS的扩展单元之一,研究发现增强甲氧基丙二酰ACP合成通路特异性基因的表达,能够提高FK506的产量[20]。本研究发现在野生株NA4中,bafB基因表达水平在次级代谢产物生物合成的关键时期持续增加,ΔbafB-E突变株中甲氧基丙二酰ACP途径阻断导致巴弗洛霉素不产生。提示增强甲氧基丙二酰ACP的供应是显著提高野生株NA4合成巴弗洛霉素产量的可行性方案。为理性构建巴弗洛霉素高产菌株提供参考。

图7 巴弗洛霉素基因簇中甲氧基丙二酰ACP的生物合成途径Fig.7 Methoxymalonyl-ACP biosynthetic pathway of bafilomycin biosynthetic gene cluster