模拟增温对青海湖鸟岛土壤产甲烷菌群落特征的影响
2022-04-11陈克龙
章 妮, 陈克龙, 祁 闻, 暴 涵
(1.青海师范大学 生命科学学院,青海 西宁 810008;2.青海师范大学 青海省自然地理与环境过程重点实验室,青海 西宁 810008;3.青海师范大学 科技处,青海 西宁 810008;4.青海师范大学 地理科学学院,青海 西宁 810008)
近年来,化石燃料的大量燃烧和土地利用变化导致大气中温室气体浓度急剧增加,全球气候变化加剧[1-2]。自1960年至今,全球年平均气温增加近2 ℃[3],预计至2100年将增加4 ℃以上[4-6],这将极大程度影响生态系统的稳定性。甲烷(CH4)是仅次于二氧化碳(CO2)的第二大温室气体,其全球变暖潜力是二氧化碳的25倍,对全球变暖的贡献高达20%[7]。地球大气化学循环中,甲烷有着重要的地位,其大气浓度直接影响地球气候[8],同时显著影响土壤环境的稳定性[9-10]。青藏高原作为一个独特的生态系统,平均海拔4 000 m以上,被称为地球第三极[11],对气候变化极为敏感[12-13]。过去的几十年里,青藏高原的气候变化呈现明显的变暖和降水增加的趋势[14]。高温、强降雨等极端天气事件越来越多地在当地气象站观测到[15]。青藏高原东北部的青海湖流域,为高纬度国际重要湿地,也是我国重要的生态功能调节区。其气候变化具有异质性,对温度变化极为敏感[16],受气候变化影响显著,30年的年平均气温升高约0.9 ℃[17]。另有研究表明,对比低海拔地区,高海拔生态系统受气候变化引起的土壤环境因素的变化更大[18]。因此,探究温度升高后青海湖流域土壤环境对增温的响应及其机制是非常必要的。土壤微生物作为土壤生态系统不可分割的一部分,在推动碳、氮、磷、硫等元素的生物地球化学循环以及维持土壤生态系统的过程和功能方面发挥着非常重要的作用[19-21],驱动了大量的生态系统过程[22],部分微生物菌群也是生态系统对气候变化响应的核心[23]。土壤微生物是优于土壤理化因素的环境指示因子,其生物量和群落结构变化是对外界环境的早期响应指标[24-26]。有研究表明,土壤微生物对微环境具有高敏感性,对温度变化响应明显[27]。温度变化不仅可以直接影响土壤微生物的生活,还可能通过蒸散发、植物生理、根系分泌和植被的变化来间接影响土壤微生物的生活[28-29]。因此,土壤微生物对气候变化的响应方向和程度存在一定的不确定性[30-31]。Iqbal等[32]的研究表明,甲烷相关的微生物菌群是识别湿地状态的最佳指标。湿地生态系统的甲烷排放量占全球甲烷排放通量的20%~40%[33],是自然环境中甲烷最大的排放源[34]。土壤中栖息的产甲烷菌通过新陈代谢产生大量甲烷[35-36],在湿地甲烷排放中起着至关重要的作用[37-38]。截至目前,对高寒湿地的土壤产甲烷菌群落的研究较少,有关青海湖鸟岛微生物群落的研究还停留在探究细菌以及真菌的群落特征上[39]。本研究旨在利用高通量测序的方法来探究温度升高后青海湖鸟岛这一湖滨湿地产甲烷菌群落的结构组成以及多样性特征的变化,以期了解高寒湿地产甲烷菌群落相关的甲烷排放机制,同时为深入探究湿地的碳循环机制提供一定的参考依据。
1 材料与方法
1.1 材料
1.1.1 研究区域概况 研究样地为鸟岛国家自然保护区,该区位于青海湖西北角的湖滨湿地,地理位置东经99°44′ ~ 99°54′,北纬36°57′ ~ 37°04′;海拔3 194 ~ 3 226 m,地势西北高、东南低。原生草地以直立黄芪 (AstragalusadsurgensPall)、甘青韭 (Alliumprzewalskianum)、赖草 (Leymussecalinus)、西伯利亚蓼 (PolygonumsibiricumLaxm)、早熟禾 (PoaannuaL)、细叶苔草 (Carexrigescens) 为优势植物种。该区为高原半干旱高寒气候区,年平均气温-0.7 ℃,年最高温度28 ℃、最低温度-31 ℃。年平均降水量322.7 mm,6~8月降水尤为集中,且年蒸发量远高于年降水量。
1.1.2 土壤样品采集 增温处理采用开顶箱 (Open-Top Chamber, OTC) 于2017年在鸟岛选取50 m×50 m样地,样地内选取4 m×4 m小样方布设OTC,其上表面直径150 cm,边长87 cm;下表面直径208 cm,边长122 cm;增温幅度约1.2 ℃。于设置增温装置的第3年,即2020年6月上旬的生长季初期采集土壤样品。实验设置5个重复,对增温圈(NW)以及自然区(Nck)土壤进行采集。以5点取样法随机取样,同层土壤混匀后过2 mm筛,于10 mL的EP管保存土壤样品,置于液氮罐中保鲜,用于土壤产甲烷菌的高通量测序。
1.1.3 试剂与仪器 PowerSoil DNA提取试剂盒(MoBio公司);AxyPrep PCR纯化试剂盒(Axygen公司)。PCR仪(ABI GeneAmp®9700,美国ABI公司);Illumina PE150测序仪(Illumina公司)。
1.2 方法
1.2.1 土壤总DNA提取及测序 PowerSoil DNA试剂盒提取土壤总DNA。检测合格的DNA样品经琼脂糖凝胶电泳分析DNA的纯度和完整性,AxyPrep PCR纯化提取的DNA,扩增过程用带Barcode序列的土壤产甲烷菌特异引物进行[40-41],即mcrA基因的正向引物 (GGTGGTGTMGGATTCACACARTAYGCWACAGC)以及反向引物 (TTCATTGCRTAGTTWGGRTAGTT),完成文库的制备。文库构建完成后,稀释文库至 2 ng/μL,随后检测文库是否符合预期,最后对文库的有效浓度进行准确定量(文库有效浓度>3 nmol/L),以保证文库质量。库检合格后,按照有效浓度及目标下机数据量的需求进行Illumina PE150测序。
1.2.2 数据分析 经高通量测序得到原始数据 (Raw Data),PANDASEQ拼接[42]、PRINSEQ质控过滤[43]、CD-HIT去冗余[44]获得有效数据(Clean Data)。优化序列基于proGenomes(http://progenomes.embl.de/)数据库经UCLUST[45]软件以97%的相似度聚类得到操作分类单元(operational taxonomic units,OTU)数目以及韦恩图,同时生成不同分类水平的物种丰度表。Mothur软件[46]评估α-多样性,Qiime[47]分析β-多样性。多因素方差分析采用SPSS 21.0进行ANOVA分析,检验各分组间数据的显著性。
2 结果与分析
2.1 鸟岛土壤产甲烷菌OTUs分布
高通量测序结果显示,鸟岛土壤产甲烷菌OTU数为679个。韦恩图表明(图1),不同分组间共有的OTU数目为597个,增温处理土壤 (NW) 的特有OTU数目为43个,自然状态土壤的特有OTU数目较少,为39个。表明温度升高对鸟岛土壤产甲烷菌的种类有一定的影响。
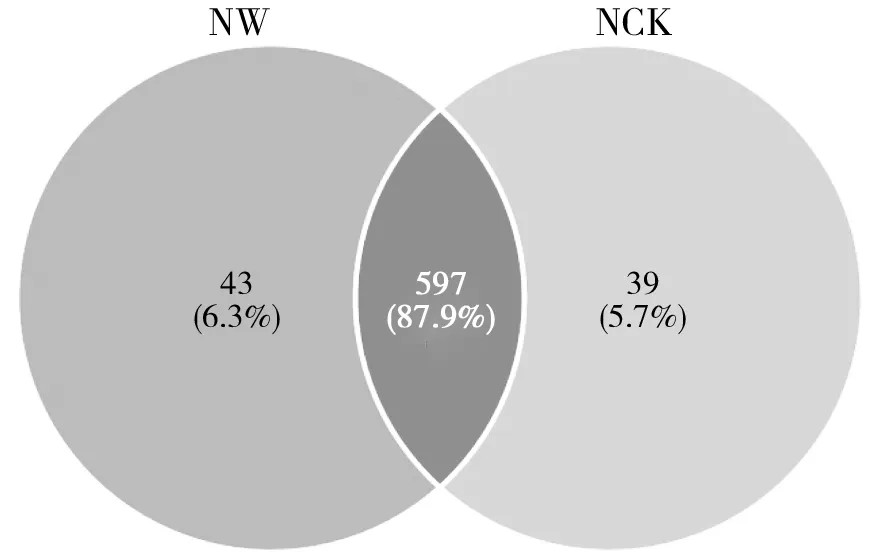
图1 鸟岛土壤产甲烷菌群落韦恩图Fig.1 Venn diagram of methanogenic bacteria community in the soil of Bird Island
2.2 鸟岛土壤产甲烷菌群落Alpha多样性
基于多样性指数构建样品稀释性曲线,验证测序数据量的合理性。图2A表明,绝大多数样品的稀释曲线趋于平缓,表明土壤产甲烷菌的测序量使得多样性指数变化趋于饱和,再次增加测序深度后,多样性指数不会大幅波动,测序深度足以进行后续分析。
多样性指数可以反映群落的丰富度以及均匀度(图2B)。鸟岛土壤产甲烷菌群落的多样性指数包含Observe指数(范围为314~559)、ACE指数(范围为329~565)、Chao1指数(范围为335~564)、Simpson指数(范围为0.961 3~0.971 8)、Shannon多样性指数(范围为4.257 7~4.423 2)。ANOVA方差分析显示,温度升高对土壤产甲烷菌的群落多样性没有显著影响 (P>0.05)。从整体上看,温度升高后,鸟岛土壤产甲烷菌群落丰富度指数(Observe、ACE、Chao1)均小幅度下降,群落Simpson及Shannon多样性指数也小幅度下降,表明温度升高对鸟岛土壤产甲烷菌群落的多样性存在一定程度的影响,产甲烷菌种类减少,群落均匀度降低。
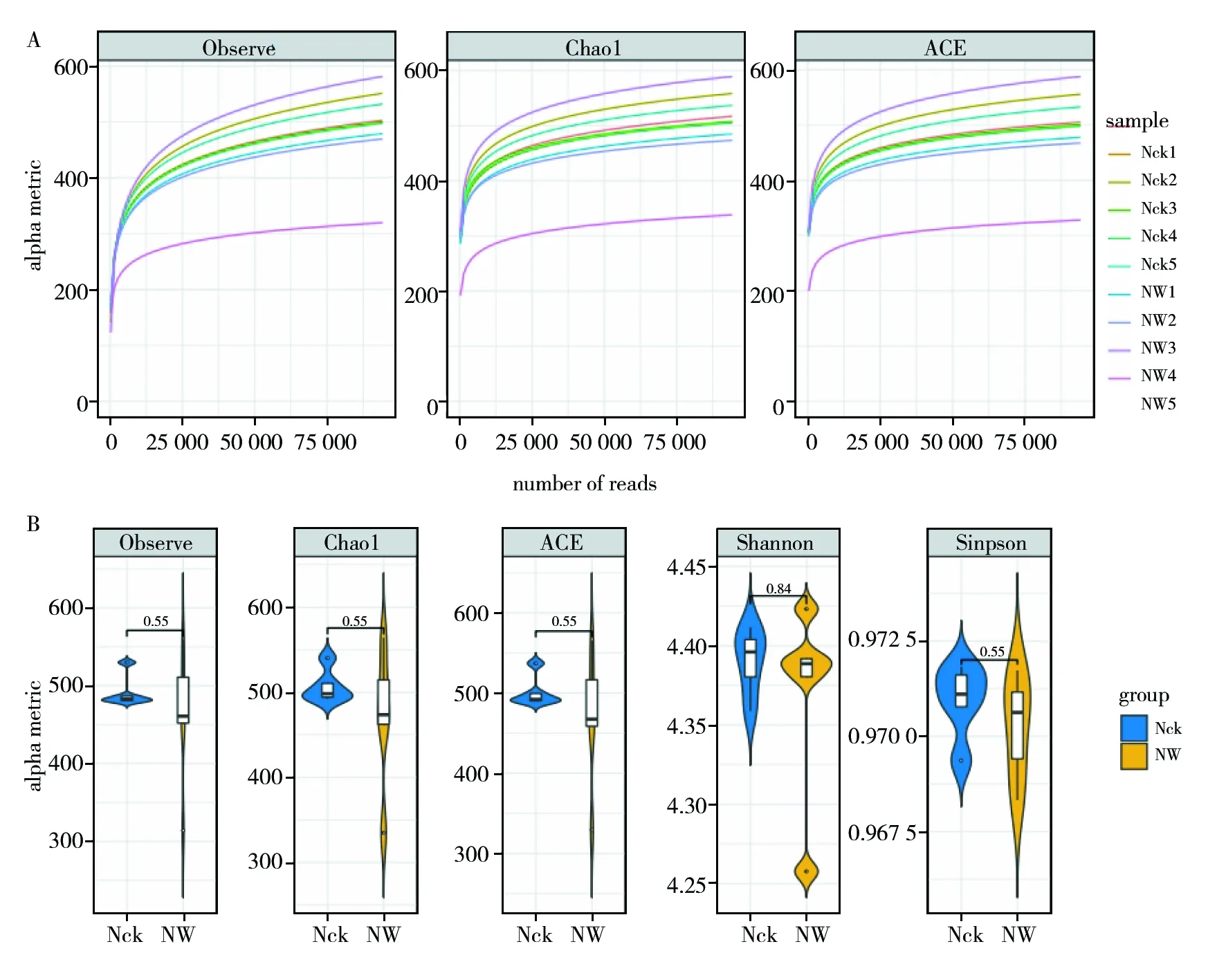
图2 样品稀释性曲线 (A) 及产甲烷菌群落多样性指数 (B)Fig.2 Dilution curve of samples (A) and diversity index of methanogenic bacteria community (B)
2.3 鸟岛土壤产甲烷菌群落结构组成
鸟岛产甲烷菌均属于广古菌门,其目水平有甲烷微菌目 (Methanomicrobiales)、甲烷八叠球菌目 (Methanosarcinales)、甲烷杆菌目 (Methanobacteriales)、 Methanomassiliicoccales以及甲烷孢菌目 (Methanocellales)。鸟岛土壤的优势产甲烷菌为甲烷微菌目、甲烷八叠球菌目及甲烷杆菌目,相对丰度占比分别为66.90%、14.36%、10.30%。鸟岛属水平产甲烷菌(图3A)以相对丰度占比为69.18%的菌群为分类学上的未分类菌群,已知菌群中,存在9个相对丰度大于0.1%的产甲烷菌菌群,分别为甲烷丝菌属(Methanothrix,13.13%)、甲烷细菌属(Methanobacterium,9.98%)、Methanomassiliicoccus(3.75%)、CandidatusMethanogranum(1.59%)、Methanoregula(0.79%)、甲烷八叠球菌属 (Methanosarcina,0.77%)、甲烷胞菌属 (Methanocella,0.37%)、Methermicoccus(0.17%) 以及甲烷泡菌属 (Methanofollis,0.14%),其中前4个菌群的相对丰度较高,均大于1%。
PCoA分析中,横轴的PC1和纵轴的PC2分别解释了土壤产甲烷菌群落变异的31%和25%,总解释率为56%(图3B)。与对照相比,增温处理后的土壤产甲烷菌群落发生了明显变化。增温处理的土壤样品较为分散,可能是由于温度升高增加了鸟岛土壤的异质性,土壤环境因子相互作用引起了土壤产甲烷菌群落变化。
2.4 鸟岛土壤产甲烷菌菌群LEfSe分析
温度升高影响了鸟岛产甲烷菌群落,为寻找增温处理后产生的与自然状态具有统计学差异的Biomaker,本研究采用LEfSe分析发现分组间的高维生物标识并揭示基因组特征。结果表明,自然状态 (Wck) 与增温处理 (WW) 间的土壤产甲烷菌群落存在35个差异菌群(图4)。大多差异菌群为属水平及种水平菌群,纲水平和目水平差异菌群数均为2个,科水平差异菌群为3个。Wck中相对丰度较高的差异菌群为热原体纲 (Thermoplasmata)、Methanomassiliicoccales目、Methanomassiliicoccaceae科;WW中相对丰度较高的差异菌群为甲烷微菌纲 (Methanomicrobia)、八叠球菌目、甲热球菌科(Methermicoccaceae) 以及 Methanotrichaceae科。整体上看,温度升高显著影响了鸟岛产甲烷菌的群落结构,纲水平到种水平的部分菌群相对丰度均变化显著。
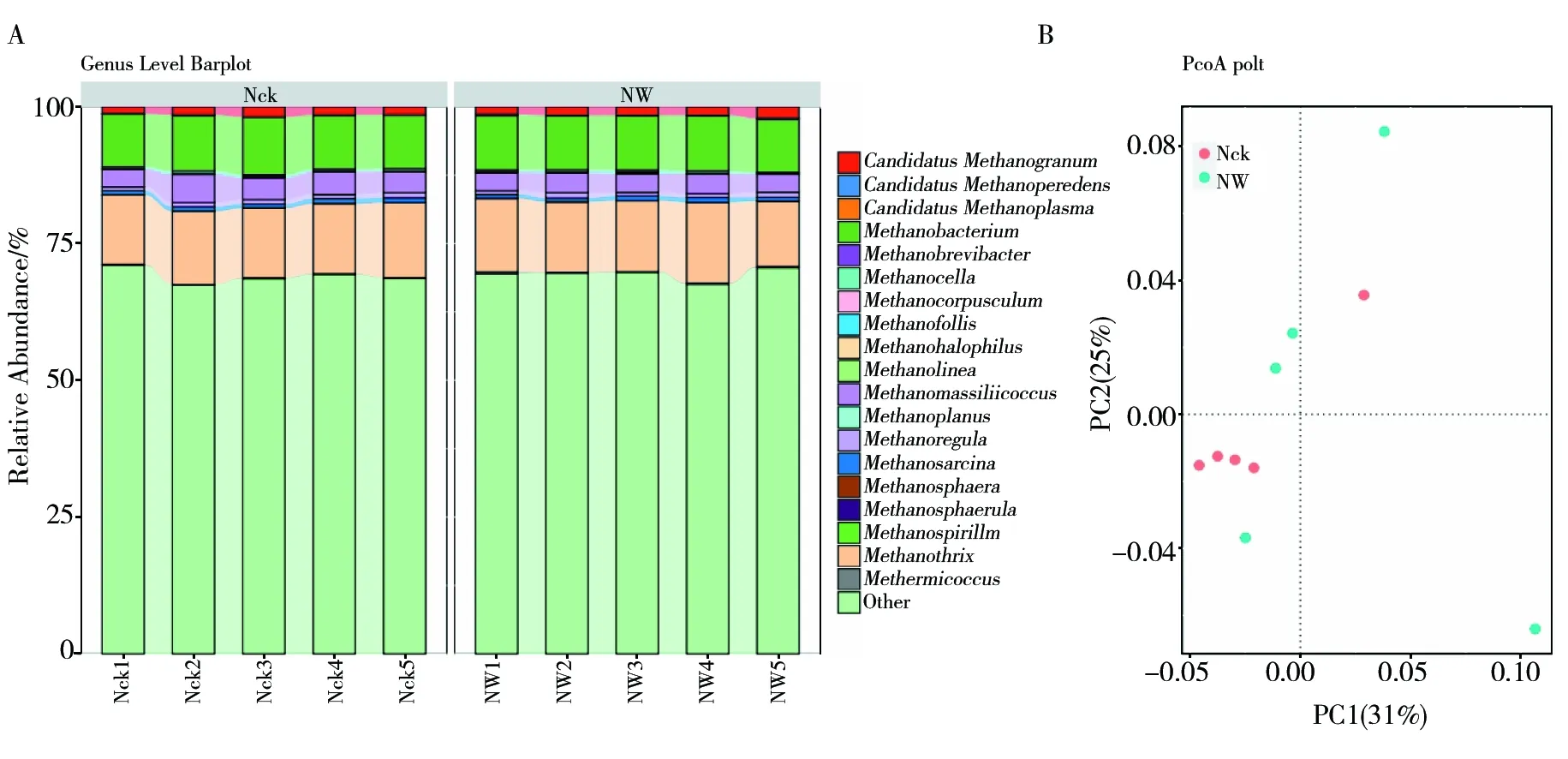
图3 土壤样品属水平产甲烷菌群落组成 (A) 及PCoA主坐标分析 (B)Fig.3 Community composition of horizontal methanogenic bacteria in soil samples (A) and Principal Coordinate analysis of PCoA (B)
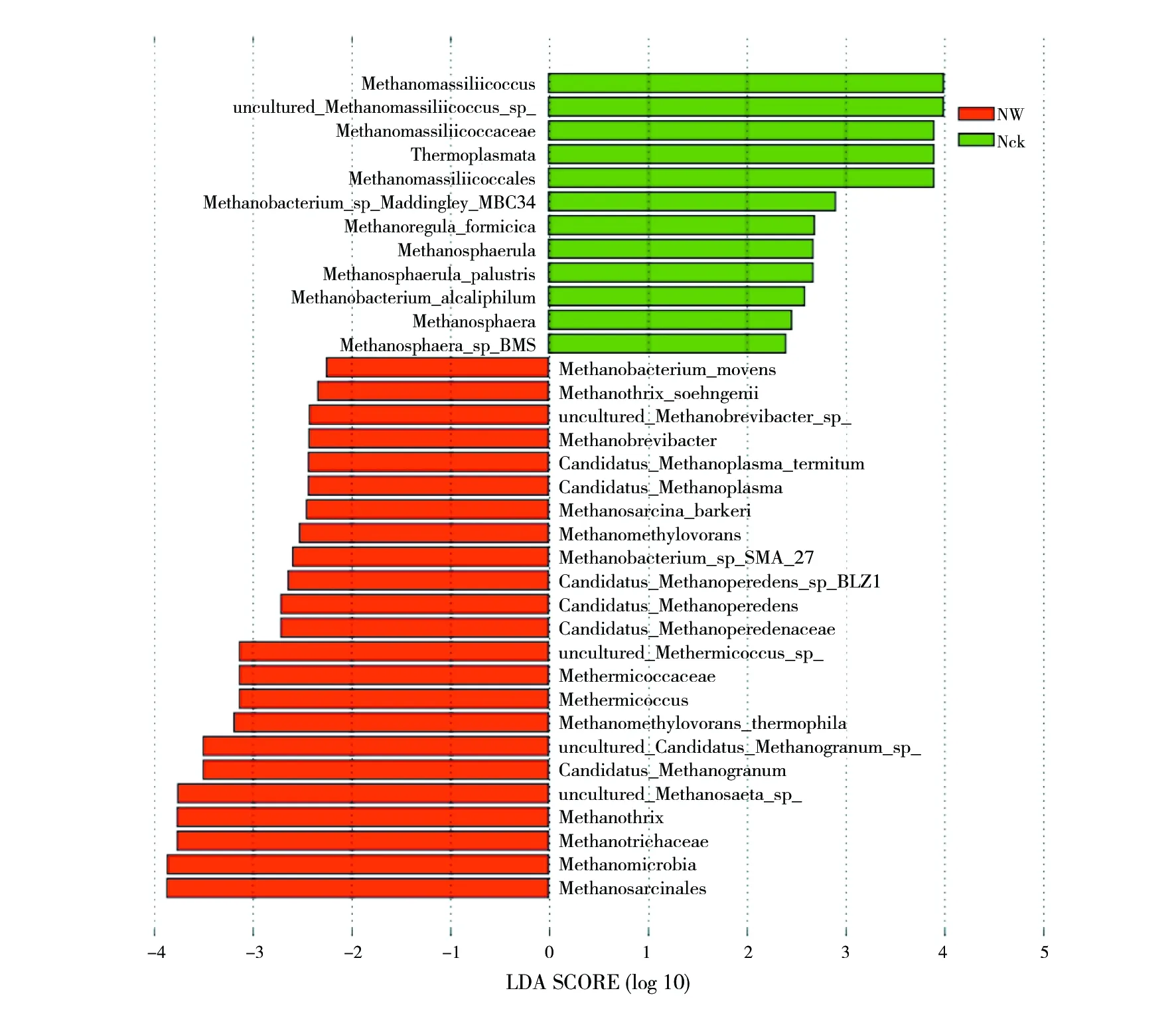
图4 土壤产甲烷菌LEfSe分析Fig.4 Lefse analysis of soil methanogens
2.5 鸟岛土壤产甲烷菌群落FAPROTAX功能预测
利用FAPROTAX预测鸟岛土壤产甲烷菌的生态功能,结果表明产甲烷菌共存在15个功能基团(图5)。大多产甲烷菌的功能基团为甲烷生成 (Methanogenesis,33.51%)、氢营养型甲烷化 (Hydrogenotrophic methanogenesis,28.67%) 以及氢还原二氧化碳生成甲烷 (Methanogenesis by CO2reduction with H2,26.72%),另有部分功能基团为暗氢氧化 (Dark hydrogen oxidation,3.82%)、化能异养 (Chemoheterotrophy,2.44%)、氢还原甲基化合物生成甲烷 (Methanogenesis by reduction of methyl compounds with H2,2.12%)、甲基营养 (Methylotrophy,2.12%)。温度升高对鸟岛土壤产甲烷菌的功能没有显著影响 (P>0.05)。表明鸟岛土壤产甲烷菌群落的功能结构较为稳定,大多产甲烷菌均利用H2/CO2的氢营养型途径产生甲烷。
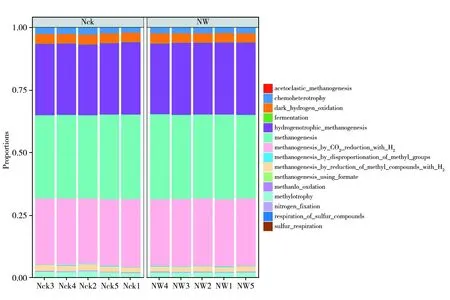
图5 产甲烷菌群落FAPROTAX功能预测Fig.5 Prediction of FAPROTAX function of methanogens community
3 讨 论
温度变化直接或间接地影响着土壤微生物群落[28-29],作为第二大温室气体,甲烷的生成与产甲烷菌有着密切的关系[37-38]。本研究通过研究温度升高对鸟岛土壤产甲烷菌群落特征的影响,来探究鸟岛湖滨湿地土壤产甲烷菌群落对气候变暖的响应。结果表明,鸟岛土壤产甲烷菌以甲烷微菌目、甲烷八叠球菌目及甲烷杆菌目为优势菌群,这与前人对湿地产甲烷菌群落的研究结果一致[48-50]。温度升高并未显著改变鸟岛土壤产甲烷菌的群落多样性,产甲烷菌群落的多样性指数均小幅度下降,不存在统计学上的显著差异。前人对温度变化影响产甲烷菌群落多样性的结论各异,部分研究表明产甲烷菌群落丰富度与甲烷排放呈显著正相关,随温度升高显著增加[51];另有研究表明,增温显著降低了产甲烷菌群落的丰富度及香农多样性指数[52];这种差异可能是由于空间异质性以及模拟增温的幅度不同所致。Peltoniemi等[53]研究表明,温度上升后产甲烷菌群落相似,与本研究的结论一致。LEfSe分析结果表明,增温处理与自然状态的土壤产甲烷菌纲水平到科水平的差异菌群数量分别为2、2、3。增温处理显著增加了甲烷微菌纲、八叠球菌目、甲热球菌科以及Methanotrichaceae的相对丰度,显著降低了热原体纲、Methanomassiliicoccales、Methanomassiliicoccaceae的相对丰度。表明自然状态与温度升高后土壤的特征产甲烷菌不同,温度升高显著影响了鸟岛产甲烷菌群落结构,改变了部分产甲烷菌群的相对丰度,这与Hφj等[54]对北极泥炭中产甲烷菌群落的研究结果一致。也有前人研究表明温度上升后产甲烷菌群落相对丰度有所下降,甚至有研究表明产甲烷菌群落结构与温度几乎没有关系[52]。这可能受土壤的异质性以及环境因素交互影响得出了不同结论。鸟岛土壤产甲烷菌的FAPROTAX功能预测出15个功能基团,大多产甲烷菌的功能基团为甲烷生成、氢营养型甲烷化以及氢还原二氧化碳生成甲烷,表明大多产甲烷菌利用H2/CO2的氢营养型途径产生甲烷。
本研究初步探究了青海湖鸟岛产甲烷菌群落的结构以及多样性对温度升高的响应,为鸟岛湖滨湿地甲烷循环机制的探究提供参考,并提高对全球气候变化的前瞻性。未来可对土壤含水量、pH值、电导率等土壤理化性质与鸟岛土壤产甲烷菌群落的相互关系进一步研究,从而更加深入地探讨湖滨湿地的甲烷循环驱动机理。