养殖水温对吉富罗非鱼幼鱼血清和肝脏1H-NMR代谢组的影响
2022-02-23曾楠楠喻丽娟
曾楠楠,蒋 明,文 华,田 娟,陆 星,吴 凡,喻丽娟
(1.上海海洋大学水产科学国家级实验教学示范中心,上海 200120;2.中国水产科学研究院长江水产研究所,武汉 430223)
罗非鱼是一种著名的热带养殖鱼类,是水产养殖中产量位居世界第二的淡水鱼。罗非鱼的生活适宜温度为26~29 ℃。当前温度对罗非鱼影响的研究大多集中在对其生长的影响上。关于温度对罗非鱼代谢机制的影响还未完全探明,需要进一步研究。
作为后基因组时代的产物,代谢组学是对生物样品多组分混合物的定量分析,重点是建立生命系统的病理生理刺激或遗传改变的代谢反应,来自体液或组织的大量小分子代谢物可被一步定量检测。近年来,代谢组学平台也应用于鱼类研究范畴,如ASAKURA等基于核磁共振的代谢组学方法评估了饲料类型对鱼类-微生物共生生态系统中共代谢调节的影响;WEI等通过运用NMR代谢组技术探讨了鱼粉的替代物对大鲮鲆(L.)的作用机制;蒋明等在对团头鲂的探讨中,运用H-NMR的代谢组学技术揭示了微量元素锌对其代谢的影响。在这些研究中,基于核磁共振的代谢组学方法被用于揭示营养与鱼类代谢状态的关系。与此同时,代谢组学也开始被用于探究温度对鱼类代谢机制的影响,如KULLGREN等利用基于H-NMR的代谢组学分析大西洋鲑鱼()血浆的结果显示,高温诱导了谷氨酰胺,酪氨酸和苯丙氨酸的下降和脂质代谢的转变。本研究应用H-NMR组学方法检测分析了在三种温度条件下饲养8周后吉富罗非鱼(,)的血清和肝脏代谢物,探究水温对罗非鱼生理代谢影响的作用机制,以期为罗非鱼养殖提供理论依据。
1 材料与方法
1.1 试验饲料与养殖管理
实验鱼购自广西罗非鱼国家级育种试验场,暂养2周后将大小均匀活泼健康的吉富罗非鱼随机分配至9个养殖桶中,每桶20尾。采用电加热系统和水空调控温,在22、28、34 ℃三个养殖水温下,以试验饲料投喂初始平均体质量为(38.75±0.61) g的吉富罗非鱼8周。投喂的半纯化饲料配方见表1,每日在8:30、12:30和16:30人工投喂3次,30 min内表观饱食投喂并记录每日投喂量。将22、28和34 ℃温度组分别标记为低温(LT)、适温(MT)和高温(HT)组。饲养期间pH 7.4~7.6,溶氧保持5.0 mg/L以上,自然光照周期,每日早上对循环水系统进行反冲洗,更换5%左右的新水,控制水温波动在1 ℃之内,并清除养殖桶内粪便。
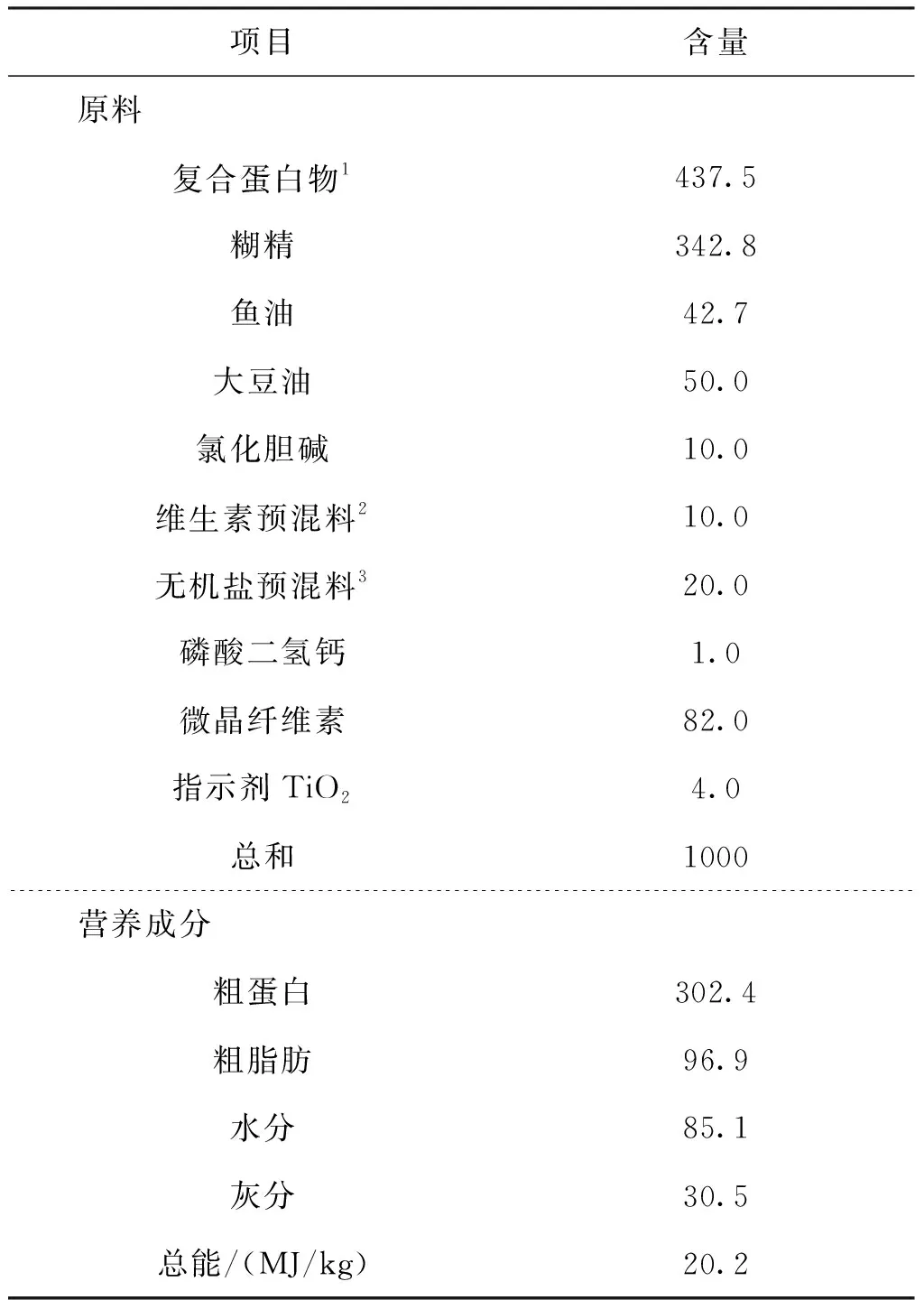
表1 实验饲料配方及营养成分Tab.1 Formulation and proximate analysis of the experiment diet g/kg
1.2 实验样品制备和测定
8周的饲喂实验结束后,将鱼禁食24 h,记录每个养殖桶内吉富罗非鱼的尾数和终末体质量,统计实验期间消耗的饲料质量。在每个养殖桶中随机取3尾鱼测量体重和体长,然后通过尾部静脉抽取血样存放于离心管,在常温下静置30 min后在离心机上离心(3 000 r/min,10 min),将得到的血清冻存在-80 ℃冰箱中。常规解剖分离出三尾实验鱼的内脏和肝脏等称其质量,并将部分肝脏标本冻存在液氮中。肝脏和血清的代谢产物均采用H-NMR代谢组方法定量和定性。
1.3 血清和肝脏1H-NMR代谢物检测
将冷冻干燥的肝脏样品粉末称重50 mg并加入1 000 mL纯水,涡旋1 min,使用4秒开/3秒关循环程序(8个循环)(Sonic VX-130,USA)在冷水浴中进行32秒超声提取。将样品离心(4 ℃,13 000 r/min)15 min后,将水膜转移到0.5 mL 3 kDa超滤膜离心过滤器(Millipore,USA)中离心(4 ℃,13 000 r/min)45 min后收集滤液。取450 μL澄清透明滤液放于新编号的2 mL离心管,加入50 μL DSS试剂(Anachro,Canada)后涡旋10秒,然后在4 ℃、13 000 r/min条件下离心2 min。将480 μL上清液置于5 mm的核磁共振管中(Norell,USA)。使用AV600MHz光谱仪收集光谱(采集参数见表2)。利用2D-1H、1H-NOESY脉冲序列的第一个增量获得H-NMR数据并抑制溶剂信号。实验分析了混合时间100 ms以及990 ms的预饱和度。在25 ℃下收集光谱并在15 min内共扫描128次。血清样品解冻后无需加纯水,涡旋30秒后离心(4 ℃,13 000 r/min)2 min,取上清液700 μL于超滤膜离心过滤离心(4 ℃,13 000 r/min)65 min收集滤液,而后的采集步骤与肝脏样品一致。
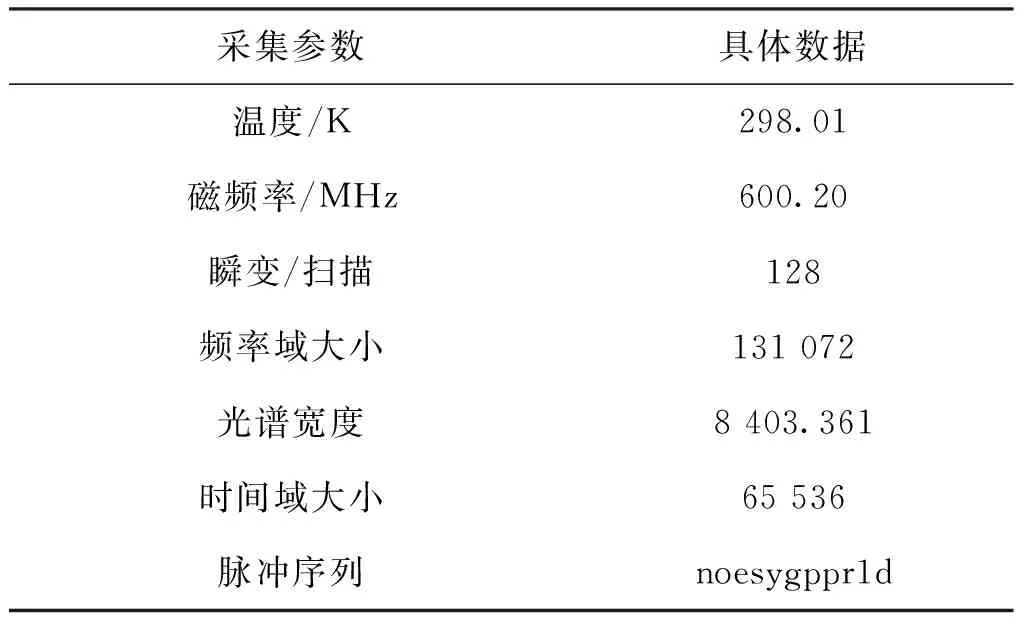
表2 核磁数据采集参数Tab.2 Acquisition parameters and data of 1H-NMR
1.4 数据处理与分析方法
本实验使用Chenomx NMR suit软件,把H-NMR自由感应衰减(FID)信号导入后开始傅里叶变换、相位调整和基线校正。DSS峰值(0.0 ppm)为所有光谱化学位秱标准,开始反卷积操作,调整色谱峰峰形(CSI)。按照H-NMR光谱信号的峰形、化学位秱、耦合裂分、半峰宽等有效信息,依据谱峰面积和DSS浓度,联合Chenomx自带数据库对实验样本的光谱信号一一进行比较分析,得到样本中差异的代谢产物和相应的绝对密度。将得到的代谢物和它们的绝对浓度含量传到EXCEL表格中,就会出现一个变量矩阵。这个变量矩阵即是后面进行PCA和PLS-DA分析的数据来源。主成分分析(principal component analysis,PCA)和偏最小二乘判别分析(partial least-squares discrimination analysis,PLS-DA)是运用R语言分别通过PCA方法Bioconductor package和PLS package进行分析,并通过ggplot2 package来实现可视化。
数据均以平均值±标准差表示,在SPSS 19.0统计软件中运用单因素方差分析(ANOVA)和Tukey′s检验确定结果的差异显著性,当<0.05时,表示差异显著。
2 结果与分析
2.1 温度对实验鱼生长性能的影响
不同温度条件下饲养8周后吉富罗非鱼的生长性能和饲料利用率见表3。可以看出,养殖水温显著影响实验鱼的终末体质量、增重率和饲料系数。其中28 ℃条件下的实验鱼的生长表现最好,显著优于22 ℃,与34 ℃的实验鱼无显著差异;饲料系数在22 ℃条件下出现最大值且显著高于其他两组,而另外两组之间无明显差异。养殖水温对实验鱼的肝体指数(HIS)也有显著影响,MT组的肝体比明显高于其余两组,而LT和HT组之间无显著差异;三组实验鱼的脏体比(VSI)之间均无显著差异。

表3 吉富罗非鱼不同温度下生长表现Tab.3 Growth performance of O.niloticus at different temperatures
2.2 样本代谢物谱图及代谢物种类
将实验中肝脏和血清样本的谱图信号按照Chenomx 软件数据库进行比较分析,获得的代谢物分别45种(见图1)和47种(见图2)。除仅肝脏中含有4-氨基丁酸酯、烟酸、泛酸、牛磺酸、尿素等16种代谢物和血清中含有的精氨酸、二甲胺、乙醇、甲酸酯、甘氨酸、异丁酸酯、T-甲基组氨酸、丙酮酸、肌氨酸、三甲胺N-氧化物、肌醇和反式-4-羟基-L-脯氨酸等17种代谢物外,实验中大部分定量和定性的代谢物在肝脏和血清之间是相同的,共有代谢物包括14种氨基酸及其衍生物,2种胺和胺化合物,5种有机酸,6种核酸组分,2种糖类(葡萄糖、甘露糖等)和1种其他组分(泛酸等)。醇类(乙醇、肌醇)代谢物仅在血清中检测出。
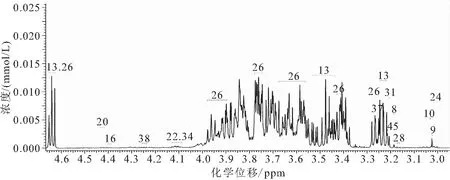
图1 吉富罗非鱼肝脏样本信号归属片段Fig.1 Signal assignment spectrum of liver from O.niloticus
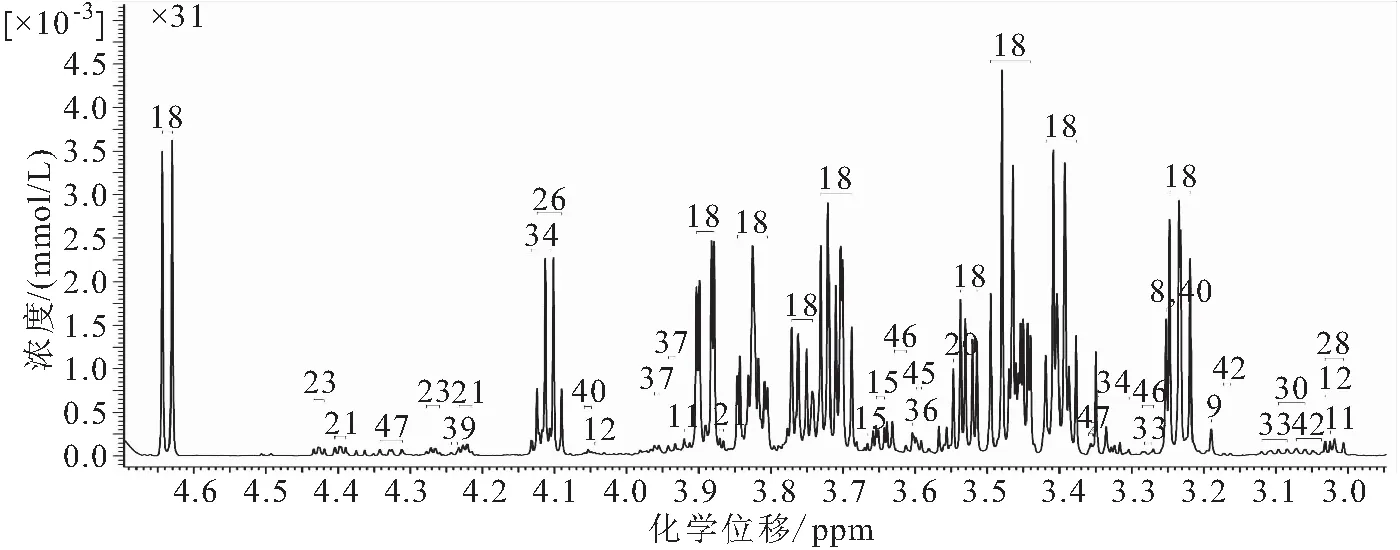
图2 吉富罗非鱼血清样本信号归属片段Fig.2 Signal assignment spectrum of serum from O.niloticus
2.3 血清PLS-DA和VIP分析
2.3.1 PLS-DA和PLS载荷分析
图3A1为实验鱼血清样本的PLS-DA结果图,如图所示,同组实验样本聚集在一起,这表明同组内样本的重复性可靠,变异较小;三组样本在主成分2方向上有分开的趋势,可推测主成分2方向上三个实验组中血清样本的代谢轮廓有差异;而在主成分1方向上所有实验组未分离,表明实验鱼在主成分1方向上代谢轮廓相似。图3A2为血清样本PLS载荷图,可以看出:葡萄糖、乳酸、丙氨酸等代谢物在区分不同样本间中发挥了重要作用。
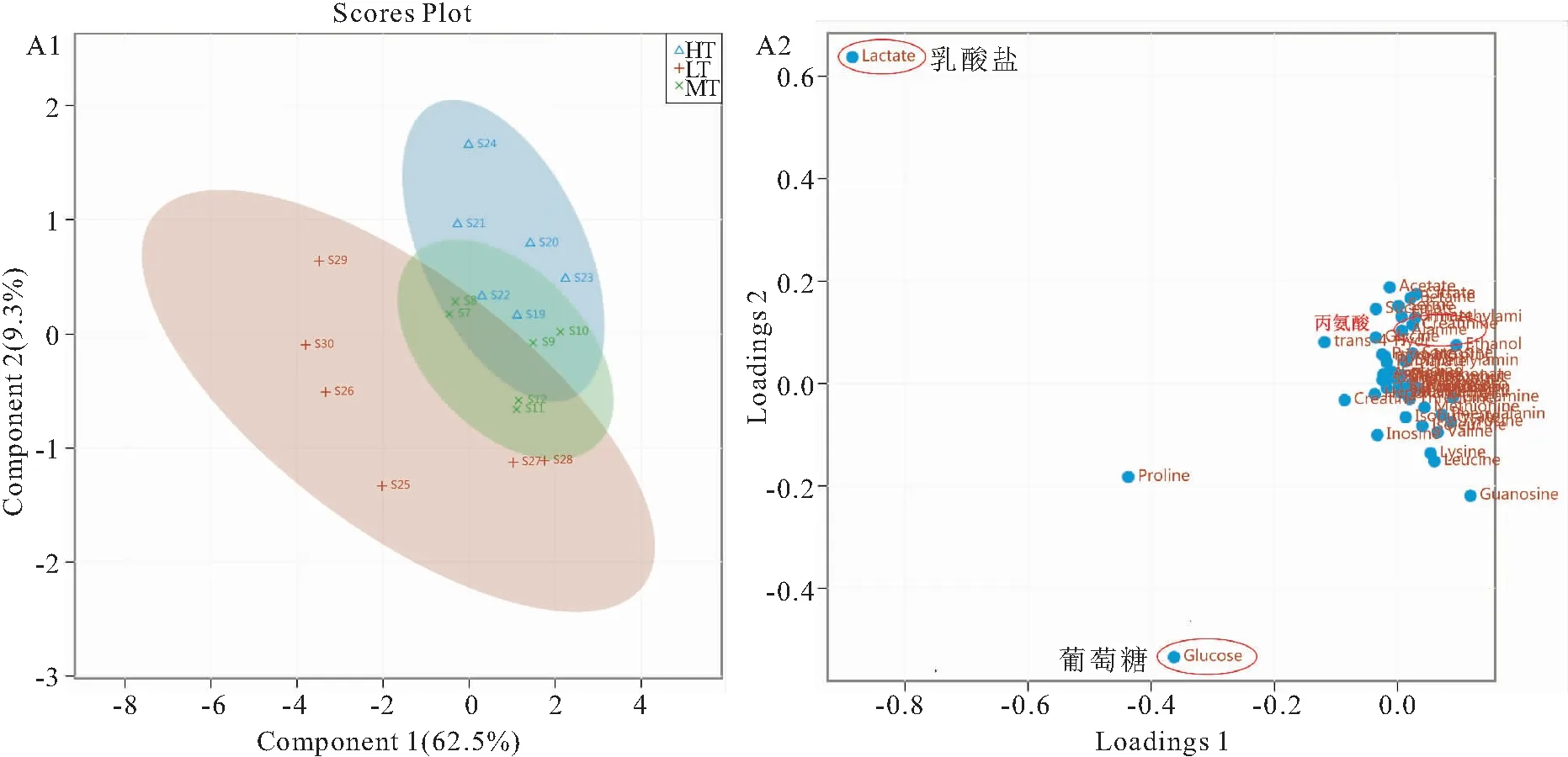
图3 来自LT、MT和HT组之间的吉富罗非鱼血清样本1H-NMR光谱得到的PLS-DA得分图(A1)和PLS-DA载荷图(A2)Fig.3 PLS-DA score plot (A1) and loading plot (A2) derived from 1H-NMR spectra of serum of O.niloticus
2.3.2 VIP差异代谢物分析
图4B1为三组实验鱼血清样本VIP得分图,如图所示,血清中第一重要差异代谢物为乳酸,剩余14种差异代谢物依次为脯氨酸、葡萄糖、柠檬酸、反式-4-羟基、乙醇、肌酸、亮氨酸、甜菜碱、缬氨酸、谷氨酰胺、三甲胺、甘露糖、酪氨酸和肌酐。对PLS-DA分析得到的VIP值大于1的代谢物进行ANOVA分析发现,血清中脯氨酸的浓度在三组间差异显著(图3-4B2)。HT组的血清柠檬酸、乙醇、甜菜碱、谷氨酰胺、三甲胺和肌酐显著高于其他两组;LT组的血清中除乳酸、脯氨酸、葡萄糖、反式-4-羟基、肌酸、亮氨酸和缬氨酸高于其他两组外,其余代谢物浓度均显著低于其他两组;而MT组血清中的甘露糖和酪氨酸浓度显著高于其他两组(见表4)。
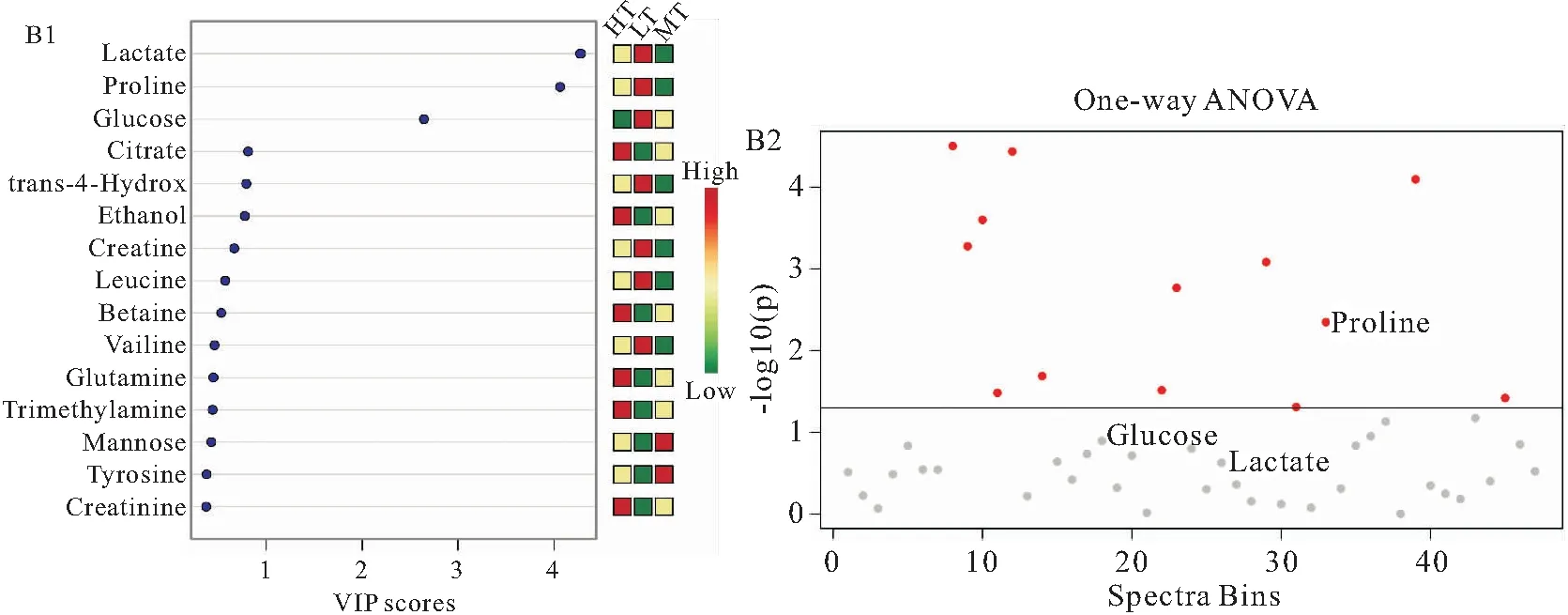
图4 来自LT、MT和HT组之间的吉富罗非鱼血清样本1H-NMR光谱得到的VIP得分图(B1)和PLS-DA分析得到的VIP值大于1的代谢物的ANOVA分析图(B2)Fig .4 VIP score plot (B1) and ANOVA analysis chart (B2) of metabolites with VIP value greater than 1 obtained by PLS-DA analysis derived from 1H-NMR spectra of blunt snout bream of O.niloticus
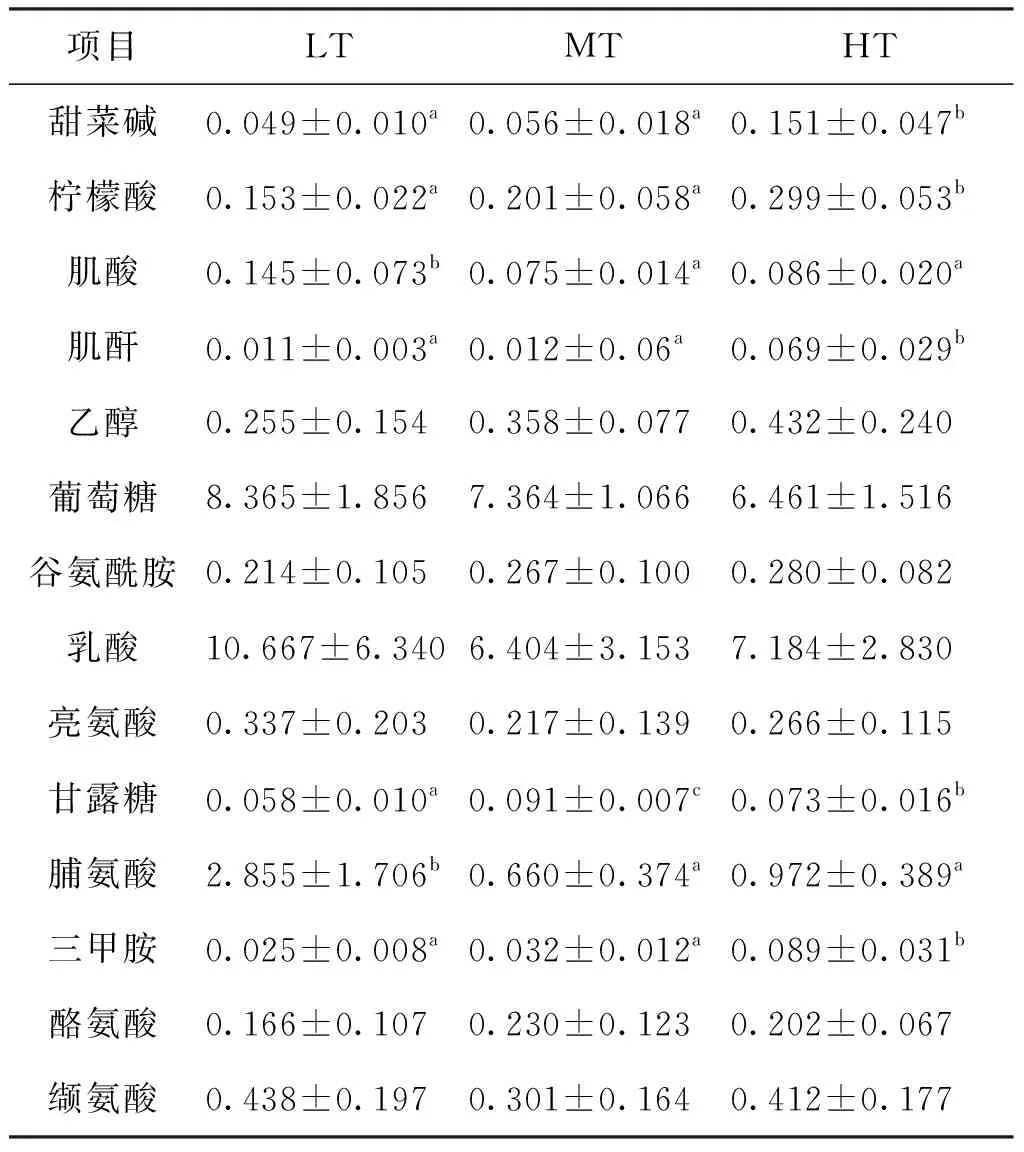
表4 血清差异代谢物列表及浓度Tab.4 List and concentration of serum differential metabolites mmol/L
2.4 肝脏PLS-DA和VIP分析
2.4.1 PLS-DA和PLS载荷分析
图5C1为肝脏样本PLS-DA得分图,结果显示,同组实验样本聚集在一起,表明平行样本间重复度高,变异较小;而LT组和另外两组的实验样本在主成分1方向上显示分离,表明在此方向上LT组实验鱼的代谢轮廓与其他两组较为不同;在主成分2方向上,实验样本基本相近,表明在该方向上三组实验鱼的代谢轮廓较为相似。图5C2为三个实验组肝脏样本PLS载荷图,可以看出:葡萄糖、麦芽糖等代谢物在样本间的区分中做出了重要贡献。

图5 来自LT、MT和HT组之间的吉富罗非鱼肝脏样本1H-NMR光谱得到的PLS-DA得分图(C1)和PLS-DA载荷图(C2)Fig.5 PLS-DA score plot (C1) and loading plot (C2) derived from 1H-NMR spectra of liver tissue of O.niloticus
2.4.2 VIP差异代谢物分析
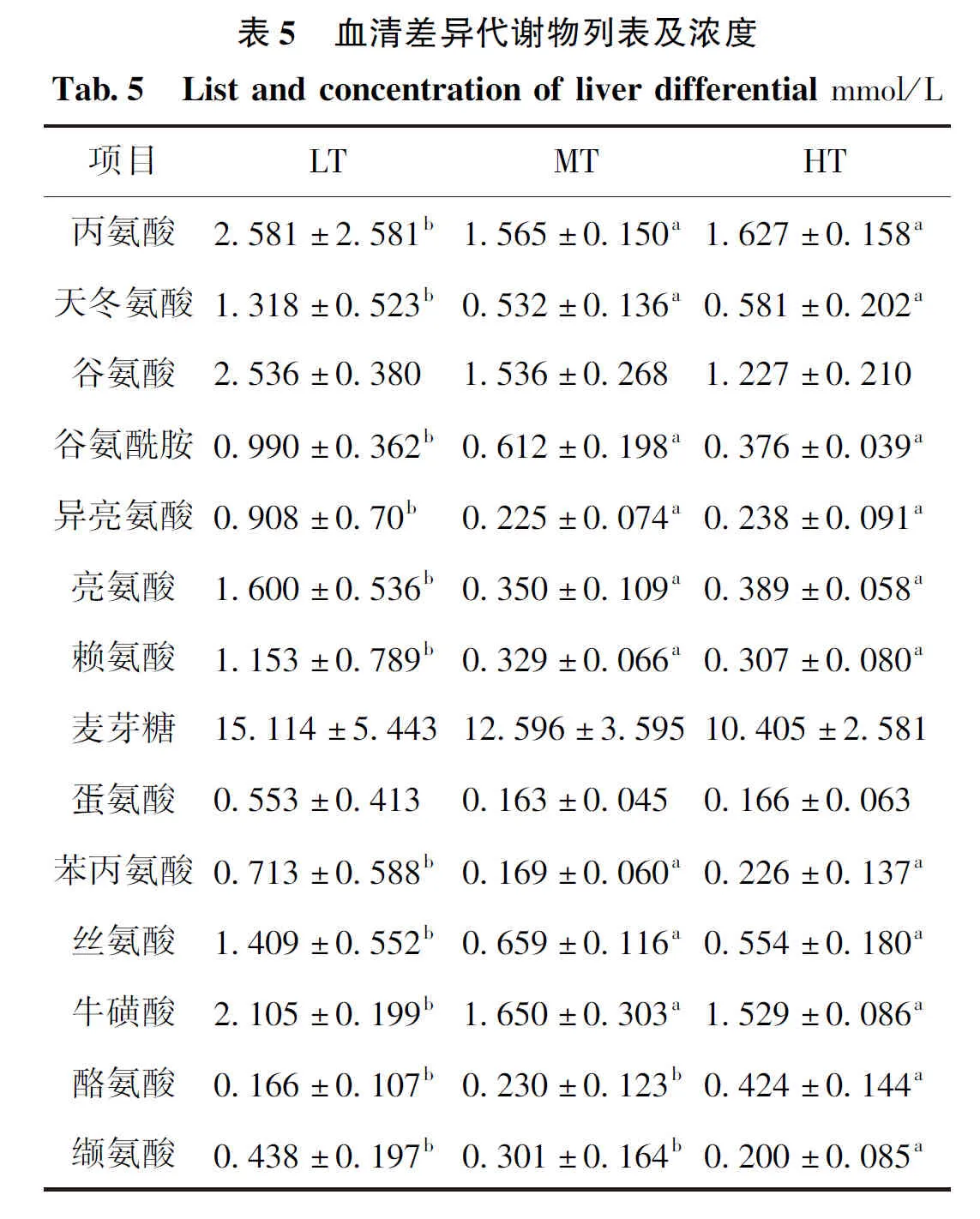
图6D1为三组实验鱼肝脏样本VIP图,如图所示,肝脏中第一重要的差异代谢物为麦芽糖,剩余14种主要差异代谢物均为氨基酸及氨基酸衍生物。对三组代谢物进行ANOVA分析发现,PLS-DA分析得到的VIP值大于1的代谢物除麦芽糖外,其余代谢物浓度各组间差异均显著(图6D2)。LT组的肝脏中15种差异代谢物浓度均高于其他两组;MT组的肝脏中除麦芽糖、谷氨酸盐、赖氨酸、丝氨酸、谷氨酰胺、牛磺酸和苏氨酸浓度高于HT组外,其余差异代谢物浓度均低于HT组(见表5)。

图6 来自LT、MT和HT组之间的吉富罗非鱼肝脏样本1 H NMR光谱得到的VIP得分图(D1)和PLS-DA分析得到的VIP值大于1的代谢物的ANOVA分析图(D2)Fig.6 VIP score plot (D1) and ANOVA analysis chart (D2) of metabolites with VIP value greater than 1 obtained by PLS-DA analysis derived from 1H-NMR spectra of liver tissue of O.niloticus
3.1 水温对吉富罗非鱼肝脏代谢组的影响
在肝脏组织中,LT、MT和HT组的15种主要差异代谢物中,有13种是氨基酸或者氨基酸代谢中间物,这充分说明温度对吉富罗非鱼氨基酸代谢具有显著的影响。类似地,ZHAO等指出高温应激吉富罗非鱼,主要影响的是其氨基酸代谢通路。与MT组相比较,HT组和LT组实验鱼中的亮氨酸、精氨酸、缬氨酸、异亮氨酸等8种氨基酸的浓度明显升高,其中亮氨酸、缬氨酸和异亮氨酸为支链氨基酸(BCAA),BCAA可通过扩大TCA(三羧酸循环)中间体(anaplerosis)和进入糖异生等途径来促进能量代谢,其余5种氨基酸也均可通过生糖促进TCA循环。这意味着高温和低温条件下吉富罗非鱼体内氨基酸会通过代谢生成葡萄糖产生能量,进而降低氨基酸利用率。而关于实验鱼肝脏中牛磺酸的含量,LT组中浓度最高、MT组次之,HT组中浓度最低,这表明温度会显著影响鱼体肝脏中牛磺酸代谢。
由宾石玉等研究发现当水温降至15 ℃,埃及尼罗罗非鱼肝脏、脾脏开始出现溶解的现象;TASCI等研究发现喂食牛磺酸可以改善鼠的肝损伤和肝脏纤维化。由此可以推断LT组牛磺酸浓度显著升高可能是一种响应机制,因为长时间的低温环境导致吉富罗非鱼的肝脏受损。同时,LT组中麦芽糖、谷氨酰胺、谷氨酸浓度也最高,MT组次之,HT组最低。谷氨酰胺通过谷氨酸可作为TCA循环中间体α-酮戊二酸的前体。LT组中麦芽糖、谷氨酰胺和谷氨酸的升高进一步证实在低温条件下吉富罗非鱼糖代谢会增强且能量升高。且与前面低温导致吉富罗非鱼肝脏受损的假设一致,LT组谷氨酰胺含量显著升高可提高机体的抗氧化能力,保护肝脏及免疫细胞以维持肝脏的正常功能。肝脏组织代谢物的结果表明温度显著影响吉富罗非鱼的氨基酸代谢和糖代谢通路,低温条件下吉富罗非鱼生长受限可能是由于不适宜的饲养温度会其降低对氨基酸的利用率;代谢组结果表明HT组条件下饲养的吉富罗非鱼的体内生理代谢具有显著变化,但HT组实验鱼的生长速度和饲料利用率虽与MT组无显著差异,可能是由于实验养殖时间较短还未反映到其表型上。
3.2 水温对吉富罗非鱼血清代谢组的影响
在血清中,LT、MT和HT组的第1差异物是乳酸。LT组实验鱼中乳酸浓度最高,HT组次之,MT组最低。血液中乳酸含量升高代表可能血液循环代谢有障碍。LT组中除乳酸外,葡萄糖、脯氨酸、反式-4-羟基、肌酸的含量也明显上升。血清中葡萄糖含量升高,意味着糖酵解增加并会影响某些氨基酸的代谢(如苏氨酸和酪氨酸),这与肝脏中代谢组得到的结果(低温条件下吉富罗非鱼糖代谢会增强且能量升高)相统一。过量的葡萄糖可以通过新的脂肪生成(DNL)作为糖原或脂肪酸储存在肝脏中,也可以作为磷酸肌酸储存,用于再生ATP的能量储备。具有细胞能量穿梭功能的肌酸是维持细胞能量稳态的关键组成部分。LT组鱼中观察到高肌酸水平可能是对低温压力的代谢反应,也可以解释低温条件下吉富罗非鱼增长率较低的原因。脯氨酸属于与抗感染相关的精氨酸和脯氨酸代谢,ZHAO等发现添加2 mg外源脯氨酸可使高温条件下吉富罗非鱼的死亡率由81%降至45%,而添加L-苏氨酸和L-天冬氨酸则未能提高存活率,表明脯氨酸与增强抗感染能力进而促进适应非适宜温度有密切关系,这与本实验的研究结果是一致的。
HT组中甜菜碱、谷氨酰胺、三甲胺和肌酐显著高于其他两组,而MT组高于LT组。有研究发现,鼠中添加甜菜碱后血浆中低密度脂蛋白(LDL)和甘油三酯含量升高;且有研究表明甜菜碱可以促进脂肪分解及脂肪酸氧化。三甲胺(TMA)是胆碱的代谢产物,可以作为蛋白质在高温下的稳定剂。由以上研究我们可以假设增加的TMA水平来源于胆碱代谢,是对高温的适应性反应,则血清中甜菜碱和三甲胺含量升高说明高温对脂质代谢、胆碱代谢也有一定的影响。
4 结论
综上所述可见,低温条件下,吉富罗非鱼糖代谢增强,氨基酸的利用率降低,进而影响罗非鱼的生长速度和饲料利用率;高温条件下饲养的吉富罗非鱼体内脯氨酸、三甲胺和甜菜碱等代谢物浓度升高,很可能是对高温的适应性反应,饲料中添加甜菜碱、脯氨酸、三甲胺等可能会增强罗非鱼在高温条件下的抵抗力。
