稻田养殖红螯螯虾个体大小与肠道菌群相关性研究
2022-02-23杨慧赞杨彦豪卢天和梁俊杰杨秋月
杨慧赞,吕 敏,杨彦豪,卢天和,童 潼,梁俊杰,杨秋月,张 琴,黄 峥,王 瑞
(1.广西壮族自治区水产科学研究院,广西水产遗传育种与健康养殖重点实验室,南宁 530021;2.广西民族大学海洋与生物技术学院,南宁 530006)
肠道微生物是最多样的微生物群,其对宿主的消化平衡、免疫防御和生理机能调节至关重要。水生动物体表和体内均存在有大量微生物,消化道作为营养物质消化吸收的场所,定殖了数量巨大、种类繁多的微生物,参与宿主多种生物进程。水生动物肠道微生物的稳定受水质、水温、天气、饲养模式和物种等多种因素影响。近几年,“组学”技术的发展,信息技术、数据分析软件包和存储系统的进步,有效促进了水产养殖动物肠道微生物研究。红螯螯虾()属十足目(Decapoda)拟螯虾科(Parastacidae)红螯螯虾属(),原产澳大利亚,因其具有体型大、繁殖力强、生长快,能耐受广泛的环境条件等特点,逐渐成为各国淡水龙虾的研究热门品种。通过对红螯螯虾肠道微生物进行研究,获得与其营养代谢、能量获取、生长性能等相关影响因子,可有效促进红螯螯虾养殖技术的进步。
目前有关红螯螯虾的研究主要集中于生物学、生理学、水产养殖和生产等相关研究,还未见其肠道微生物的研究报道。红螯螯虾肠道菌群组成及养殖环境对其肠道菌群的影响还属未知。本研究通过对稻田养殖不同大小的红螯螯虾肠道细菌16S rDNA基因V3~V4区进行高通量测序,获得红螯螯虾肠道菌群组成特点。通过红螯螯虾肠道菌群组成特点分析,探讨红螯螯虾个体大小与其肠道菌群组成的相关性,以期获得与红螯螯虾生长相关的菌群结构,为优化红螯螯虾养殖条件、益生菌筛选和病害防控等提供数据支撑。
1 材料与方法
1.1 试验材料
红螯螯虾采自广西南宁苏圩镇红螯螯虾稻田生态养殖示范基地,稻田水温26.5 ℃,所有样品为同一块稻田、同批次苗种、同时放养。样品分为大个体组[RB:(4.5±10.8) g,(10.2±0.5) cm]和小个体组[RS:(27.7±7.7) g,(7.6±0.7) cm],每个组设3个重复,无菌采集红螯螯虾后肠,将5尾的后肠及其内容物混合为1个重复。
1.2 细菌基因DNA提取及高通量测序
红螯螯虾样品按照HiPure Stool DNA Kit(Magen生物,中国)说明书方法提取总DNA。采用PCR扩增核糖体RNA基因的16S rDNA V3-V4区序列。反应条件为:94 ℃ 2 min;98 ℃ 10 s,62 ℃ 30 s,68 ℃ 30 s,30个循环;68 ℃延伸5 min。使用引物为:341F(CCTACGGGNGGCWGCAG)和806R(GGACTACHVGGGTATCTAAT)。反应体系为 50 μL:10 × KOD Buffer 5 μL、2 mmol/L dNTPs 5 μL、Forward Primer(10 μmol/L)和Reverse Primer(10 μmol/L)各1.5 μL、KOD Polymerase 1 μL、MgSO(25 mmol/L) 3 μL、Template DNA 100 ng、补超纯水至50 μL。PCR产物经2%琼脂糖凝胶电泳检测后,按照AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,美国)说明书方法进行回收,采用ABI StepOnePlus Real-Time PCR System进行定量后在Illumina平台进行PE250测序(广州基迪奥生物科技有限公司)。
1.3 高通量测序结果生物信息学分析
红螯螯虾肠道细菌高通量测序结果借助基迪奥公司在线实时交互式数据分析平台Omicsmart(http://www.omicsmart.com)分析。主要分析步骤包括:原始测序序列的拼接和质控;采用USEARCH软件的UPARSE算法进行OTU聚类分析,相似度大于97%的序列聚为一类,计算获得每个OTU在各个样品中的Tags绝对丰度和相对信息;采用RDP Classifier的Naïve Bayesian assignment算法,与greengene数据库进行物种注释(设定置信度的阈值为0.8~1)对代表性OTU进行物种注释;Alpha多样性分析,并采用Welch’s T检验分析样本差异显著性;在生物学分类的门和属水平进行细菌群落结构和相对丰度分析;LEFse指示物种分析,获得组间菌群差异,找出主要特异菌群;Tax4Fun开展KEGG预测及KO丰度统计,预测菌群功能;使用R语言工具、Excel软件进行相关数据图形化。
2 结果与分析
2.1 样本16S rDNA基因高通量测序结果
通过样本16S rDNA基因高通量测序,RB组共获得352768条有效序列,聚类获得615个OTUs;RS组共获得351744条有效序列,聚类获得602个OTUs;RB组和RS组共有OTUs数量为345个,RB组特有OTUs为270个,RS组特有OTUs为257个。
2.2 菌群Alpha多样性分析
红螯螯虾肠道细菌群落Alpha多样性指数见表1。Alpha多样性结果分析显示,RB组的Chao指数、Ace指数、香农指数和辛普森指数均高于RS组,但差异不显著(>0.05),表明RB组菌群物种丰富度、菌群多样性和均匀度差异不显著,这可能是由于样品处于相同环境并摄食相同饵料造成。RB组和RS组的覆盖率分别为99.74%和99.72%,表明测序深度已经基本覆盖到样品中所有的物种,所得数据基本能反映样品真实物种组成情况。

表1 RB和RS Alpha多样性指数Tab.1 Alpha-diversity index of the samples in RB and RS group
2.3 样品菌群门水平组成差异分析
稻田养殖红螯螯虾肠道细菌群落门水平组成如图1所示,RB组和RS组的优势菌门相同,均为变形菌门(Proteobacteria)、软壁菌门(Tenericutes)、厚壁菌门(Firmicutes)、梭菌门(Fusobacteria)、拟杆菌门(Bacteroidetes)等,但各个优势菌门在RB组和RS组的组成比例存在差异,如变形菌门菌群在RB组所占比例为42.62%,而在RS组为51.78%;软壁菌门菌群在RB组所占比例为41.15%,而在RS组为35.71%;RB组浮霉菌门(Planctomycetes)和蓝藻(Cyanobacteria)菌群所占比例分别是RS组的3.6倍和5.5倍。
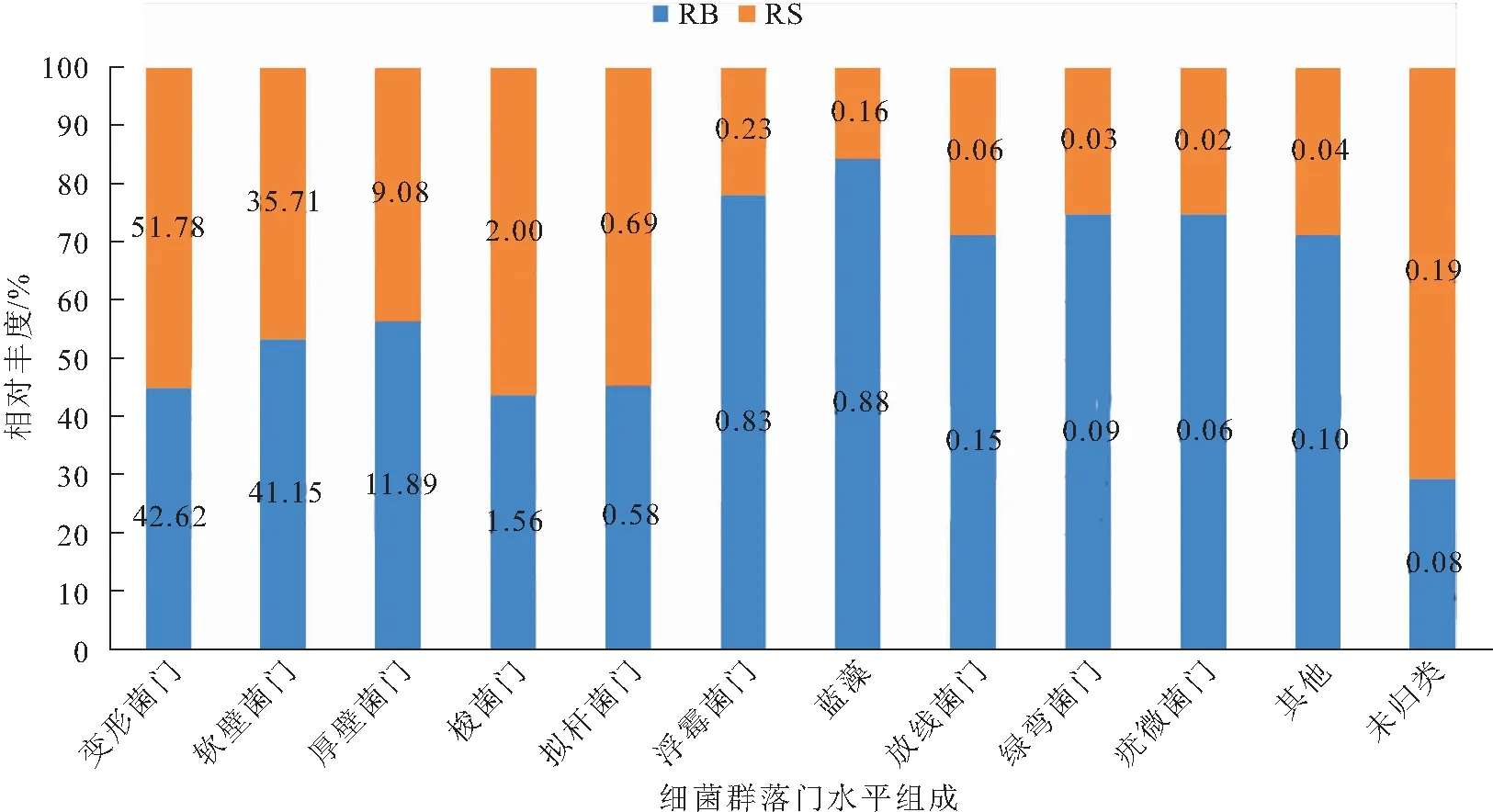
图1 RB组和RS组肠道菌群门水平相对丰度Fig.1 Relative abundance of intestinal microflora of RB and RS on phylum level
2.4 样品菌群属水平组成差异分析
稻田养殖红螯螯虾肠道细菌群落属水平组成如图2所示,RB组和RS组排名前10的优势菌属分别为、柠檬酸杆菌属()、梭菌属()、、弧菌属()、乳球菌属()、、布拉格菌属()、棍状厌氧菌属()、气单胞菌属()。其中梭菌属、、弧菌属菌群比例RB组分别为RS组的2.42、8.14和6.00倍,而乳球菌属和布拉格菌属菌群比例RS组分别为RB组的15.45和21.13倍。
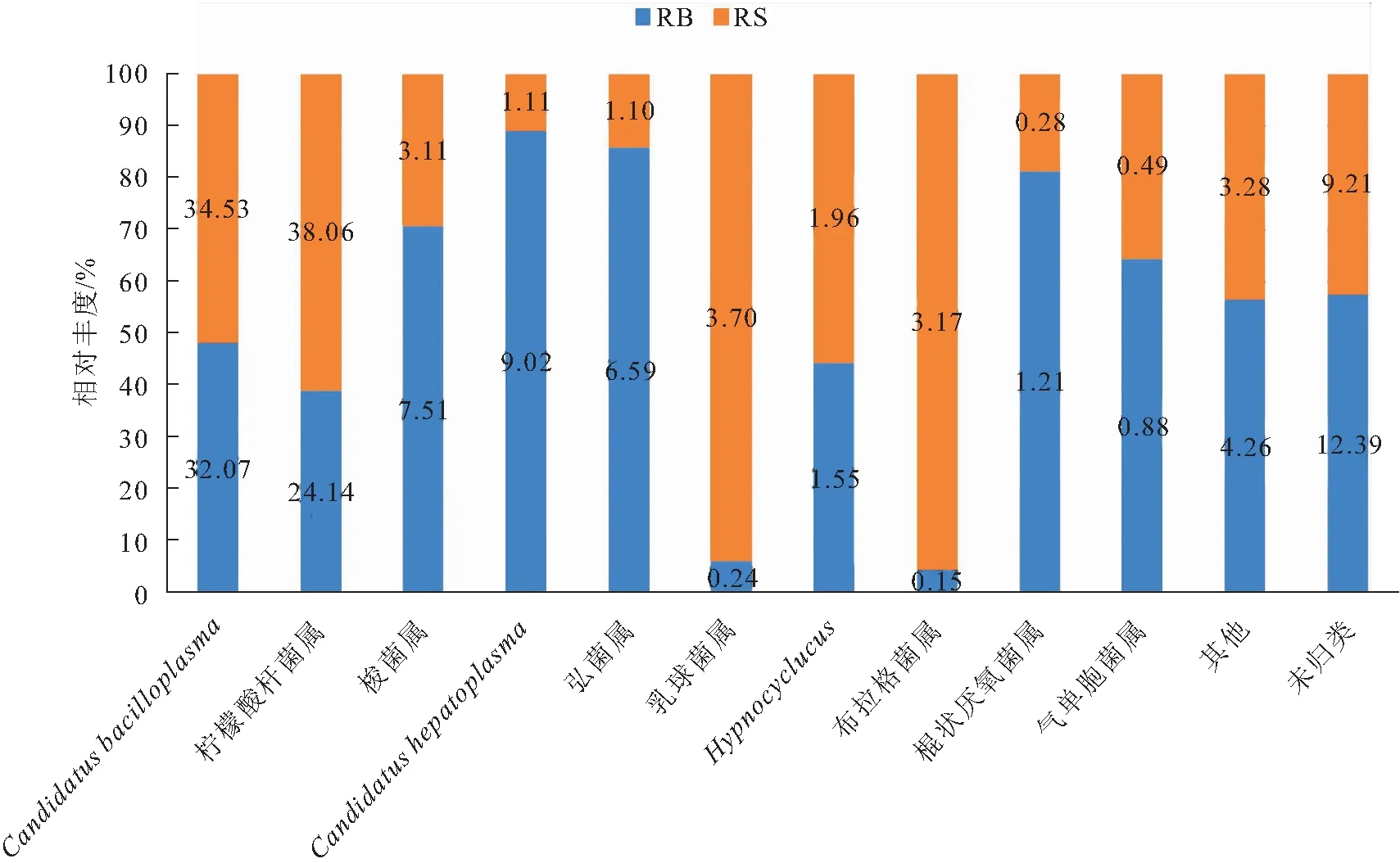
图2 RB组和RS组肠道菌群属水平相对丰度
2.5 样品菌群指示物种分析
通过LEFse分析RB和RS组间菌群差异,获得组间特异的主要菌群作为样品菌群的指示物种,分析结果如图3所示,RB组的特异菌群为乳酸菌科的乳杆菌属()和片球菌属()、苍白杆菌属()、军团杆菌属()及变形杆菌目(Gammaproteobacteria Incertae Sedis)等菌群;RS组的特异菌群为拟杆菌目(Bacteroidales)、红小梨形菌属()、布拉格菌属()和不动杆菌属()菌群。
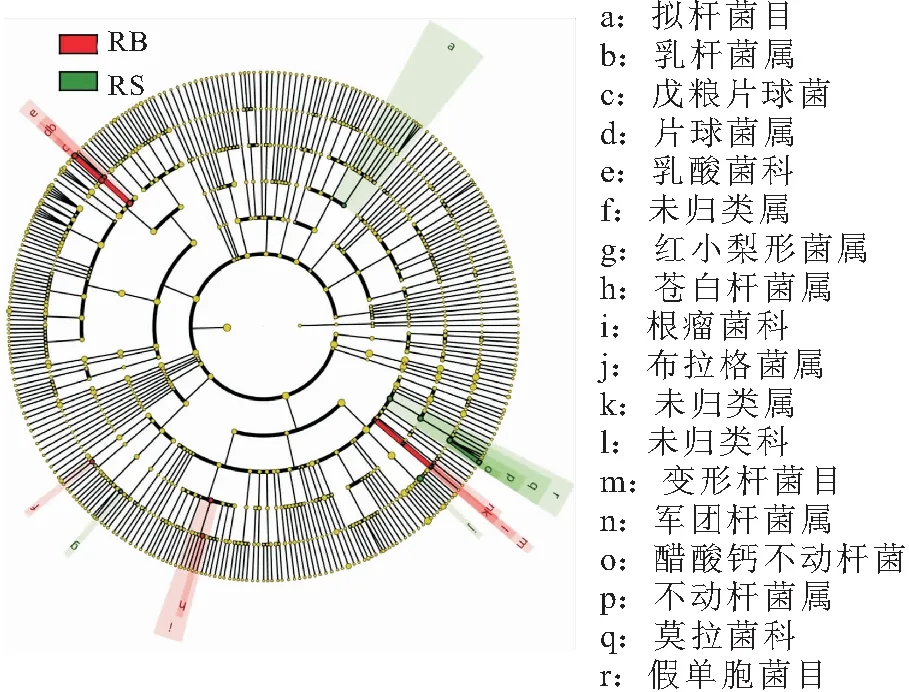
图3 RB组和RS组肠道菌群指示物种聚类图Fig.3 Cluster diagram of indicator species of intestinal microflora of RB and RS
2.6 样品菌群功能分析
通过Tax4Fun对16S序列的SILVA注释进行KEGG功能预测,获得样本中KO、pathway等功能的相对丰度,结果如图4所示。
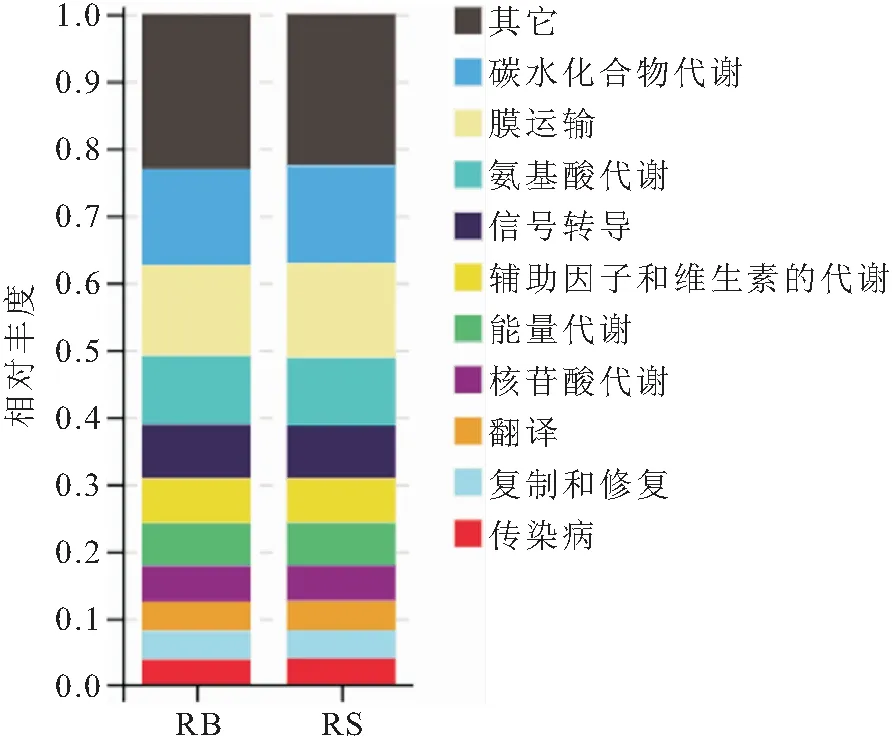
图4 RB组和RS组肠道菌群功能堆叠图Fig.4 Functional stacking diagram of intestinal microflora in RB and RS
RB组和RS组肠道菌群功能通过Welch’s T检验,获得丰度均值显著差异的功能聚类,结果如图5所示。除甘油磷脂代谢RS组丰度高于RB组,缬氨酸亮氨酸和异亮氨酸降解、柠檬烯和蒎烯降解、香叶醇降解、D-谷氨酰胺与D-谷氨酸代谢等功能RB组丰度均高于RS组。因此,RS组在脂代谢方面强于RB组,RB组在氨基酸代谢、聚酮类代谢、外源生物降解和代谢、消化系统和免疫系统等方面强于RS组。
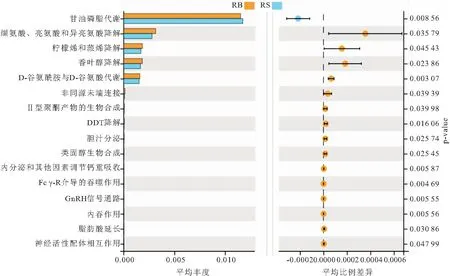
图5 RB组和RS组肠道菌群功能差异Fig.5 Functional differences of intestinal microflora between RB and RS groups
3 讨论
水生生物肠道菌群通常以变形菌门、厚壁菌门和拟杆菌门为主。本研究通过16S rDNA的高通量测序研究了稻田养殖红螯螯虾RB与RS肠道菌群多样性,研究显示RB组独有OTUs、RB和RS组共有OTUs和RS组独有OTUs数量各占总OTUs数量的31%、40%和29%,表明RB和RS组肠道细菌种类具有一定的共性,也存在较大的差异,与其他淡水螯虾,如马龙螯虾()、克氏原螯虾肠道菌群研究结果相似。除变形菌门、梭菌门和拟杆菌门丰度与红螯螯虾个体大小呈负相关外,其他优势菌群丰度均与红螯螯虾个体大小呈正相关。投喂益生菌可显著改善肠道菌群结构,提高马龙螯虾肠道软壁菌门和浮霉菌门等有益菌群,促进先天免疫相关的代谢功能和基因表达。RB组软壁菌门和浮霉菌门丰度均高于RS组,与红螯螯虾个体大小呈正相关,表明这两种菌群对螯虾的生长可能具有促进作用。研究显示,除个体差异因素外,品种、饲料和养殖环境是影响肠道菌群结构的重要因素。本研究菌群Alpha多样性结果显示RB组和RS组的菌群丰富度、多样性和均匀度均差异不显著,可能是由于样品的品种、饲养环境、饲料投喂完全相同所致。另外,红螯螯虾肠道蓝藻丰度也与个体大小呈正相关,从侧面表明大个体具有更强的摄食能力。
梭菌属能够利用包括纤维素、单糖和木聚糖等糖类为宿主提供营养。从人类粪便样本中分离的梭菌能够在结肠中积累Treg细胞,从而抑制肠道炎症。梭状芽孢杆菌在健康克氏原螯虾肠道中起炎症抑制的作用,而在镉引起的不健康肠道中会加重炎症相关疾病。本研究中RB组梭菌属丰度为RS组的2.42倍,表明梭菌属在健康红螯螯虾肠道可能起积极作用。弧菌属包含很多种水产养殖条件致病菌,可引起细菌性传染疾病暴发,是虾类养殖的巨大威胁。但也有大量研究数据表明,虾类疾病的发生是虾及菌群相互作用的平衡被打破的结果,而不是完全由单一病原造成的结果。有研究显示弧菌属为克氏原螯虾肠道菌群的优势菌群,但也有研究显示克氏原螯虾肠道菌群并不含有弧菌属,表明弧菌属并不是克氏原螯虾肠道的固有菌群,其丰度可能受环境的影响。本研究结果显示,弧菌属在健康红螯螯虾肠道中具有较高的丰度。乳球菌属、乳杆菌属和片球菌属分别属乳酸菌目的链球菌科、乳杆菌科。乳酸菌是肠道微生物的组成部分,通常被认为是益生菌,在促生长、宿主免疫调节和抗病性等方面发挥有益的作用。乳酸菌及其代谢产物可促进虾的存活、生长和免疫反应,增强虾对病原体的抵抗力。乳球菌和乳杆菌体外均具有抗弧菌活性,南美白对虾()口服后可在其肠道定殖抗弧菌感染。乳杆菌可调节宿主TOR依赖的营养传感机制及蜕皮激素和胰岛素激素信号促进生长。片球菌可提高虾的增重率、存活率、饲料转化率和血淋巴总抗氧化水平。本研究RB组肠道弧菌属丰度为RS组的6.00倍,而RS组肠道乳球菌属丰度为RB组的15.45倍,推测可能是RS组肠道较高的乳球菌属丰度对弧菌属产生了抑制作用。但菌群指示物种分析结果显示RB组特异具有乳杆菌属和片球菌属菌群,因此乳杆菌属和片球菌属可能在促进红螯螯虾生长方面起重要作用。
肠道微生物参与消化过程中物质循环和能量流动,其代谢产物在维持宿主生理稳态方面起关键作用。因此,肠道菌群及其代谢功能的信息是了解动物健康状况的有效途径。虽然不同个体的肠道菌群存在差异,但与代谢途径相关的基因在个体中是稳定的,这些微生物基因主要参与碳水化合物代谢和氨基酸合成等代谢途径。RB组和RS组肠道菌群虽然存在差异,但其菌群的功能均主要富集为碳水化合物代谢、膜运输、氨基酸代谢、信号转导等。RB组和RS组肠道菌群功能聚类差异分析显示,RS组在脂代谢方面强于RB组,RB组在氨基酸代谢、聚酮类代谢、外源生物降解和代谢、消化系统和免疫系统等方面强于RS组。这些菌群功能的差异,可能是影响红螯螯虾生长的重要因素。
本研究通过比较分析稻田养殖红螯螯虾个体大小与肠道菌群间的关系,发现个体大小与肠道菌群的结构组成和丰度、菌群的代谢功能有关,说明在相同的养殖环境和饲养方法条件下,红螯螯虾肠道微生物可影响红螯螯虾的生长性能。此外,根据本研究结果推测同属乳酸菌目的乳球菌属和乳杆菌属在红螯螯虾肠道的功能存在差异,乳球菌属可抑制肠道弧菌属的丰度,而乳杆菌在促进红螯螯虾生长方面起重要作用,为不同功能益生菌的开发提供参考。
