杀鲑气单胞菌可视化重组酶聚合酶扩增检测技术的建立
2022-02-23谷庆花李铭远司鑫鑫
谷庆花,李铭远,司鑫鑫,高 嵩
(江苏海洋大学药学院,江苏省海洋药物活性分子筛选重点实验室,江苏连云港 222005)
杀鲑气单胞菌()是已知最古老的鱼类疖病的病原体,属于气单胞菌科气单胞菌属,是一种不能运动、兼性厌氧的革兰氏阴性菌,广泛分布于自然界中。该菌可引起鲑鳟鱼类如大西洋鲑()、褐鳟()、虹鳟()等发生疖病,给养殖业带来严重的经济损失。目前对该病的治疗主要依赖于抗生素,但抗生素的长期使用已导致耐药性、药物滥用等诸多问题的出现。因此,建立一种快速、方便的杀鲑气单胞菌现场检测方法,在感染早期对该病原菌进行检测以便及时采取相应措施,对水产养殖业的发展具有重要意义。
针对杀鲑气单胞菌的传统检测方法为分离鉴定法,该方法既繁琐又耗时,且由于杀鲑气单胞菌及其亚种的复杂性,很难达到检测的重复性和特异性要求。近年来,许多分子生物学技术,如常规PCR、多重PCR、实时荧光定量PCR、环介导等温扩增(LAMP)等,已被应用于杀鲑气单胞菌的快速检测,这些方法的应用使准确检测病原体所需时间从几天减少到几个小时。然而,由于这些方法需要依赖昂贵的仪器设备和专业的技术人员,且存在引物设计复杂、耗时长等缺点,导致在现场快检时仍有一定局限。
近几年来,重组酶聚合酶扩增(recombinase polymerase amplification,RPA)技术被引入到水产养殖病原体的检测中。该方法是一种能够在35~45 ℃的恒温下实现扩增的技术,利用重组酶UvsX与引物结合并寻找与引物互补的同源序列后,解锁局部双链DNA,不需对模板高温变性,随后单链结合蛋白gp32进一步打开双链,最后通过Bsu聚合酶来扩增目标序列,30 min内就可获得大量的扩增产物。该扩增方法不依赖昂贵的仪器,操作简单,接近人体温度就可以进行目的基因的扩增。RPA扩增结束后可结合侧向流试纸条(lateral flow strips,LFS)对产物进行终点目视读出。RPA-LFS的联用是一种对设备依赖性小、非常适合现场快检的技术。本研究建立了一种基于RPA-LFS的杀鲑气单胞菌检测方法,为杀鲑气单胞菌感染的现场快速诊断提供了一种可行的技术选择。
1 材料与方法
1.1 菌株来源
温和气单胞菌(ATCC 43979)、豚鼠气单胞菌(ATCC 15468)、维氏气单胞菌(ATCC 35624)、哈维氏弧菌(ATCC 14126)、 灿烂弧菌(ATCC 33125)和荧光假单胞菌(ATCC 13525)购自美国American Type Culture Collection(ATCC)菌种保藏中心,并用于本研究。杀鲑气单胞菌(ATCC 33658)、嗜水气单胞菌(ATCC 13040)、溶藻弧菌(ATCC 17749)、副溶血弧菌(ATCC 17802)、迟缓爱德华氏菌(CICC 10630)、小肠耶尔森氏菌(ATCC 23715)由本实验室保存。以上菌株均经过了16S rRNA测序确认。
1.2 主要试剂及仪器
RPA试剂包括TwistAmp Basic Kit和TwistAmp nfo Kit,购自英国TwistDx Inc公司;核酸检测试纸条(LFS)及配套缓冲液购自杭州优思达生物技术有限公司;手持式第三代组织研磨器购自天根生化科技(北京)有限公司。
1.3 引物及探针的设计与合成
根据杀鲑气单胞菌遗传性质保守的铁载受体(ferric siderophore receptor,fstA)基因(GenBank accession no.X87995.1)的序列,利用NCBI Primer-BLAST设计特异性引物,参数设置参考RPA试剂说明书对引物的设计要求。使用Primer Premier 5软件在引物定义的区域内设计探针。根据TwistAmp nfo Kit说明书要求,探针和反向引物的5′端分别修饰FITC和生物素基团;探针序列中部的一个碱基使用四氢呋喃(THF)基团取代,且探针3′端添加可以阻断聚合酶延伸的SpC3基团。引物和探针[通用生物系统(安徽)有限公司]序列见表1。

1.4 RPA实验流程及电泳检测
RPA实验根据TwistAmp Basic Kit说明书进行。在50 μL反应体系中,添加1 μL模板,正向、反向引物(10 μmol/L)各2.4 μL,以及试剂盒提供的其他反应成分。通过添加2.5 μL乙酸镁(280 mmol/L)启动反应,并在37 ℃孵育30 min。该反应的模板来自细菌培养液,10CFU/mL的杀鲑气单胞菌培养液经100 ℃煮沸10 min后直接用作模板。该反应的扩增产物经吸附柱纯化后,使用1.5%琼脂糖凝胶电泳进行分析。
1.5 RPA-LFS实验流程
在RPA-LFS实验中,RPA扩增部分按照TwistAmp nfo Kit说明书进行。在50 μL反应体系中添加正向、反向引物(10 μmol/L)各2.1 μL,探针(10 μmol/L)0.6 μL,1 μL模板,以及试剂盒提供的其他反应成分。通过添加2.5 μL乙酸镁(280 mmol/L)启动反应,并在30~45 ℃孵育10~30 min。反应模板来自细菌培养液,首先将各细菌培养液用去离子无菌水稀释至所需的浓度(浓度单位:CFU/mL),然后经100 ℃煮沸10 min后直接用作模板。RPA扩增完成后,取5 μL扩增产物滴加到核酸检测试纸条(LFS)的样品垫上,然后将试纸条的侧向流起始端浸入100 μL侧向流缓冲液(主要成分为PBS和Tween-20)中。在试纸条上,沿着侧向流的方向有样品垫、金标垫(附有带FITC抗体的纳米金颗粒)、检测线(标记了链霉亲和素)、质控线(标记了FITC抗体的二抗)和吸收垫。在侧向流试纸条上,扩增产物会结合纳米金颗粒并聚集在检测线上产生阳性信号,而未与扩增产物结合的纳米金颗粒会聚集在质控线上指示侧向流的完成。在5 min内侧向流实验即可完成。
1.6 人工污染样本的准备
从本地市场购买健康活鲤,经国标培养法(GB/T 15805.6-2008)确认无杀鲑气单胞菌污染。使用手持式第三代组织研磨器将肠、肾、脾和肌肉组织分别匀浆。将1 g匀浆重悬于10 mL PBS中,并按实验需要掺入不同量的杀鲑气单胞菌。将重悬液加热至100 ℃孵育10 min后,以5 000离心5 min使组织残留物沉降,取1 μL上清液直接用作人工污染样本模板。
2 结果
2.1 杀鲑气单胞菌fstA基因片段的RPA扩增
将杀鲑气单胞菌的培养液经热处理后制备成模板,进行fstA基因片段的RPA扩增。结果显示获得单一条带,扩增片段长度为255 bp,与预期大小一致(图1),表明该对引物可用于RPA扩增杀鲑气单胞菌的fstA基因片段。
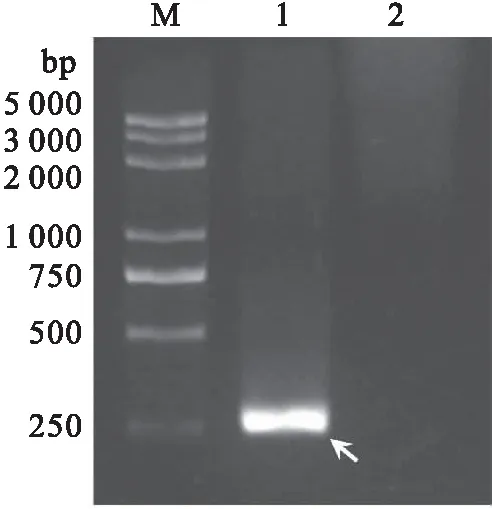
图1 杀鲑气单胞菌fstA基因片段的RPA扩增Fig.1 RPA amplification of fstA gene fragment of A.salmonicidaM:DNA分子质量标准;1:以杀鲑气单胞菌为模板的RPA扩增产物;2:无模板对照
2.2 RPA-LFS反应条件优化
为确定RPA-LFS方法的最佳反应条件,对RPA扩增反应温度和时间进行了筛选。结果表明:RPA-LFS在30~40 ℃温度范围内均产生了阳性信号,且信号强度随着温度升高呈现先增加后减少的趋势,当温度在37 ℃时信号强度最大,检测线的显色最明显(图2A)。由此确定RPA扩增的最佳反应温度为37 ℃。然后测试10~30 min之间不同反应时间对结果的影响,结果显示反应时间为25 min时检测线的信号最明显(图2B),由此确定RPA扩增的最佳反应时间为25 min。
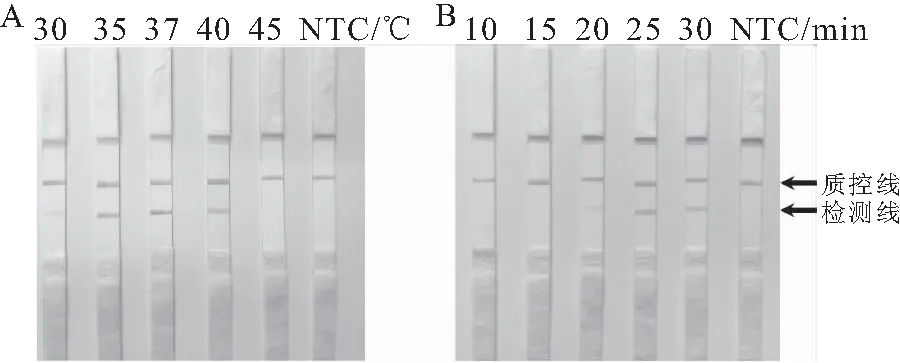
图2 RPA-LFS反应条件优化Fig.2 Reaction condition of the RPA-LFS method
2.3 RPA-LFS检测方法的特异性
RPA-LFS方法的反应温度和时间确定后,应用该方法检测杀鲑气单胞菌及其他11种水产常见致病菌模板,结果表明除杀鲑气单胞菌模板外,其他致病菌模板的RPA-LFS检测结果均为阴性(图3),说明本研究建立的杀鲑气单胞菌RPA-LFS检测方法具有良好的特异性。

图3 RPA-LFS检测方法的特异性Fig.3 Specificity of the RPA-LFS method
2.4 RPA-LFS检测方法的灵敏度
使用1×10~5×10CFU的杀鲑气单胞菌样本确定RPA-LFS检测方法的灵敏度和最低检测限。在此检测范围内,RPA-LFS方法均产生了明显的阳性信号,表明该方法检测杀鲑气单胞菌的灵敏度可达到单次反应1 CFU的最低检测限(图4)。

图4 RPA-LFS检测灵敏度(纯培养物)Fig.4 Limit of detection of the RPA-LFS method for pure culture
以上所测为细菌纯培养物的检测灵敏度。为了解在实际检测中,样本中其他成分(如鱼的组织成分)是否会影响该检测灵敏度,人工制备了鲤鱼组织(包括肠、肾、脾和肌肉)的杀鲑气单胞菌污染样本并对检测灵敏度进行了验证。单个反应所检测的鲤鱼组织污染样本中杀鲑气单胞菌含量的范围是1×10~1×10CFU。结果显示,尽管个别信号强度有所减弱,但不同组织污染样本的检测灵敏度仍然能达到单次反应1 CFU,未受组织成分的影响(图5)。因此,本研究建立的杀鲑气单胞菌RPA-LFS检测方法的灵敏度为单次反应1 CFU。
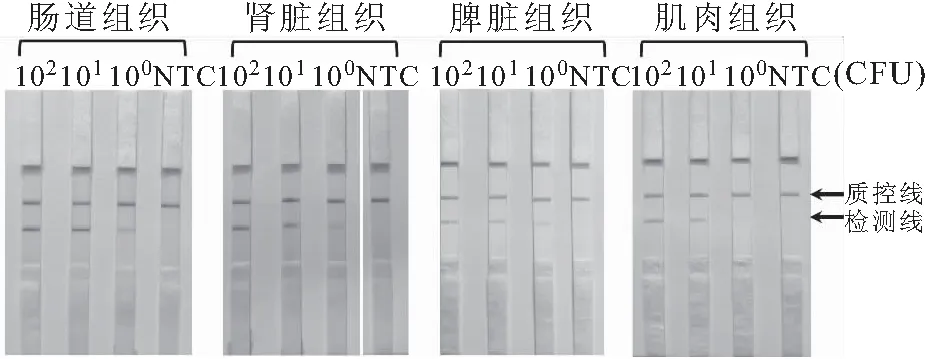
图5 RPA-LFS检测灵敏度(鲤鱼组织污染样本)Fig.5 Limit of detection of the RPA-LFS method for spiked samples
3 讨论
杀鲑气单胞菌广泛分布在自然界中,是条件致病菌,一旦爆发感染就会给水产养殖业带来严重的经济损失。据报道,该菌引发的疾病每年可造成加拿大水产养殖损失超过4亿美元。因此,如何快速准确地检测该病原菌在水产养殖等领域显得十分重要。
目前针对杀鲑气单胞菌的检测方法已被陆续开发出来。早在1993年,童裳亮等利用ELISA技术建立了快速检测水样中杀鲑气单胞菌的方法;BEAZ-HIDALGO等评估一种新的PCR方案,旨在检测鱼组织中的杀鲑气单胞菌;SAVAN等根据基因设计了特异性引物并应用环介导等温扩增技术来检测大西洋鳕鱼非典型疖病的病原杀鲑气单胞菌。但这些方法存在时间跨度长、需要专业的仪器设备和操作人员,且不能满足偏远地区或资源贫乏地区的检测要求。
RPA-LFS是一种近年来发展起来的对设备依赖性小、简单、快速的检测技术,特别适合资源贫乏地区的现场快速检测。例如DONG等建立的基于RPA-LFS方法,适用于海水养殖业的溶藻弧菌致病菌株的现场检测;彭遥等建立的侧流层析-重组酶聚合酶扩增技术在临床及现场检测土拉弗朗西斯菌中具有应用前景。本研究建立了一种基于RPA-LFS的杀鲑气单胞菌可视化快速检测技术,基于杀鲑气单胞菌的毒力基因fstA保守区设计引物和探针,并对反应时间和反应温度进行了优化,结果显示37 ℃、25 min为最佳反应条件。该方法特异性好,与其他鱼类致病菌无交叉反应。该方法灵敏度高,最低检测限可达单次反应1 CFU。而目前其他检测方法,包括基于PCR、qPCR和LAMP的检测方法等,最低检测限在单次反应10至100 CFU之间。尽管本研究确定灵敏度时将细菌添加到组织匀浆液中,与从细菌感染的组织中提取细菌DNA的效率有所差异,但本研究仅使用热处理释放DNA,而未经DNA提取纯化步骤,说明在粗模板状态下该方法的灵敏度是令人满意的。另外,应用该方法检测鲤鱼组织污染样本中杀鲑气单胞菌时,粗模板的检测灵敏度未受到明显影响,也印证了RPA扩增可耐受一定扩增抑制剂的特征。此外,用于RPA扩增的反应组分为干粉形式,便于运输和储存,这种特性使将RPA-LFS方法组装成一个“移动手提箱实验室”成为可能,便于在现场使用。
综上所述,本研究建立的基于RPA-LFS的杀鲑气单胞菌可视化快速检测技术具有特异性强、灵敏度高、操作简单、结果可通过肉眼观察、不依赖昂贵的仪器设备等优点,适用于养殖业中杀鲑气单胞菌的现场检测。
