基于UPLC-Q-TOF MS/MS技术的可可粉中掺入可可壳定量检测方法研究
2022-01-26张雅莉韩建勋魏海燕侯卫静
张雅莉,韩建勋,,宋 薇,魏海燕,侯卫静,富 玉,付 萌,李 婷
(1.谱尼测试集团股份有限公司,北京 100095;2.谱尼测试集团北京检验认证科学研究院有限公司,北京 100095)
可可是一种重要的经济作物,其种子可可豆可制作成可可粉等可可制品。可可粉含有丰富的多酚、可可碱、可可脂、粗纤维、蛋白质等营养和活性成分,是世界上三大嗜好性饮料之一[1-3]。目前,全球对可可的需求正在日益增加[4],约有60个国家种植可可树,然而只有厄瓜多尔等少数国家是可可的主要出口国[4-5],导致可可价格一直居高不下[6],给可可及可可制品的质量把控提出了更高要求。可可粉中掺入可可壳是常见的质量问题[2,7],其存在不仅会影响感官体验,还可能引起霉菌毒素、重金属或微生物等污染[8]。可可粉中可可壳的掺入主要包括2种途径:1) 人为添加,为牟取暴利一些不法企业以饲料名义进口可可壳,粉碎加工后喷上可可香精掺入可可粉中[9];2) 生产过程残存,在一定程度上,可可加工过程中可可壳的残存是不能完全避免的[8,10]。可可粉中可可壳的掺入量是其质量控制的重要参数[9],目前国内外尚无可可粉中可可壳掺入量的质控标准,国际食品法典委员会(Codex Alimentarius Commission, CAC)发布的CXS 141-1983标准规定,可可浆和可可蛋糕中可可壳掺入量的限值为5%,已成为可可加工行业普遍接受的可可壳掺入限值[8]。
目前,可可粉中可可壳掺入量的检测方法有显微镜法[11]、重量法[12]、分光光度法[13]、液相色谱法[9,14-15]以及近红外光谱法[16]等,均取得了较好的研究进展。显微镜法操作简单,但难以定量[9];重量法通过测定可可粉溶液中沉降成分的质量来评估可可壳的掺入量,难以得到稳定准确的检测结果[17];分光光度法和液相色谱法主要通过测定可可粉或可可壳中多糖、脂质、脂肪酸色酰胺等特征成分含量来评估可可壳含量,但是方法的灵敏度较低[9]。胡明华等[2]利用酸水解及柱前衍生的HPLC指纹图谱法分析可可粉的多糖组分,结合系统聚类分析法可对掺入15%及以上可可壳的可可粉予以鉴别;张九魁等[9]建立了固相萃取-高效液相色谱-荧光检测法检测可可粉中二十二烷酸色酰胺和二十四烷酸色酰胺的含量,鉴别出掺入5%及以上可可壳的掺假可可粉。近红外光谱技术具有快速、无损等优点,其结合化学计量学方法建立模型后,可实现可可粉中可可壳的定性定量检测,但该方法对于定标样本数据和模型的精确性都有很高的要求,需采集广泛的代表性样本,才能保证结果的稳定性和准确性[8,18-19]。超高效液相色谱-四极杆-飞行时间串联质谱(ultra performance liquid chromatography-quadrupole-time of flight-tandem mass spectrometry, UPLC-Q-TOF MS/MS)将具有高分离度、高灵敏度的液相色谱系统与能同时提供母离子和碎片离子准确质量数以及元素组成的高分辨质谱有机结合,对复杂基质中未知化合物的鉴定具有优势,被广泛应用于食品、药品等领域的掺假鉴别研究[20-21]。
本研究拟采用UPLC-Q-TOF MS/MS技术结合UNIFI软件以及化学计量学算法,通过确定可可壳相对于可可粉的特征标志物,建立可可粉中掺杂可可壳的定量检测方法,旨为可可粉的质量评价与控制提供科学依据。
1 实验部分
1.1 仪器与装置
Waters Xevo G2-XS QTOF/UPLC系统:美国Waters公司产品,配有MassLynx软件(V4.1)和UNIFI软件(V1.9.4);ST-04A多功能粉碎机:上海树立仪器仪表有限公司产品;H1850台式高速离心机:湖南湘仪离心机仪器有限公司产品;N-1100旋转蒸发仪:日本东京理化器械株式会社产品;AB135-S分析天平(感量0.01 mg)、AB204-S分析天平(感量0.1 mg):瑞士Mettler Toledo公司产品;0.22 μm有机相滤膜(尼龙):天津博纳艾杰尔科技有限公司产品。
1.2 材料与试剂
可可豆(4个批次,产地为厄瓜多尔),可可粉(来源4个不同生产厂家),以上样品均于室温避光储藏。
甲醇、乙腈:色谱纯,美国Fisher Scientific公司产品;乙酸铵:优级纯,天津津科精细化工研究所产品;亮氨酸脑啡肽:分析纯,美国Waters公司产品。
1.3 实验方法
1.3.1样品制备 自制可可粉和可可壳粉:将可可豆果实(可食部分)和可可豆果皮分开,磨粉过125目筛,分别标记为可可粉组(G组)和可可壳粉组(K组),置于阴凉干燥处,待测。
模拟制备可可粉中掺杂可可壳粉:分别称取0、0.1、0.5、1、2、5 g(精确0.001 g)可可壳粉于50 mL干燥具塞离心管中,再加入一定量的可可粉至共10 g,充分混合,制备得到可可壳掺入量分别为0、1%、5%、10%、20%、50%的可可粉掺杂模拟样品,置于阴凉干燥处,待测。
盲样制备:分别将4个批次的可可粉和可可壳粉进行等比例混合,得到混合的可可粉和可可壳粉;再将以上不同批次混合后的可可粉和可可壳粉按一定比例混合,模拟制成3个盲样,置于阴凉干燥处,待测。
1.3.2样品前处理 准确称取约1 g(精确至0.001 g)样品于50 mL具塞离心管,加约20 mL甲醇,涡旋混匀,超声20 min;取出后以8 000 r/min离心5 min,收集上清液,向残渣中加入20 mL甲醇重复提取,合并上清液;将上清液于40 ℃旋蒸至干,加入1 mL甲醇复溶,过0.22 μm滤膜,待分析。其中,为监测仪器的稳定性和重复性,在进行可可粉和可可壳粉样品前处理后,吸取同等体积的样品溶液混匀,作为质控(QC)样品。每个样品平行测定3次。
1.3.3仪器条件 液相色谱条件: Acquity UPLC®BEH C18色谱柱(100 mm×2.1 mm×1.7 μm);柱温40 ℃;流动相:MSE和MS/MS模式下流动相A分别为水和乙酸铵水溶液(5 mmol/L),流动相B均为乙腈,洗脱梯度列于表1;流速0.3 mL/min;进样体积5 μL。
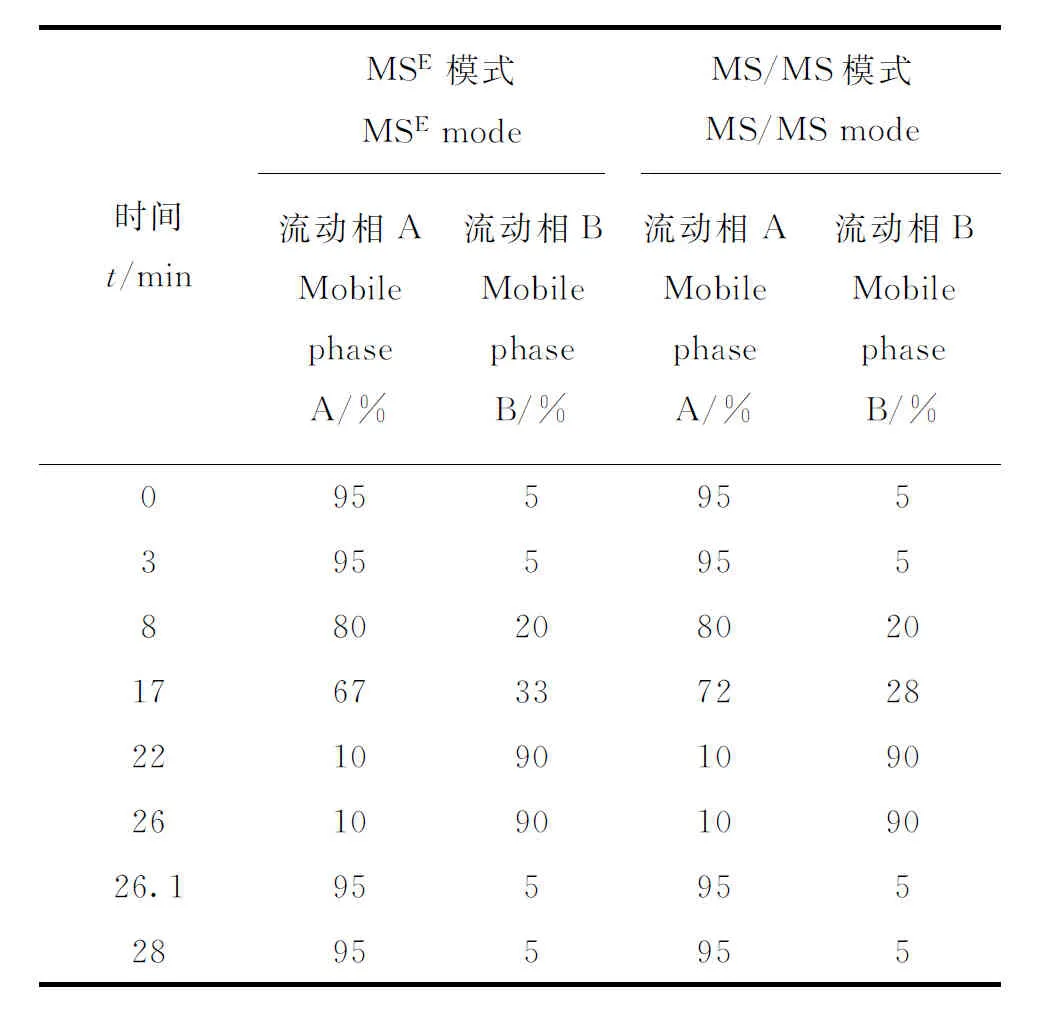
表1 流动相洗脱梯度Table 1 Elution gradient of mobile phase
MSE模式质谱条件:ESI离子源,正、负离子模式;离子源温度100 ℃;脱溶剂气温度250 ℃;脱溶剂气流速600 L/h;锥孔气流速50 L/h;毛细管电压2.0 kV;锥孔电压40 V;灵敏度模式扫描;质量扫描范围m/z50~1 200;扫描时间0.2 s;碰撞能量:低碰撞能量为off,高碰撞能量为10~35 eV;实时校正液:亮氨酸脑啡肽,正离子条件m/z556.277 1,负离子条件m/z554.261 5。
UNIFI软件参数设置:高能量和低能量下响应阈值分别为50、250;精确质量偏差阈值5 mu;可识别的化合物加合峰形式包括+H、+H2O+H、-H、+e峰;实时校正液:亮氨酸脑啡肽,正离子条件m/z556.276 6,负离子条件m/z554.262 0。
MS/MS模式质谱条件:ESI离子源,负离子模式;离子源温度100 ℃;脱溶剂气温度250 ℃;脱溶剂气流速600 L/h;锥孔气流速50 L/h;毛细管电压2.0 kV;锥孔电压40 V;灵敏度模式扫描;质量扫描范围m/z50~500;监测母离子m/z375.18,监测子离子m/z191.07*、289.07(*为定量离子);扫描时间0.2 s;碰撞能量15~40 eV;实时校正液:亮氨酸脑啡肽,m/z554.261 5。
1.4 数据处理
将采集的可可粉(G组)和可可壳粉(K组)MSE数据导入UNIFI软件中完成质量校正、加合离子设定等处理,进行化合物峰提取,并结合UNIFI软件自带的天然活性物质数据库进行自动匹配鉴定;将经UNIFI软件处理的数据导入EZinfo软件进行无监督的主成分分析(principal component analysis, PCA)与有监督的正交偏最小二乘法-判别式分析(orthogonal partial least squares-discriminate analysis, OPLS-DA)。
1.5 特征标志物的筛选与鉴定
根据OPLS-DA模型的变量投影重要性(variable importance in the project, VIP)筛选潜在特征标志物,设置VIP≥3,且以仅存在于可可壳中为原则确定可可壳的特征标志物,并进行鉴定。
1.6 定量检测模型的构建
为定量检测可可粉样品中可可壳粉的掺入情况,在可可粉中加入可可壳粉,制成质量分数分别为0%、1%、5%、10%、20%和50%的可可粉掺杂模拟样品,按照1.3.3节MS/MS模式的液相色谱和质谱方法上机采集数据,以可可粉中可可壳粉的掺入量为横坐标,特征标志物苦木内酯Ⅰ的峰面积为纵坐标,拟合线性标准曲线,采用保留时间定性,外标法定量。
2 结果与分析
2.1 可可粉与可可壳粉代谢指纹图谱分析
采用UPLC-Q-TOF MS/MS技术在正、负离子模式下采集可可粉和可可壳粉样品的信息,生成基峰色谱图(base peak intensity, BPI),示于图1。可见,可可粉和可可壳粉中的相关组分在28 min内均得到较好的分离和响应值,且谱峰差异明显。通过统计图1的谱峰,在正离子模式下,可可粉和可可壳粉分别有31、32个响应较高的谱峰;而在负离子模式下,可可粉和可可壳粉分别有58、61个响应较高的谱峰;负离子模式下的离子响应明显优于正离子模式。因此,本研究采用负离子模式对相关数据进行分析。

注:a,b.正离子模式;c,d.负离子模式
使用UNIFI软件处理负离子模式下采集的MSE原始数据,进行峰识别和对齐后,得到包含母离子质荷比、保留时间和离子响应强度的数据矩阵,结合UNIFI软件自带的天然活性物质数据库对可可粉和可可壳粉中响应较高的谱峰进行归属,其相关信息分别列于表2和表3。
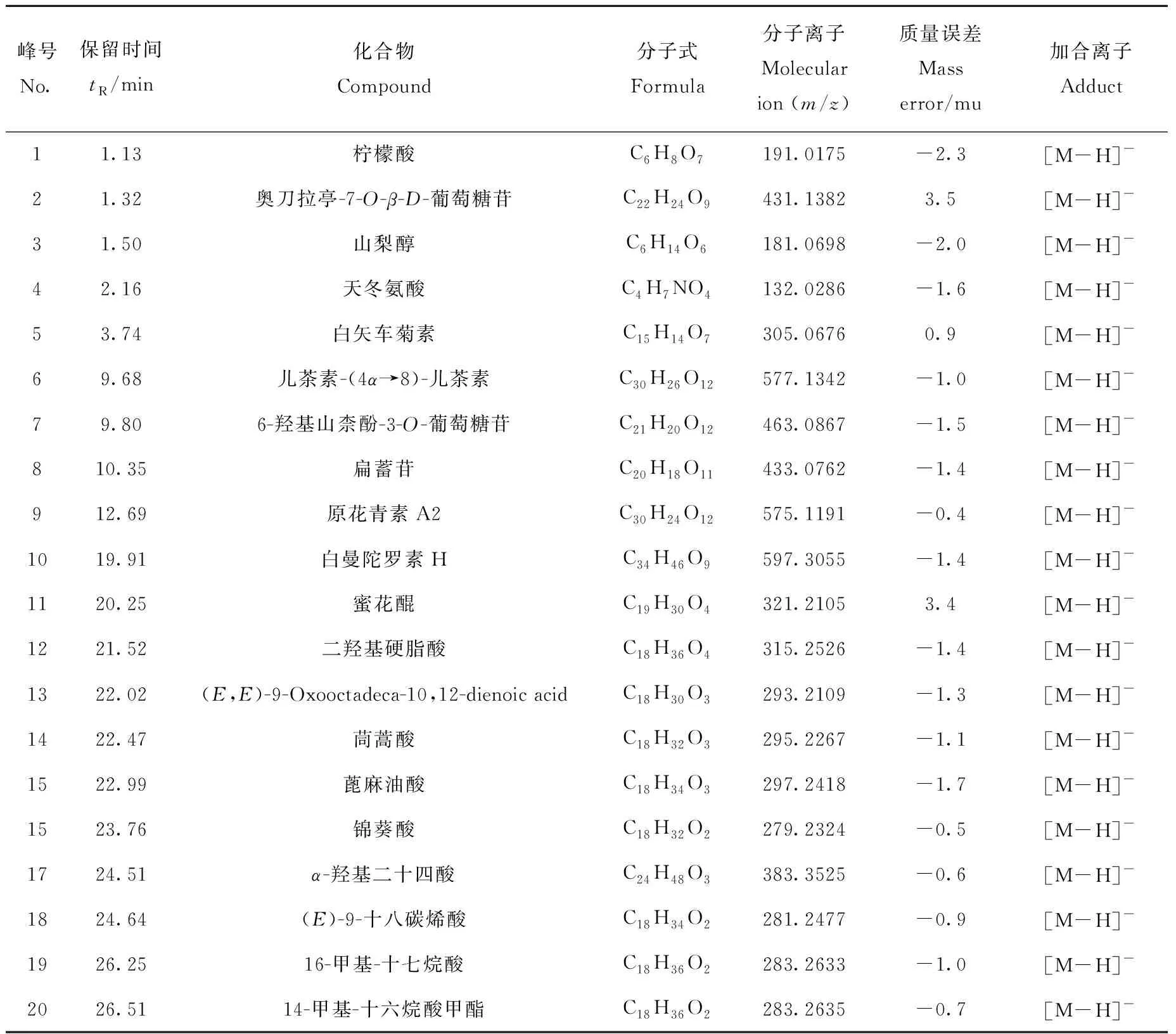
表2 负离子模式下,可可粉中鉴定的成分Table 2 Components of cocoa powder identified in negative ion mode
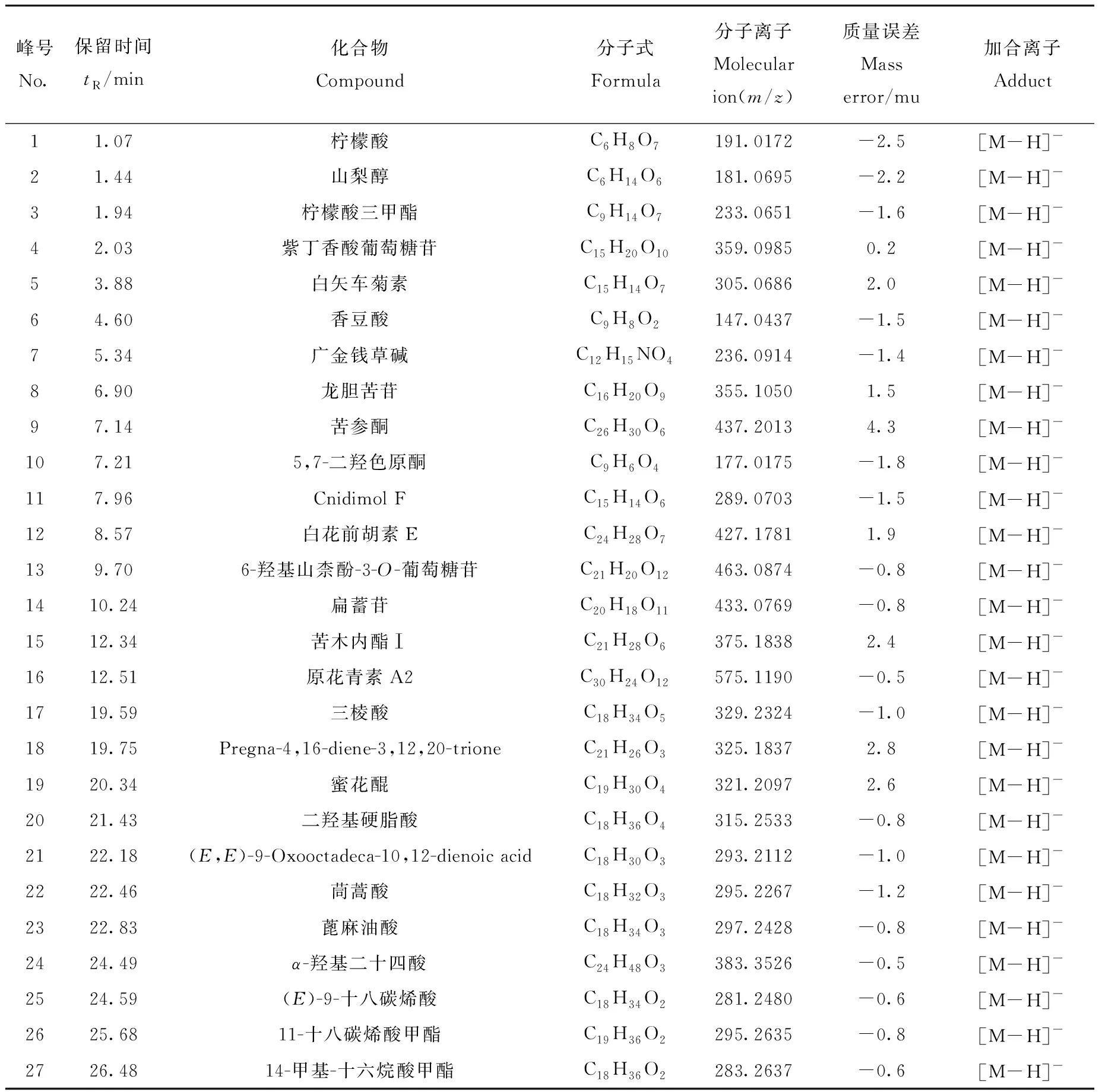
表3 负离子模式下,可可壳粉中鉴定的成分Table 3 Components of cocoa shell powder identified in negative ion mode
2.2 定性判别分析
PCA分析属于一种模糊识别方式,是将复杂数据进行降维处理,剔除冗余数据后,找出对整体贡献值最大的信息[22],通过原始数据直观地反映2组样品间的整体差异,但是无法消除随机误差和组内误差[23]。将2.1节UNIFI软件分析得到的包含母离子质荷比、保留时间和离子响应强度的数据矩阵导入EZinfo软件进行PCA分析。结果表明,所有QC样品在PCA得分图上紧密聚集在一起,而且同1个样品的3个平行实验也紧密聚集在一起,表明数据稳定可靠,示于图2。G组和K组样品在PCA模型的第二主成分上聚集成2类,示于图2a,表明可可粉和可可壳粉的化学成分存在明显差异。同时,2组样品点分布都有所离散,表明不同批次间的可可粉和可可壳也存在一定的组分差异。
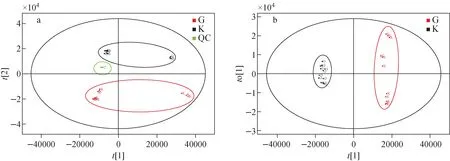
图2 可可粉与可可壳粉的PCA(a)和OPLS-DA(b)得分图Fig.2 PCA (a) and OPLS-DA (b) scores plot of cocoa powder and cocoa shell powder
OPLS-DA是一种有监督的判别分析统计方法,可降低样品组内差异、放大组间差异,排除无关因素对实验数据造成的影响,从而实现对不同样品的有效预测[24]。为充分提取2组样品检测的差异信息,准确筛选出可可壳粉的特征标志物,进一步采用OPLS-DA模型分析数据。结果表明,可可粉和可可壳粉样品在OPLS-DA得分图上聚集成2类,得以明显区分,示于图2b。
2.3 定量检测分析
2.3.1特征标志物的应用 通过建立OPLS-DA模型,得到可可粉与可可壳粉的S-plot图,示于图3。在S-plot图中分布的点越靠近两极,代表对应化合物对2组样品分组的贡献程度越大,VIP值也越大。以VIP≥3且S-plot图中的模型参数p[1]>0为筛选条件,初步得到119个化合物信息,这些化合物在可可壳粉中的含量均大于可可粉中的含量。选择在K组中检测到而在G组中未检测到的化合物作为特征标志物,共得到23个化合物信息,如tR=1.83 min(m/z267.048 9)、tR=2.10 min(m/z315.072 5)、tR=3.48 min(m/z467.121 1)、tR=6.04 min(m/z187.095 0)、tR=6.66 min(m/z177.016 7)、tR=12.34 min(m/z375.183 1)、tR=18.88 min(m/z331.244 9)、tR=19.38 min(m/z313.235 6)等,对其进一步推测鉴定。其中,tR=12.34 min(m/z375.183 1)经与天然活性物质数据库匹配,鉴定为苦木内酯Ⅰ(nigakilactone Ⅰ),示于图3。苦木内酯Ⅰ的质谱信息及其母离子(m/z375.183 1)、碎片离子(m/z315.086 0、289.070 2、191.073 0)的归属示于图4。因此,可将苦木内酯Ⅰ作为可可壳粉的特征标志物用来鉴定可可粉中可可壳粉的掺入。
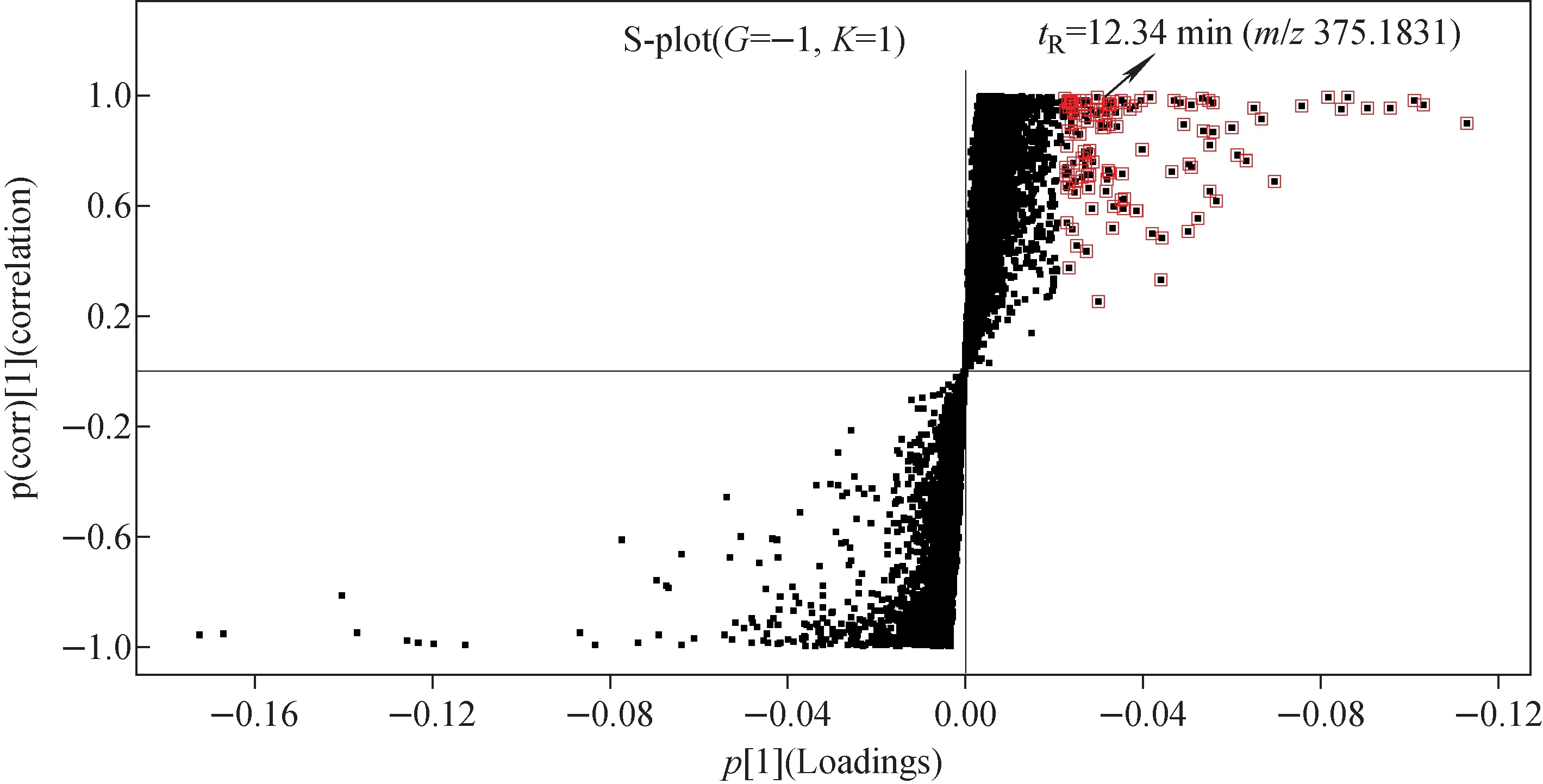
注:红框表示VIP≥3的化合物
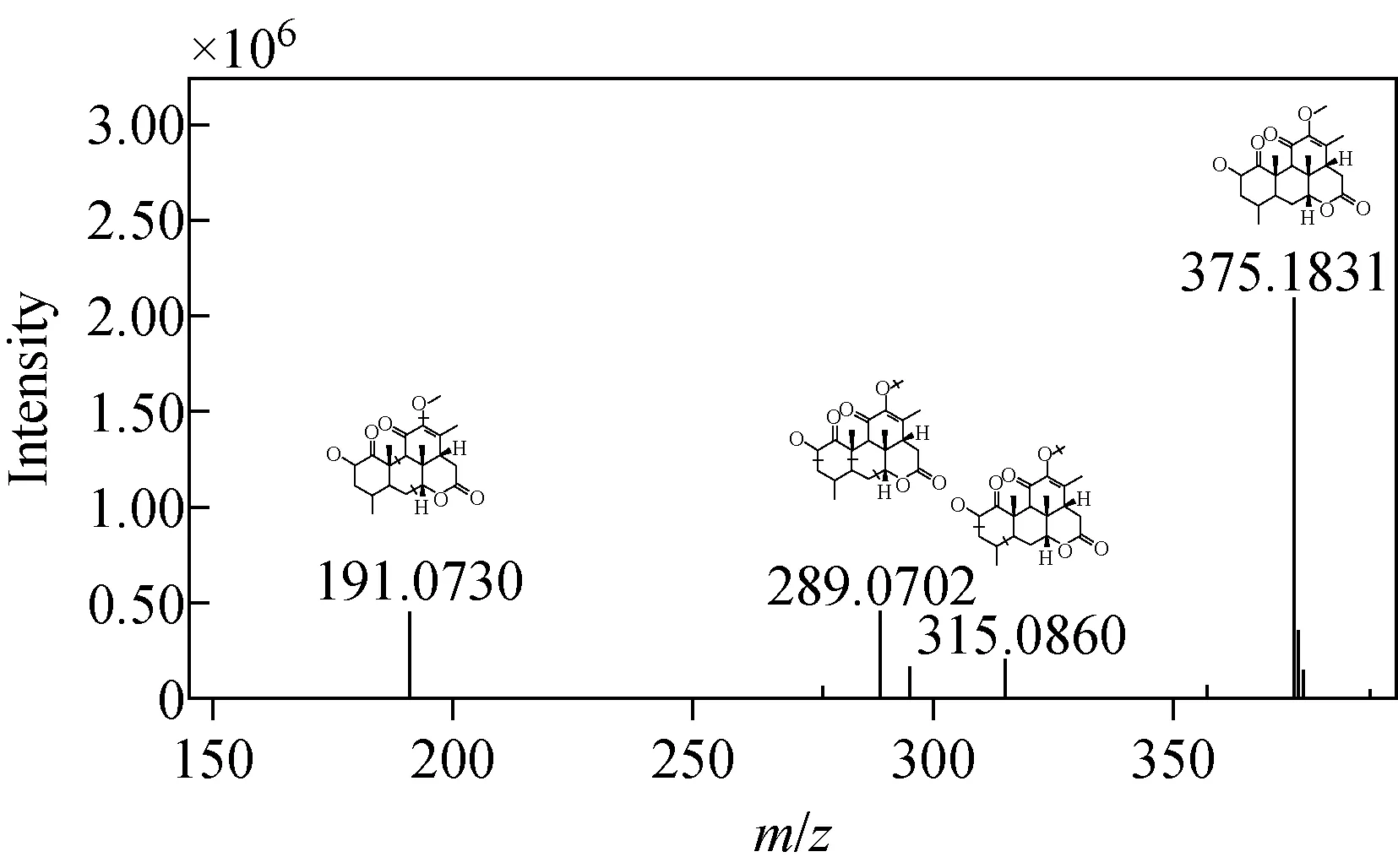
图4 苦木内酯Ⅰ的质谱图Fig.4 Mass spectrum of nigakilactone Ⅰ
2.3.2定量检测模型信息 按1.6节方法得到的线性标准曲线示于图5。结果可知,在可可壳粉掺入量为1%~50%范围内,苦木内酯Ⅰ峰面积与可可壳粉掺入量之间的线性关系良好,线性方程为y=187.82x+646.96,相关系数(R2)大于0.999 9,检出限(LOD,S/N≥3)为0.3%,定量限(LOQ,S/N≥10)为1%。
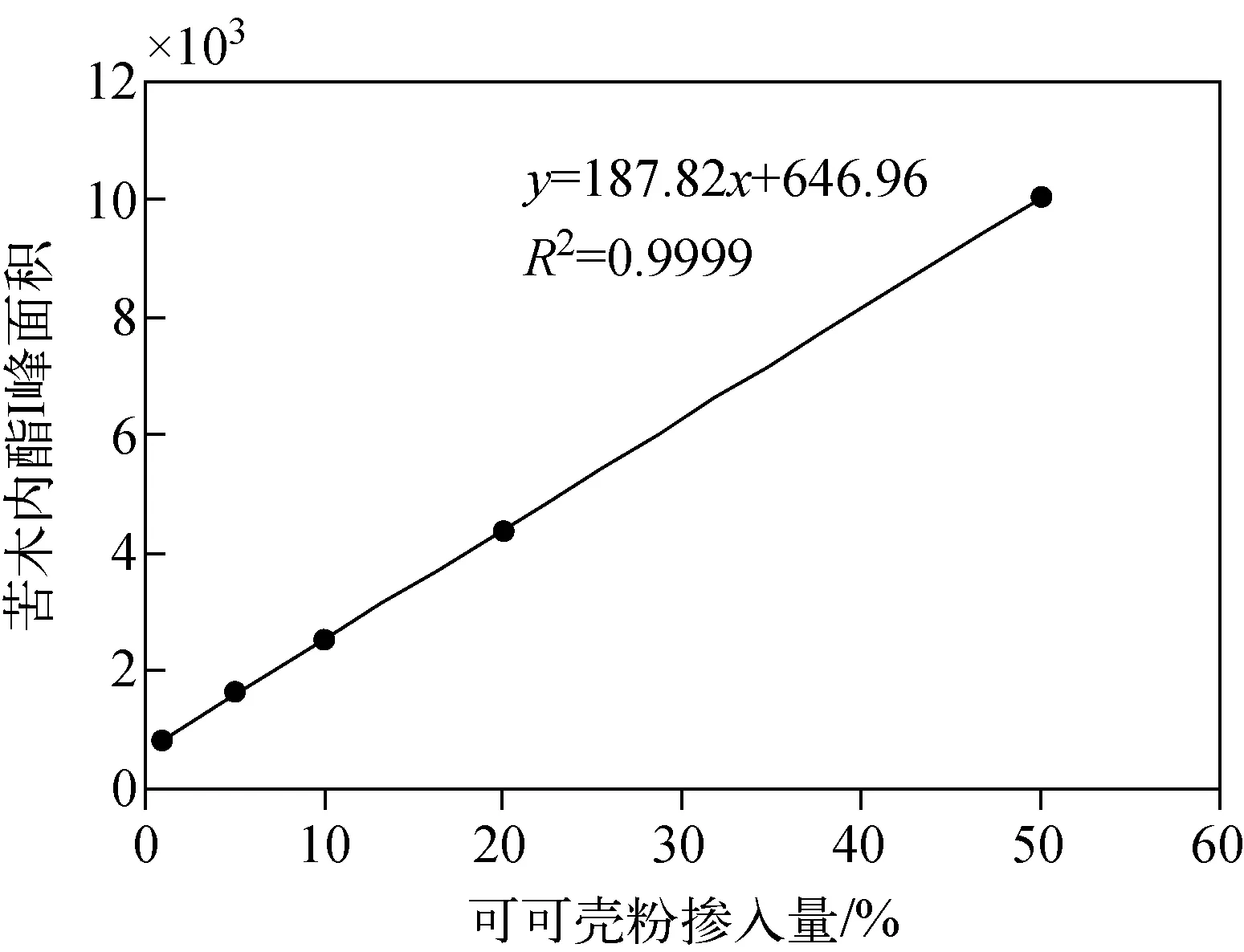
图5 苦木内酯Ⅰ峰面积和可可壳粉掺入量之间的标准曲线Fig.5 Standard curve between the peak area of nigakilactone Ⅰ and the content of cocoa shell powder
2.3.3盲样验证以及市售样品检测 为验证方法的可靠性与适用性,对模拟制备的3份盲样和4份市售可可粉样品进行定量检测,结果列于表4。其中,7份样品检测含量的相对标准偏差(RSD)在0.89%~2.28%范围内,表明本方法精密度良好;3份盲样检测出的可可壳粉含量与实际掺入量基本一致,相对误差在3.89%~7.81%范围内,表明本方法准确度较好;4份市售可可粉样品中可可壳粉的检测含量分别为9.03%、2.51%、3.33%、2.79%。参考CXS 141-1983规定,推测市售可可粉样品1中可能人为掺入了可可壳,其他3份市售样品中检测到的可可壳可能来自加工过程中的污染。由此,所建立的方法可用于市售可可粉中掺入可可壳的定量检测。
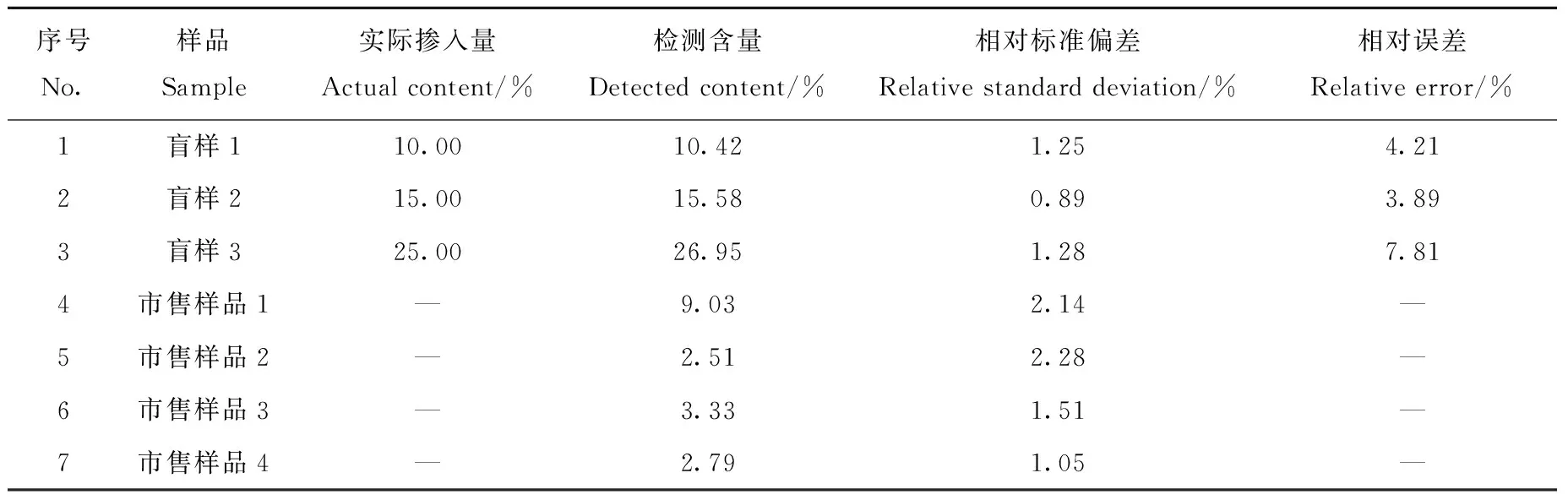
表4 盲样和市售可可粉样品中可可壳粉掺入量的检测结果Table 4 Results of the contents of cocoa shell power in blind samples and commercial samples
3 结论
为实现可可粉中可可壳的定性定量检测,本研究采用UPLC-QTOF MS/MS技术,以厄瓜多尔产地可可豆为研究对象,通过分析可可粉与可可壳粉中的组分差异,结合PCA和OPLS-DA模型,在无监督和有监督2种模式下,实现了对纯可可粉和可可壳粉的判别区分。在此基础上,发现苦木内酯Ⅰ是可可壳粉的特征标志物。苦木内酯Ⅰ属于苦木内酯类化合物,苦木内酯类化合物结构相似,为苦木科鸦胆子属植物中主体特征生物活性成分,具有杀虫止痢、抗疟、抗肿瘤、抗炎以及降血糖等多种功效[25]。
使用MS/MS模式检测掺有一定量可可壳粉的可可粉模拟样品,当沿用MSE模式中使用的液相色谱方法时,发现目标峰与其他杂峰未完全分离,且峰形有一定的拖尾现象。通过优化MS/MS模式下的流动相及其洗脱梯度,目标峰与其他杂峰的分离度较好,且峰形对称度良好,可用来定量检测可可粉中可可壳粉的掺入量。本方法的检出限为0.3%,定量限为1%,与HPLC等方法鉴别掺入可可壳的可可粉研究结果[2,9]对比,本方法的定量限更低,结果更准确。
本方法前处理简单、准确度高、重复性好、灵敏度高,可为市售可可粉样品的掺假鉴别提供技术手段。后续将会选择更多产地(如西非和亚洲等)的可可豆作为样品,以进一步补充和完善研究内容。
