基于荧光及紫外光谱法对虾青素与乳清蛋白相互作用的研究
2022-01-19赵英源张胜梦李一帆贾慧慧李紫薇刘俊霞李瑞芳
赵英源 ,张胜梦,李一帆,梁 晋,贾慧慧,李紫薇,刘俊霞,李瑞芳,2
(1.河南工业大学生物工程学院,河南郑州 450001;2.河南省小麦生物加工与营养功能重点实验室,河南郑州 450001)
虾青素是一种酮式类胡萝卜素[1],广泛存在于虾、蟹、鱼、藻类、酵母等生物中。虾青素分子式为C40H52O4,其分子结构为共轭多烯不饱和链,常见虾青素为紫红色粉末。Lu等[2]的研究发现,虾青素单体分子在水合溶剂中可以发生分子聚集,产生头与头面对面平行堆积卡包(Card-packed)构型的H聚集体(如图1A)和头与尾错位平行堆积头包尾(Head-totail)构型的J聚集体(如图1B)。LP)等[11]。乳清蛋白在提高免疫力[12]、抗氧化[13]、抗癌[14]、缓解疲劳[15]等方面有多种应用。并且乳清蛋白可以与多种小分子或生物大分子发生作用,具有配体结合性和可以结合多种金属离子的功能特性。乳清蛋白的组成和结构决定了它可作为载体运用,这些功能主要是由α-乳白蛋白、β-乳球蛋白以及牛血清蛋白所提供,所以研究选用了这三种蛋白以及浓缩乳清蛋白(Whey Protein Concentrate,WPC)进行研究。江萍[16]利用乳清蛋白包埋姜黄素形成载药纳米粒,提高了姜黄素在小肠上皮的吸收效率;Shafaei等[17]阐明β-乳球蛋白作为高效多样载体蛋白的潜力,以及其形成靶向性良好的纳米载体体系的能力;贾前生等[18]运用乳铁蛋白对姜黄素进行包载,发现构建的乳铁蛋白姜黄素纳米载药递送系统能够有效提升姜黄素的生物可利用率。本研究依据乳清蛋白良好的载体特性,拟构建虾青素/乳清蛋白纳米复合物解决虾青素水分散性差问题,并通过紫外光谱法和荧光光谱法分析虾青素聚集体与乳清蛋白(α-乳白蛋白、β-乳球蛋白、浓缩乳清蛋白、牛血清蛋白)的相互作用,探究虾青素聚集体与乳清蛋白的结合机制,以期提高虾青素及其聚集体的水分散性和生物利用度,并为乳清蛋白作为载体特性的应用提供理论依据。

图1 虾青素聚集体示意图[2]Fig.1 Schematic diagram of astaxanthin aggregates[2]
1 材料与方法
虾青素抗氧化性极强,并且具有抗肿瘤[3]、防癌症[4]、抗炎症[5]、光保护[6]、视力保护[7]、中枢神经的保护[8]及预防心血管疾病[9]等多种对人类有益的生理功能。这些生理功能使其在医药、食品等行业有着广泛的应用。但是虾青素水分散性较差,并且在光、热、氧气等条件下容易发生分解不稳定,导致其生物利用度较低,使虾青素的应用受到限制[10]。乳清蛋白主要生物活性成分包括α-乳白蛋白(α-lactalbumin Solution,α-La)、β-乳球蛋白(β-lactoglobulin,β-Lg)、牛血清蛋白(Bovine Serum Albumin,BSA)、免疫球蛋白(Immunoglobulins,Ig)、乳铁蛋白(Lactoferrin,LF)、乳过氧化物酶(Lactoperoxidase,
1.1 材料与仪器
虾青素 纯度99%,分子量596.84 kDa,上海阿拉丁生化科技股份有限公司;α-乳白蛋白 纯度85%,分子量14.2 kDa,上海源叶生物科技有限公司;β-乳球蛋白(纯度90%,分子量18.3 kDa)、牛血清蛋白(纯度97%,分子量66.430 kDa) 北京索莱宝科技有限公司;浓缩乳清蛋白粉 蛋白含量80%,美国Glanbia营养有限公司;无水乙醇等 国药化学试剂有限公司。
FA1004精密电子天平 上海舜宇恒平科学仪器有限公司;AMM-6T多点磁力搅拌器 天津奥特赛恩斯仪器有限公司;Nano-S90马尔文粒度仪、Nano-Z Zeta电位仪 英国马尔文仪器有限公司;UPT-II-10T优普系列超纯水器 四川优普超纯科技有限公司;DHG-9140A 电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;MJ-78A高压灭菌锅 施都凯仪器设备(上海)有限公司;DF-101S集热式恒温磁力搅拌器 巩义市予华仪器有限责任公司;RF-6000荧光分光光度计 日本株式会社岛津制作所;UV-3100紫外可见分光光度计 上海美谱达仪器有限公司。
1.2 实验方法
1.2.1.1 虾青素溶液的制备 参考Lu等[2]的方法,略有修改,配制虾青素母液。准确称取0.00250 g虾青素置于100 mL烧瓶中,加入100 mL无水乙醇溶解虾青素,在室温避光的条件下200 r/min磁力搅拌1 h,配制浓度为0.0250 mg/mL的虾青素溶液,使用时现配现用。
1.2.1.2 乳清蛋白的制备 参考江萍[16]的方法,略有修改,配制乳清蛋白母液。
α-乳白蛋白溶液(α-La)的制备:称取10 mgα-乳白蛋白白色固体粉末,加入到10 mL无菌水中,制备浓度为1 mg/mL的α-乳白蛋白溶液为母液,4 ℃冷藏。取1 mLα-La母液,加入到39 mL无菌水中得到0.025 mg/mLα-La溶液;取1 mLα-La母液加入到31.5 mL无菌水中得到溶液0.03 mg/mLα-La溶液。
β-乳球蛋白(β-Lg)溶液的制备:称取10 mgβ-乳球蛋白白色固体粉末,加入到10 mL无菌水中,制备浓度为1 mg/mL的β-乳球蛋白溶液为母液,4 ℃冷藏。取1 mLβ-Lg母液,加入到39 mL无菌水中得到0.025 mg/mLβ-Lg溶液;取1 mLβ-Lg母液加入到31.5 mL无菌水中得到0.03 mg/mLβ-Lg溶液。
浓缩乳清蛋白(Whey Protein Concentrate,WPC)溶液的制备:称取10 mg浓缩乳清蛋白白色固体粉末,加入到10 mL无菌水中,制备浓度为1 mg/mL的浓缩乳清蛋白溶液为母液,4 ℃冷藏。取1 mL 浓缩乳清蛋白母液,加入到39 mL无菌水中得到0.025 mg/mL WPC溶液;取1 mL浓缩乳清蛋白母液加入到31.5 mL无菌水中得到0.03 mg/mL WPC溶液。
牛血清蛋白(Bovine Serum Albumin,BSA)溶液的制备:称取10 mg牛血清蛋白粉末,加入到10 mL无菌水中,制备浓度为1 mg/mL的牛血清蛋白溶液为母液,4 ℃冷藏。取1 mL BSA母液,加入到39 mL无菌水中得到0.025 mg/mL BSA溶液;取1 mL BSA母液加入到31.5 mL无菌水中得到0.03 mg/mL BSA溶液。
以侵权责任的承担来惩罚未经许可演绎人的侵权行为,以著作权的赋予来奖励未经许可演绎人的创作行为。这既是对法律规范的严格遵循,也是对演绎人智力创造劳动的鼓励,符合知识产权法立法精神。著作权行使方式的特点,在保护了未经许可演绎人利益的同时,兼顾了原作品著作权人的利益。
1.2.1.3 H型/J型聚集体虾青素与乳清蛋白纳米复合物的可控制备 本实验分别对α-乳白蛋白、β-乳球蛋白、乳清蛋白粉、牛血清蛋白包载的虾青素进行相关探究。运用分子层层自组装法进行制备[19]。以下八种纳米复合物溶液所用四种蛋白终浓度均为0.02 mg/mL,所用虾青素(AST)终浓度均为0.005 mg/mL。
H型/J型虾青素/α-乳白蛋白纳米复合物(H/J Aggregates Astaxanthin/α-La Nanocomplexes,H/JALaNs)的制备如下。H-ALaNs:吸取2 mL 0.025 mg/mL AST溶液,逐渐滴加到8 mL 0.025 mg/mLα-La溶液,200 r/min避光磁力搅拌10 min;J-ALaNs的制备:吸取10 mL 0.025 mg/mL AST溶液,向其中加入7.5 mL无水乙醇,磁力搅拌10 min后吸取3.5 mL逐滴加入到6.5 mL 0.03 mg/mLα-La溶液中,200 r/min避光磁力搅拌10 min。
H型/J型 虾 青 素/β-乳 球 蛋 白 纳 米 复 合 物(H/J Aggregates Astaxanthin/β-Lg Nanocomplexes,H/J-ALgNs)的制备:H-ALgNs的制备如下。吸取2 mL 0.025 mg/mL AST溶液,逐渐滴加到8 mL 0.025 mg/mLβ-Lg溶液,200 r/min避光磁力搅拌10 min;J-ALgNs的制备:吸取10 mL 0.025 mg/mL AST溶液,向其中加入7.5 mL无水乙醇,磁力搅拌10 min后吸取3.5 mL逐滴加入到6.5 mL 0.03 mg/mLβ-Lg液中,200 r/min避光磁力搅拌10 min。
H型/J型虾青素/浓缩乳清蛋白纳米复合物(H/J Aggregates Astaxanthin/Whey protein concentrate Nanocomplexes,H/J-AWNs)的制备如下。H-AWNs的制备:吸取2 mL 0.025 mg/mL AST溶液,逐渐滴加到8 mL 0.025 mg/mL WPC溶液,200 r/min避光磁力搅拌10 min;J-AWNs的制备:吸取10 mL 0.025 mg/mL AST溶液,向其中加入7.5 mL无水乙醇,磁力搅拌10 min后吸取3.5 mL逐滴加入到6.5 mL 0.03 mg/mL WPC溶液中,200 r/min避光磁力搅拌10 min。
H型/J型虾青素/牛血清蛋白纳米复合物(H/J Aggregates Astaxanthin/Bovine Serum Albumin Nanocomplexes,H/J-ABNs)的制备如下。H-ABNs的制备:吸取2 mL 0.025 mg/mL AST溶液,逐渐滴加到8 mL 0.025 mg/mL BSA溶液,200 r/min避光磁力搅拌10 min;J-ABNs的制备:吸取10 mL 0.025 mg/mL AST溶液,向其中加入7.5 mL无水乙醇,磁力搅拌10 min后吸取3.5 mL逐滴加入到6.5 mL 0.03 mg/mL BSA溶液中,200 r/min避光磁力搅拌10 min。
1.2.2 虾青素/乳清蛋白纳米复合物的外观分析 通过1.2.1的方法对虾青素/乳清蛋白纳米复合物进行制备,将新鲜制备的虾青素纳米复合物悬液装入适合的玻璃样品瓶中,密封、室温25 ℃、避光条件下储存,观察其溶液状态,对其进行外观分析。
1.2.3 虾青素/乳清蛋白纳米复合物的粒径及电位测量 粒径、多分散性指数(PDI)的测定[20]:打开马尔文粒度仪预热30 min。清洗比色皿,并用待测液润洗两次,取新鲜制备的纳米复合物1 mL加入粒径样品皿中,放入卡槽中,测量角度为90o,测试温度为25 ℃,平衡时间为120 s,循环次数为90次,分散介质为水。每个样品测量四次,取平均值,进行数据分析。
Zeta电位的测定:根据亨利方程(Henry)公式。虾青素/乳清蛋白纳米复合物的电位采用动态光散射的方法,测试时首先测得复合物的电泳速率UE,然后根据亨利方程(Henry)求得虾青素/乳清蛋白纳米复合物的电位,测试温度为25 ℃,样品平衡时间120 s。样品比色皿为1 cm聚苯乙烯池,采用一对0.45 cm2铂电极,间距为0.4 cm。每个样品测量四次,取平均值,进行数据分析。
1.2.4 虾青素/乳清蛋白纳米复合物的透射电镜观察按照Preethi等[21]的方法略有调整。取一滴样品滴于洁净的石蜡板上,将铜网轻轻放在液滴表面使液滴浸入铜网格中。大约10 min后取下铜网,用滤纸将铜网表面液体擦干,沾有液体表面的铜网为正面朝上放置。将铜网正面与磷钨酸液滴接触染色10 min,取下铜网,室温下干燥后,放入透射电子显微镜中观察。
1.2.5 虾青素/乳清蛋白纳米复合物的紫外吸收光谱测量 按照Qiao等[22]的方法略有调整,打开紫外可见分光光度计,预热15 min,用待测溶液润3次石英比色皿。参数设置扫描范围为200~800 nm;间距为1.0 nm;精度为10。测定样品的紫外光谱,用灭菌超纯水做基线校准。
1.2.6 虾青素/乳清蛋白纳米复合物的荧光检测 按照Liu等[23]的方法略有调整,将制备的虾青素/乳清蛋白纳米复合物以及α-乳白蛋白溶液、β-乳球蛋白溶液、浓缩乳清蛋白溶液、牛血清蛋白溶液分别进行荧光光谱扫描。发射光谱扫描的参数设置如下,设置激发波长固定为280 nm,发射光谱范围设置为290~450 nm,激发和发射的狭缝宽度固定在10 nm,扫描速度为6000 nm/min。在上述参数设置下得到其相应的荧光光谱。
1.3 数据处理
本文运用Microsoft Excel 2020等软件处理试验数据,获得虾青素与乳清蛋白相互作用的紫外可见光吸收光谱、荧光光谱,并且由谱图分析两者相互作用机制。
2 结果与分析
2.1 虾青素/乳清蛋白纳米复合物的外观分析
研究选用了α-乳白蛋白(α-La)、β-乳球蛋白(β-Lg)、牛血清蛋白(BSA)三种单一蛋白及浓缩乳清蛋白(WPC),由1.2.1所示的分子自组装方法,制备出H/J-ALaNs、H/J-ALgNs、H/J-AWNs、H/J-ABNs溶液。如图2所示四种蛋白所构建的纳米复合物当中,其中H型-虾青素/乳清蛋白纳米复合物均为浅黄色均一透明溶液、无沉淀、无絮凝;J型-虾青素/乳清蛋白纳米复合物均为粉紫均一透明溶液、无沉淀、无絮凝。四种复合物在颜色深浅上存在差异。Lu等[2]的研究发现,虾青素单体分子以“面对面”平行的共轭链堆叠而成H聚集体,相对于虾青素游离单体的最大吸收波长发生蓝移,H聚集体颜色为黄色。以松散的虾青素单体分子错位平行堆叠组成的J聚集体,相对于虾青素游离单体的最大吸收波长发生红移,显现粉紫色[24]。根据实验室前期的研究[25]可知,虾青素H聚集体和J聚集体可被包裹在DNA-壳聚糖构建的疏水微区中,使形成的纳米悬液呈现出相应的颜色。参考李敬等[26]的研究,推测虾青素以H聚集体或J聚集体嵌入蛋白的疏水微区中,后期可以通过紫外光谱或荧光光谱等方法进行进一步的分析。

图2 虾青素/乳清蛋白纳米复合物样品图Fig.2 Sample diagram of astaxanthin/whey protein nanocomplex
2.2 虾青素/乳清蛋白纳米复合物的粒径及电位
利用动态光散射仪测量虾青素/乳清蛋白纳米复合物的粒径及电位,得到结果如表1。

表1 虾青素/乳清蛋白纳米复合物的粒径及电位Table 1 Particle size and potential of astaxanthin/whey protein nanocomplex
表1 为乳清蛋白与虾青素制备的纳米复合物所对应的粒径、多分散性指数(PDI)、电位。因蛋白空间结构不同,其中α-乳白蛋白相较于其他三种蛋白与J聚集体虾青素所形成的纳米复合物的粒径相较较小,β-乳球蛋白相较于其他三种蛋白与H聚集体虾青素形成的纳米复合物的粒径小,导致不同蛋白与虾青素相互作用程度不同,多分散指数有所差异。由表1可知H聚集体的粒径普遍小于J聚集体,且前者的PDI和电位大于后者,猜测是因为H聚集体虾青素与J聚集体虾青素的结构不同所造成的。Zhao等[27]分析了首尾相连结构的J-AST和层层堆叠结构的H-AST。其中首尾相连的结构相对于层层堆叠,形成的复合物的粒径较大。体系粒径减少会导致乳液中分散粒子的相互作用增大,从而提高乳液的稳定性[24]。乳液的稳定是由液滴间的静电排斥维持的,因此体系电位值可侧面反映体系稳定性[26]。由表1可知四种蛋白与虾青素形成复合物的电位也有较为明显的差异,其中H型/J型虾青素/α-乳白蛋白纳米复合物有较高电位,一定程度上表明其稳定性较高。由表1数据可知,虾青素/乳清蛋白纳米复合物粒径均在150~430 nm之间,PDI分散性良好,电位在−12~−1 mV之间。参考刘俊丽等[28]的研究,说明实验成功制备出虾青素/乳清蛋白纳米复合物。
2.3 虾青素/乳清蛋白纳米复合物的透射电镜观察
由前期实验探究发现,β-乳球蛋白、浓缩乳清蛋白不能形成稳定的纳米粒,α-乳白蛋白市价较贵,所以选用牛血清蛋白进行接下来的实验。采用1.2.1.3中的方法成功制备H-ABNs和J-ABNs纳米复合物,通过TEM观察制备的样品的样貌,其结果如图3所示。
由图3可以看出H/J-ABNs溶液近似为球形,这与Wu等[29]制备的纳米复合物形状相似。如图3,形成的纳米复合物中间为黑色的,结合紧密的实心球状物,球状物外部呈灰色且结合较为疏松,推测是牛血清白蛋白形成了核-壳结构排列在外部,中间黑色球状物为虾青素,被包裹在牛血清蛋白的核-壳纳米结构中。由图3中对比可以看出J-ABNs溶液的纳米粒径要大于H-ABNs溶液的纳米粒径,通过2.2中对于H/J-ABNs溶液的粒径的测量可知,H-ABNs溶液的水合粒径为251 nm,J-ABNs溶液的水合粒径为357 nm,J-ABNs溶液的水合粒径大于H-ABNs溶液的水合粒径。DLS测得的水合粒径大于透射电镜所测得的纳米粒径,这可能是由于电镜测量时需要脱水造成的[30]。该透射电镜图表明,虾青素/乳清蛋白纳米复合物(H/J-ABNs)的纳米粒子分布均匀,虾青素被包裹在乳清蛋白形成的核-壳纳米结构中,说明虾青素/乳清蛋白纳米复合物(H/J-ABNs)成功制备。

图3 H/J-ABNs复合物透射电镜图Fig.3 Transmission electron microscopy of H/ J-ABNs complex
2.4 虾青素/乳清蛋白纳米复合物的紫外可见光谱分析
对虾青素/乳清蛋白纳米复合物进行紫外光谱扫描,在300~800 nm得到光谱如图4。
由图4可知H型-虾青素/乳清蛋白纳米复合物普遍在388 nm左右存在一个吸收峰,因H聚集体不稳定,向J聚集体进行转换,导致A、C、D的H聚集体在480 nm处存在另外一个吸收峰,而J-ALaNs在519和556 nm左右有两处显示并肩峰。乳清蛋白中的酪氨酸(Tyr)、苯丙氨酸(Phe)、色氨酸(Trp)在300~800 nm没有吸收峰[31],而本研究中虾青素/乳清蛋白纳米复合物的吸收峰明显,这一变化与Zhao等[32]研究的H型/J型虾青素/DNA/壳聚糖纳米复合物的紫外可见吸收光谱基本相似,这是虾青素所造成的。虾青素/乳清蛋白纳米复合物中虾青素H聚集体光谱由单体480 nm蓝移至388 nm,虾青素J聚集体光谱红移,并显示出519和556 nm左右的并肩峰,表明虾青素对乳清蛋白产生了影响,两者结合形成了纳米复合物。

图4 虾青素/乳清蛋白纳米复合物的紫外光谱Fig.4 Ultraviolet spectrogram of astaxanthin/whey protein nanocomplex
2.5 虾青素/乳清蛋白纳米复合物的荧光光谱分析
在270~300 nm激发光下可发出内源荧光的蛋白质分别为酪氨酸、色氨酸、苯丙酸这三种氨基酸的残基,其中色氨酸的荧光强度最大[33]。三种发光基团的荧光峰特征见表2。氨基酸残基的荧光发射波长与其所处的微环境有关,环境极性增加则发生峰红移,疏水性增加则发生峰蓝移[34]。对α-乳白蛋白、β-乳球蛋白、浓缩乳清蛋白、牛血清蛋白形成的虾青素/乳清蛋白纳米复合物以及α-乳白蛋白溶液、β-乳球蛋白溶液、浓缩乳清蛋白溶液、牛血清蛋白溶液分别进行荧光扫描,得到的荧光强度如图5所示。
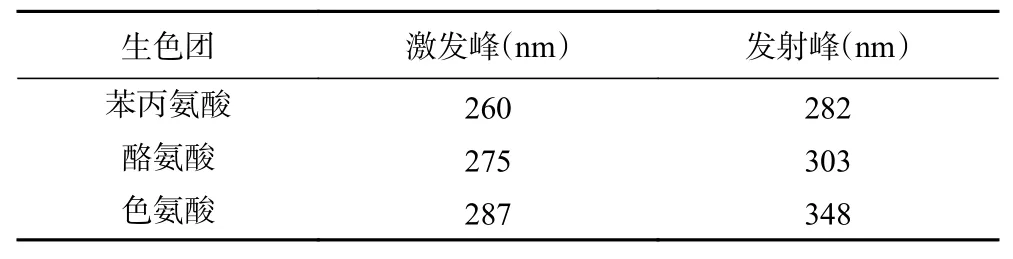
表2 三种发光基团的荧光峰特征Table 2 Fluorescence peak characteristics of three luminescent clusters
由图5看出,四种蛋白形成虾青素/乳清蛋白纳米复合物后的荧光强度与对应的蛋白相比均增强。虾青素作为一种含共轭双键的短链多烯类生物分子,和其他类胡萝卜素分子一样有宽带荧光[35]。虾青素有两个β-紫罗兰酮环和11个共轭双键,这种结构导致了虾青素/乳清蛋白纳米复合物荧光强度的增加。同时虾青素本身可发生分子自聚集形成具有内源荧光的虾青素H聚集体和虾青素J聚集体,使虾青素/乳清蛋白纳米复合物的荧光强度增强。这与鲁瑞梅等[36]发现共轭聚合物会使荧光增强的实验结果一致,并且与通过改变温度和加入聚合乳清蛋白导致的蛋白质荧光强度增加[33]结果相似。
α-乳白蛋白形成的两种纳米复合物H/J-ALaNs的最大发射波长发生红移,表明形成的纳米复合物使色氨酸等残基的光强猝灭,且所处的微环境极性更强[37]。虾青素与α-乳白蛋白结合后形成的纳米复合物与张明等[38]发现的乳白蛋白结合油酸或亚油酸后的荧光光谱的变化相似,乳白蛋白中的色氨酸所处微环境的极性增强。同时β-乳球蛋白形成的两种纳米复合物,J-ALgNs的最大发射波长相对于β-Lg发生红移;H-ALgNs相对于β-Lg发生蓝移。其中JALgNs的红移说明β-Lg疏水性下降,结合位点的氨基酸残基部分可能暴露在溶剂中,H-ALgNs发生较少蓝移,推测是虾青素H聚集体的特殊结构导致β-Lg疏水性增强。由图5可知,浓缩乳清蛋白的最大发射波长为335 nm。H/J-AWNs纳米复合物的最大发射峰仍在335 nm左右,与浓缩乳清蛋白的最大发射峰为335 nm相比,几乎未发生移动。参考Burstezin等[39]的研究,色氨酸残基的最大发射峰在335 nm,部分色氨酸残基处于蛋白质内部非极性区域,另一部分可能处于蛋白质表面区域,并与水溶液的相互接触受到限制或整体处于水溶液中。由图5得牛血清蛋白的荧光峰位于342 nm处,符合表2中色氨酸发射波长范围,可以确定牛血清蛋白中的主要发光基团为色氨酸残基。且牛血清蛋白与虾青素H/J聚集体形成纳米复合物后峰值出现蓝移,溶液疏水性增加[40]。根据发射波长的移动判断,虾青素与牛血清蛋白结合,导致色氨酸所处微环境发生改变。

图5 虾青素/乳清蛋白纳米复合物的荧光光谱图Fig.5 Fluorescence spectra of the whey protein/astaxanthin nanocomplex
3 结论
本文选用乳清蛋白与虾青素构建纳米复合物,并实现乳清蛋白对虾青素H聚集体和J聚集体的可控载运。本实验主要采用紫外可见分光光谱法和荧光光谱法对乳清蛋白与虾青素聚集体的相互作用机制进行探究。研究表明虾青素/乳清蛋白纳米复合物的水合粒径均在150~430 nm范围内,且J-ABNs纳米复合物的粒径要大于H-ABNs纳米复合物的粒径。在虾青素/乳清蛋白纳米复合物中,虾青素H聚集体紫外可见吸收波长λmax由虾青素单体480蓝移至388 nm,虾青素J聚集体紫外可见光谱发生红移,并显示出519和556 nm左右的并肩峰。虾青素聚集体与乳清蛋白的相互作用能改变芳香族氨基酸残基在空间结构中所处的微环境的极性变化,引起乳清蛋白的构象变化。本研究为提高虾青素及其聚集体的水分散性和拓展乳清蛋白载体特性的应用提供理论基础。
