PIK3CA基因沉默对宫颈癌生物学特性影响及机制
2022-01-13游兴文王秀琴王艳虹杨敏李鸿超杨林青
游兴文,王秀琴,王艳虹,杨敏,李鸿超,杨林青
(1 濮阳市油田总医院妇产科,河南 濮阳 457001;2 濮阳市油田总医院病理科;3 许昌学院)
宫颈癌是发病率位居女性生殖系统恶性肿瘤首位的一类妇科肿瘤,其病死率逐年升高且呈年轻化趋势[1]。我国也是宫颈癌的高发国家[2]。上皮间质转化(EMT)是指上皮细胞获得具备侵袭邻近组织的生物学特性,从而在肿瘤侵袭转移中发挥重要作用[3]。E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)和波形蛋白(Vimentin)等是EMT的重要标志性因子,在多种肿瘤中异常表达[4-6]。基因沉默技术通过调控基因表达,在转录或翻译水平上阻断特定基因的异常表达,可达到对特定基因的外源性表达调控,进而发挥治疗疾病的作用[7]。磷脂酰肌醇-3激酶(PI3K)/PKB蛋白激酶(又称AKT)信号通路是一类在细胞内发挥促进细胞增殖、抑制细胞凋亡作用的细胞存活相关信号转导途径[8]。临床对于通过基因沉默干预相关基因表达和信号转导途径在宫颈癌EMT的研究已有部分报道[9-11],但对于磷脂酰肌醇-4,5-二磷酸肌醇-3-激酶(PIK3CA)基因沉默介导PI3K/AKT信号通路对宫颈癌EMT的影响却鲜有报道。本研究通过探究人宫颈癌组织和细胞中PIK3CA的表达,并通过细胞转染和基因沉默,确认PIK3CA基因沉默介导PI3K/AKT信号通路对宫颈癌EMT的影响,以期为宫颈癌病人的分子治疗方案提供新思路。
1 材料与方法
1.1 实验材料
1.1.1主要试剂与仪器 人宫颈癌细胞系HeLa(中国科学院上海生物研究所),正常人宫颈鳞状上皮细胞CRL-2614(美国典型菌种保藏中心,ATCC);DMEM培养基(Gibco公司,美国);Lipofectamine 2000(Invitrogen公司,美国);免疫组化抗体(Abcam,剑桥,英国);Trizol和反转录试剂盒(宝生物工程有限公司,大连);PCR引物(深圳华大基因有限公司合成);蛋白质印迹(Western blot)抗体(abcam公司,英国);化学发光后凝胶成像系统(北京六一凝胶成像仪);Quantity One软件(BIO-RAD公司,美国);噻唑蓝(MTT)和二甲基亚砜(DMSO)溶液(Sigma公司,美国);酶标仪(BioTek公司,美国);Annexin-V-FITC细胞凋亡检测试剂盒和碘化丙啶(PI)染料(Sigma公司,美国);流式细胞仪(Coulter Corporation公司,美国)。
1.1.2临床标本 收集我院2016年1月—2019年1月经病理检查证实的188例宫颈癌病人(年龄27~69岁,平均(52.32±6.50)岁)癌组织及癌旁组织标本。所有病人临床资料完整,均排除其他系统肿瘤,术前均未接受抗肿瘤治疗。本研究已通过本院伦理委员会批准,均取得病人及其家属同意,采取自愿原则并签署知情同意书。
1.2 实验方法
1.2.1免疫组化检测 将宫颈癌及癌旁组织经甲醛固定,进行石蜡包埋,厚度3 μm连续切片,70 ℃烤片15 min,梯度乙醇脱水,PBS漂洗3次。用正常山羊血清室温孵育15 min。滴加20~30 μL以PBS稀释的PIK3CA一抗,4 ℃孵育过夜,用PBS替代第一抗体作阴性对照。加入二抗,于37 ℃下孵育45 min,DAB显色5~10 min。苏木精复染后,进行脱水、透明、封片,光学显微镜下观察。免疫组化检查结果判定:由高年资病理医师阅片,采用双盲法分别判断。按癌细胞免疫组织化学染色强弱计分:阴性为0分;淡黄色染色为1分;中度黄色染色为2分;棕黄色染色为3分。按照阳性细胞率计分:阳性细胞≤5%为0分;6%~25%为1分;26%~50%为2分;>50%为3分。各基因蛋白表达强度基于染色深浅和阳性细胞率综合判定,以两者的乘积≥3分为阳性表达,<3分为阴性表达。
1.2.2细胞培养与筛选 人宫颈癌细胞系HeLa培养于DMEM培养基,进行传代培养,置含体积分数0.05 CO2、37 ℃恒温培养箱中常规培养,2~3 d传代1次。取对数生长期的细胞进行实验。采用实时定量PCR(qRT-PCR)检测PIK3CA相对表达量。
1.2.3细胞转染与分组 选择培养生长至对数生长期的细胞,收集细胞悬液接种于6孔板,给予新鲜完全培养基培养至细胞融合度为50%~80%时进行转染。脂质体转染依据Lipofectamine 2000使用说明进行,配制转染试剂和质粒或载体的复合物(200 μL),混匀后转染,置含体积分数0.05 CO2、37 ℃恒温培养6 h,换含有血清的正常培养基。将细胞分为如下6组:Blank组(a组:人宫颈癌细胞)、NC组(b组:人宫颈癌细胞+转染空白载体质粒)、HA-PIK3CA组(c组:人宫颈癌细胞+PIK3CA过表达载体)、PIK3CA-siRNA组(d组:人宫颈癌细胞+转染PIK3CA抑制表达质粒)、LY294002组(e组:人宫颈癌细胞+PI3K/AKT信号通路拮抗剂)以及LY294002+PIK3CA-siRNA组(f组:人宫颈癌细胞+PI3K/AKT信号通路拮抗剂+转染PIK3CA-siRNA质粒),进行后续实验。
1.2.4qRT-PCR检测 取临床标本并收集转染后各组细胞,Trizol法提取细胞、组织中总RNA,测定RNA的浓度和纯度。按照反转录试剂盒说明书将样品RNA反转为cDNA。在cDNA中加入65 μL的DEPC水稀释,并充分混匀,配制Real-time PCR反应体系。PCR扩增条件:95 ℃预变性1 min;95 ℃变性30 s,58 ℃退火5 s,共循环30次;72 ℃延伸5 s。以GAPDH为内参照,每个样品的每个基因设3个复孔。按 2-△△Ct方法计算目的基因相对表达量。
1.2.5Western blot检测 收集转染后各组细胞,加入裂解液。冰浴中匀浆粉碎,离心提取上清,为总蛋白提取液。取细胞总蛋白进行 SDS-PAGE电泳,转至 PVDF膜,TBST 洗膜 1 次。采用50 g/L脱脂奶粉封闭,摇床孵育2 h后,TBST洗膜,加入以封闭液稀释的一抗(PIK3CA、PI3K、AKT、E-cadherin、N-cadherin、Vimentin和GAPDH),4 ℃摇床孵育过夜。室温下TBST洗膜后,加入稀释的经辣根过氧化物酶标记的二抗,室温孵育。化学发光后凝胶成像系统成像,保存图片。采用Quantity One软件测定灰度值。
1.2.6MTT检测 收集转染后各组细胞,按一定密度稀释细胞并制成单细胞悬液,调整细胞密度后接种于96孔板中,置于CO2培养箱中37 ℃培养24、48、72 h。随后每孔避光加入10 μL的 MTT溶液孵育4 h。小心吸出培养液,每孔避光加入100 μL的DMSO溶液。振荡避光溶解后,用酶标仪检测490 nm波长处各孔吸光度(A)值,并绘制细胞活力曲线图。
1.2.7流式细胞术检测 各组细胞转染48 h后,收集细胞于流式管后离心,弃上清。用预冷PBS洗涤细胞3次,离心弃上清。按照Annexin-V-FITC细胞凋亡检测试剂盒的说明,向每管细胞中加入5 μL的 Annexin-V-FITC,振荡混匀;避光,室温孵育后再加入5 μL的PI染料,振荡混匀。1 h内用流式细胞仪检测细胞凋亡变化。
1.3 统计学分析
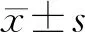
2 结 果
2.1 人宫颈癌组织PIK3CA蛋白表达及其与临床病理特征关系
PIK3CA蛋白表达阳性细胞为浅黄色至棕黄色样颗粒物质,见图1。PIK3CA蛋白在188例人宫颈癌组织阳性表达119例(63.30%),癌旁组织为41例(21.80%),癌组织的阳性表达率明显高于癌旁组织(χ2=23.581,P<0.05)。此外,PIK3CA蛋白表达与宫颈癌病人TNM分期、淋巴结转移和组织学分级均有关(χ2=6.766~31.171,P均<0.05),而与年龄、原发灶大小及病理组织类型无关(P>0.05)。见表1。
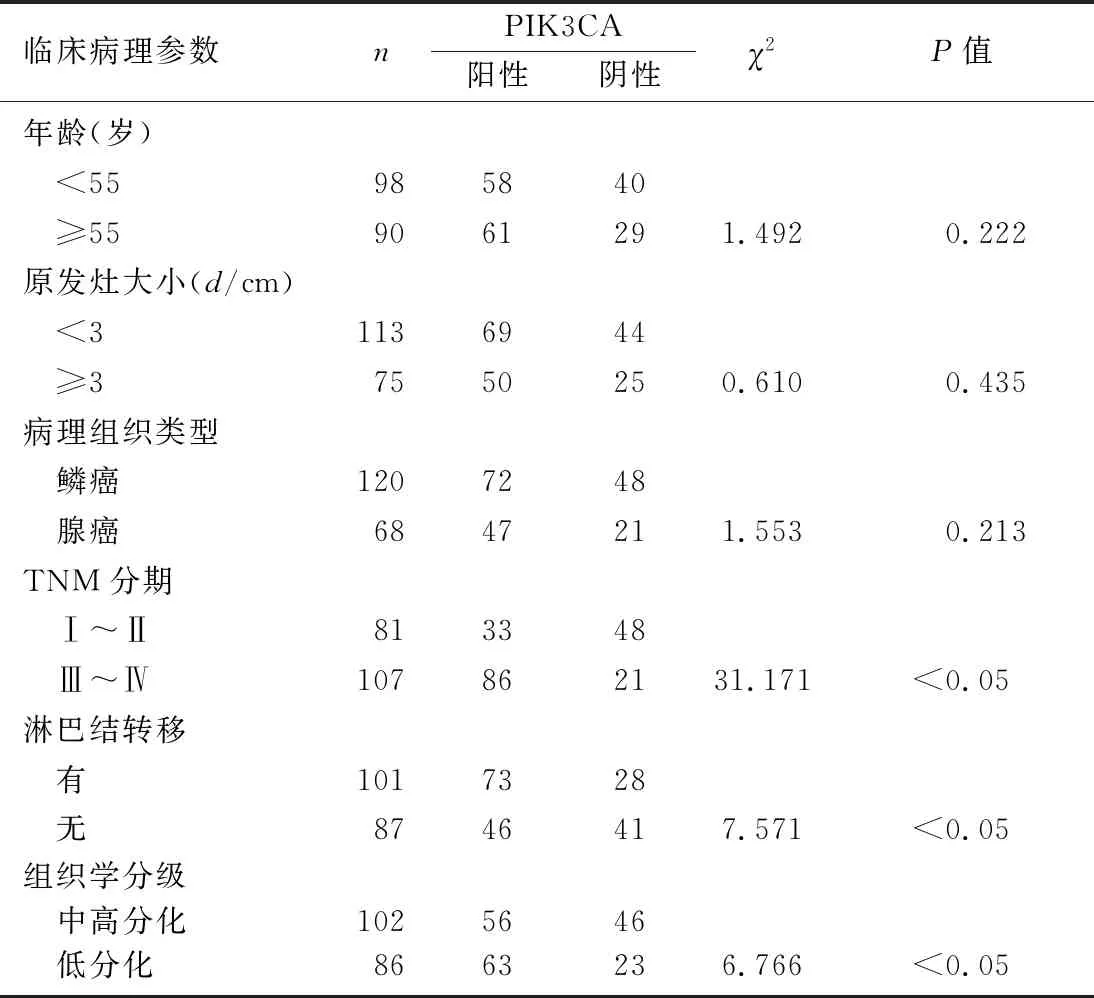
表1 人宫颈癌组织PIK3CA蛋白表达与临床病理特征的关系(n=188,例)
2.2 宫颈癌细胞株中PIK3CA基因的表达水平
qRT-PCR法检测HeLa细胞株中的PIK3CAmRNA表达的结果显示,HeLa细胞株PIK3CAmRNA表达量明显高于正常人宫颈鳞状上皮细胞(t=14.59,P<0.05)。见图2。
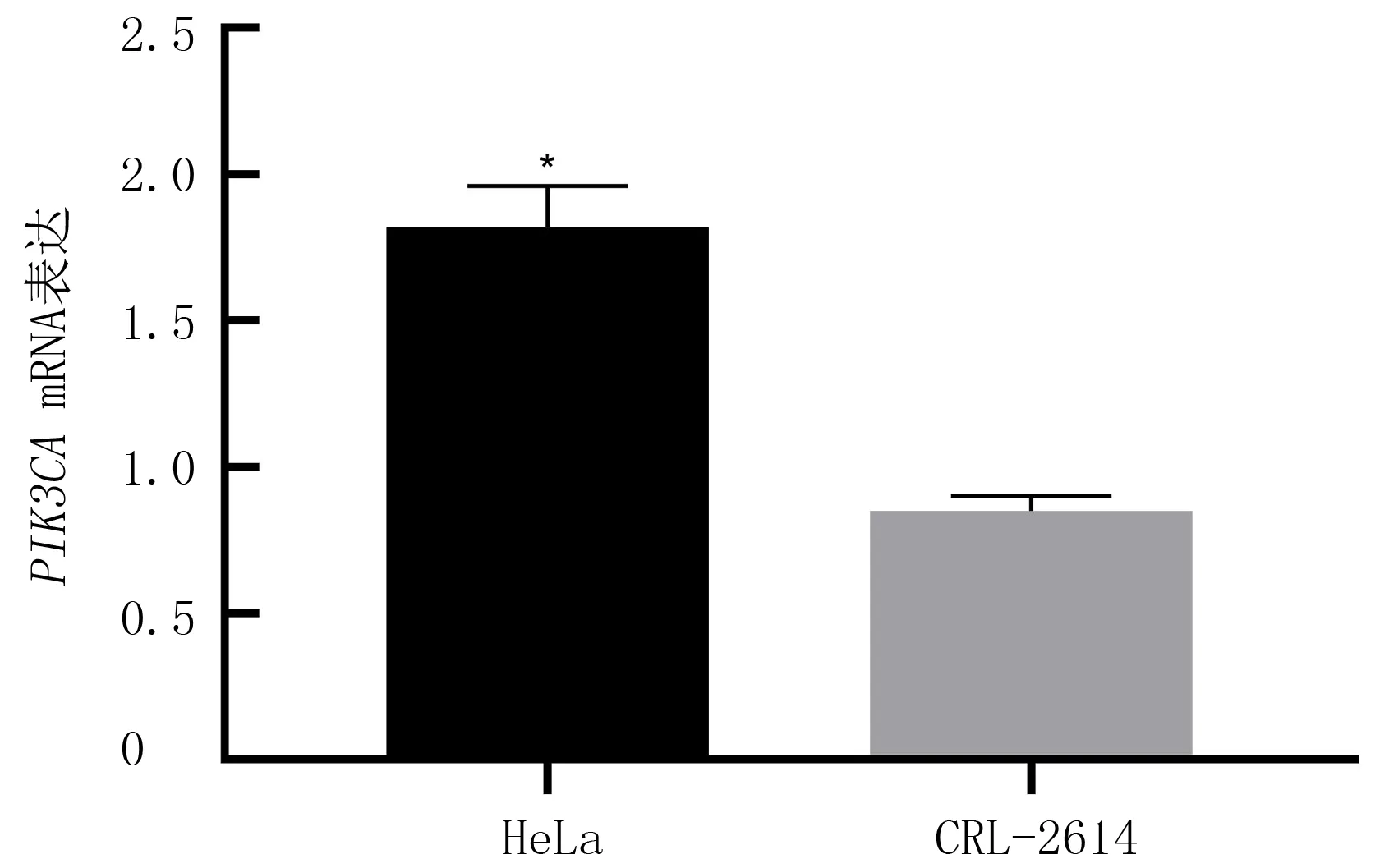
与正常人宫颈鳞状上皮细胞表达水平相比,*P<0.05。
2.3 沉默PIK3CA对宫颈癌细胞PI3K/AKT通路激活的影响
实验结果表明,在HeLa细胞系中,与NC组和Blank组相比,PIK3CA-siRNA组、LY294002组和LY294002+PIK3CA-siRNA组PIK3CA、PI3K、AKT的mRNA和蛋白相对表达量均明显降低(FmRNA=105.7~176.1,F蛋白=125.8~130.5,P均<0.05),HA-PIK3CA组mRNA和蛋白相对表达量均呈升高趋势(FmRNA=43.7~347.2,F蛋白=87.2~302.6,P<0.05);与PIK3CA-siRNA组和LY294002组相比,LY294002+PIK3CA-siRNA组中各基因的mRNA和蛋白相对表达量均显著降低(FmRNA=64.8~206.3,F蛋白=50.9~96.5,P<0.05)。而NC组和Blank组、PIK3CA-siRNA组和LY294002组比较,差异均无显著意义(P均>0.05)。见图3。

A:qRT-PCR检测mRNA表达。B:Western blot检测蛋白表达。C:相关信号蛋白表达比较。a:Blank组,b:NC组,c:HA-PIK3CA组,d:PIK3CA-siRNA组,e:LY294002组,f:LY294002+PIK3CA-siRNA组。与NC组和Blank组相比,*P<0.05;与PIK3CA-siRNA组和LY294002组相比,#P<0.05。
2.4 沉默PIK3CA对宫颈癌细胞EMT相关因子的影响
实验结果显示,与Blank组和NC组相比,HA-PIK3CA组的E-cadherinmRNA和蛋白表达均明显降低,N-cadherin和Vimentin的mRNA和蛋白表达量均明显增加(FmRNA=131.7~209.3,F蛋白=69.7~286.3,P均<0.05);而PIK3CA-siRNA组、LY294002组和LY294002+PIK3CA-siRNA组E-cadherin的mRNA和蛋白表达明显增加,N-cadherin和Vimentin的mRNA和蛋白表达明显降低(FmRNA=158.5~185.1,F蛋白=107.7~148.1,P均<0.05)。与PIK3CA-siRNA组和LY294002组相比,LY294002+PIK3CA-siRNA组的E-cadherin的mRNA和蛋白表达显著增加,N-cadherin和Vimentin的mRNA和蛋白表达量均显著降低(FmRNA=32.9~83.5,F蛋白=47.6~66.3,P均<0.05)。而NC组和Blank组比较、PIK3CA-siRNA组和LY294002组比较,差异均无显著性(P均>0.05)。见表2和图4。
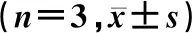
表2 PIK3CA对各组细胞的EMT相关因子mRNA和蛋白表达的影响

a:Blank组,b:NC组,c:HA-PIK3CA组,d:PIK3CA-siRNA组,e:LY294002组,f:LY294002+PIK3CA-siRNA组。
2.5 沉默PIK3CA对宫颈癌细胞增殖的影响
检测结果显示,与NC组和Blank组相比,HA-PIK3CA组过表达PIK3CA可明显促进细胞增殖(F=24.6~32.1,P均<0.05);PIK3CA-siRNA组、LY294002组和LY294002+PIK3CA-siRNA组细胞增殖均受到明显地抑制(F=28.0~98.8;P均<0.05)。与PIK3CA-siRNA组和LY294002组相比较,LY294002+PIK3CA-siRNA组细胞增殖均受到显著抑制(F=28.5~104.6,P均<0.05)。而NC组和Blank组相比较、PIK3CA-siRNA组和LY294002组比较,差异均无显著性(P均>0.05)。见图5。
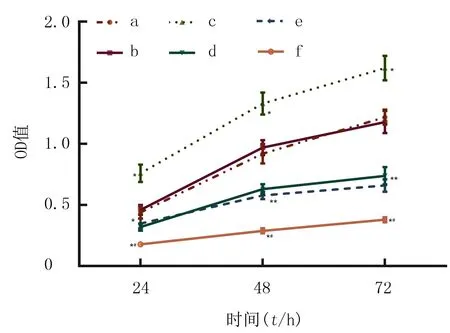
表示与NC组和Blank组相比,*P<0.05;与PIK3CA-siRNA组和LY294002组相比,#P<0.05。
2.6 沉默PIK3CA对宫颈癌细胞凋亡的影响
流式细胞学检测结果显示,与NC组和Blank组比较,HA-PIK3CA组细胞凋亡率明显下降(F=45.1,P<0.05),PIK3CA-siRNA组、LY294002组和LY294002+PIK3CA-siRNA组凋亡率均明显上升(F=213.9,P<0.05)。与PIK3CA-siRNA组和LY294002组细胞相比,LY294002+PIK3CA-siRNA组的上升趋势更明显(F=54.9,P<0.05)。NC组和Blank组、PIK3CA-siRNA组和LY294002组的细胞凋亡率比较,差异均无统计学意义(P>均0.05)。见图6。

与NC组和Blank组相比,*P<0.05;与PIK3CA-siRNA组和LY294002组相比,#P<0.05。
图6 转染后各组宫颈癌细胞株细胞凋亡能力变化
3 讨 论
宫颈癌发病率位居妇科肿瘤首位,其转移成为影响病人预后的重要因素[12]。宫颈癌来源于上皮组织,EMT在其转移过程中扮演重要角色[13]。多数上皮性肿瘤周围细胞多呈间质细胞表型[14],表现出较强的增殖、侵袭能力[15],可侵袭肿瘤组织周围正常组织,刺激肿瘤远处转移,导致病人病情恶化、预后不良[16-17]。抑制肿瘤EMT对于改善病人治疗效果和提升预后尤为重要[18]。近期研究显示,靶向PI3K/AKT信号转导途径的分子拮抗剂可结合顺铂联合化疗改善PIK3CA突变的宫颈癌的治疗效果[19],为基于该病精准药物的新型治疗策略提供重要参考和启示。PI3K是重要的胞内激酶[20],Akt又称蛋白激酶B,是PI3K的下游关键因子[21],二者构成的信号通路在肿瘤细胞生长、侵袭、凋亡等过程中作用显著。既往研究结果表明,PI3K/AKT信号通路在肿瘤细胞中被激活,可通过多重机制参与肿瘤发生发展[22-23]。作为PI3K催化亚基的编码基因,PIK3CA基因已被证实是上消化道癌、胶质细胞瘤、卵巢癌、乳癌等多种肿瘤的癌基因[24-27]。同时,PIK3CA基因在宫颈癌中的表达日益备受关注[28]。目前已有报道PI3K/AKT信号通路可诱导多类上皮细胞恶性肿瘤发生EMT,如胃癌、肺癌、宫颈癌等,而阻断该通路可抑制上述现象[29]。然而,目前有关PIK3CA基因介导PI3K/AKT信号通路对宫颈癌EMT影响的研究较少。
本实验基于前期研究结果和基因沉默技术,选取与宫颈癌相关PIK3CA基因,假设沉默该基因可抑制PI3K/AKT信号通路激活,进而抑制EMT,从而抑制宫颈癌进展。本研究首先通过组织检测显示,与癌旁组织相比,癌组织中PIK3CA表达显著升高,且PIK3CA蛋白表达与宫颈癌病人TNM分期、淋巴结转移和组织学分级均有关,提示PIK3CA阳性表达与宫颈癌发生发展相关。同时,宫颈癌细胞检测结果亦表明PIK3CA高表达,证实宫颈癌中PIK3CA发挥癌基因作用,其高表达可诱导宫颈癌发生。本研究推测PIK3CA基因沉默和PI3K/AKT信号通路拮抗剂可逆转这一不良结局,而细胞实验结果则进一步验证了这一假设。
本文细胞实验结果表明,沉默PIK3CA表达、PI3K/AKT信号通路拮抗剂LY294002以及二者联合处理可抑制PIK3CA、PI3K和AKT表达;且与沉默PIK3CA基因表达或者通路拮抗剂结果相比,二者联合处理各指标变化趋势更为显著;而上调PIK3CA表达可逆转上述指标表达趋势。提示可通过特异性siRNA干扰序列处理,实现对宫颈癌生长转移的抑制,且其作用机制可能与抑制PI3K/AKT信号通路激活相关。为进一步证实PIK3CA基因沉默对宫颈癌细胞生物学特性的影响,本文观察了不同处理后宫颈癌细胞EMT、细胞增殖和细胞凋亡的变化。研究结果显示,沉默PIK3CA表达、PI3K/AKT信号通路拮抗剂LY294002以及二者联合处理可下调N-cadherin和Vimentin表达,上调E-cadherin表达,降低细胞增殖活性,增加细胞凋亡;而且二者联合处理的趋势更为显著;而上调PIK3CA表达后各指标变化趋势逆转。提示在mRNA和蛋白水平上,沉默PIK3CA基因表达能够抑制宫颈癌细胞EMT,抑制宫颈癌细胞增殖,并促进细胞凋亡。上述结果最终佐证,PIK3CA基因沉默对宫颈癌细胞上述生物学特性的作用可能与抑制PI3K/AKT信号通路的激活相关。我们推测PIK3CA基因沉默后,抑制PI3K/AKT信号通路激活,通过上调E-cadherin表达,抑制肿瘤细胞产生金属蛋白酶,抑制蛋白降解,从而阻止肿瘤细胞穿透基质、基底膜[30];通过下调N-cadherin和Vimentin表达,从而抑制细胞分化[31];进而逆转肿瘤细胞生物学行为的转变,最终抑制肿瘤生长。本研究与秦海霞等[32]报道PIK3CA抑制宫颈癌细胞增殖及迁移的机制,可能与miRNA-375靶向调控其表达有关类似,提示PIK3CA在宫颈癌发病中的作用。
总之,本研究显示沉默PIK3CA基因表达可能通过抑制PI3K/AKT信号通路的激活,抑制宫颈癌EMT和细胞增殖,并促进细胞凋亡。本研究从分子生物学角度为寻求改良宫颈癌病人预后和治疗新思路提供了新的实验证据。然而,本研究有关沉默PIK3CA基因表达抑制PI3K/AKT信号通路的分子机制探究仅在细胞实验中证实,有待未来动物实验的验证并可建立与当前研究热点microRNA的联系,以期为宫颈癌分子靶向治疗提供潜在参考。
