河南和广西地区紫云英匍柄霉叶斑病的病原菌鉴定
2021-10-12钱宁吴雨红冯彩莲张国珍卢训莉赵文生
钱宁 吴雨红 冯彩莲 张国珍 卢训莉 赵文生


摘要 2019年-2020年,在我国河南省信阳市和广西壮族自治区南宁市种植紫云英的田间发现一种紫云英叶斑病。通过常规组织分离法分离得到7株真菌(菌株号为XZYB1~XZYB6、GX1),经单孢纯化、形态学观察和多基因系统发育学分析(ITS-GAPDH-CAL),结果显示7株真菌均为黄芪匍柄霉Stemphylium astragali。依据柯赫氏法则,选取菌株XZYB1和XZYB4无伤接种紫云英离体叶片,选取菌株GX1活体接种紫云英叶片进行致病性测定。接种5 d后离体叶片和活体植株叶片均发病,发病症状与田间症状一致,且再分离得到的菌株与接种菌株相同。据此,确定黄芪匍柄霉为该叶斑病的病原菌,并将病害定名为紫云英匍柄霉叶斑病。这是该病害在河南和广西发生的首次报道。本研究也为匍柄霉叶斑病的诊断与后续的防治策略提供了科学依据和理论指导。
关键词 形态学; 系统发育学; 致病性测定; 黄芪匍柄霉; 紫云英
中图分类号: S 435. 5
文献标识码: A
DOI: 10.16688/j.zwbh.
2021048
Identification of the pathogen caused a leaf spot disease in Astragalus sinicus in Henan province and Guangxi Zhuang autonomous region
QIAN Ning, WU Yuhong, FENG Cailian, ZHANG Guozhen, LU Xunli, ZHAO Wensheng*
(Key Laboratory of Pest Monitoring and Green Management, Ministry of Agriculture and Rural Affairs; College of
Plant Protection, China Agricultural University, Beijing 100193, China)
Abstract
A leaf spot disease was found in the milk vetch fields of Henan province and Guangxi Zhuang autonomous region (GZAR) in 2019-2020. Seven strains (XZYB1-XZYB6 and GX1) were isolated using the conventional tissue isolation method. After single spore purification, morphological observation and multi-gene phylogenetic analysis (ITS-GAPDH-CAL), these strains were all identified as Stemphylium astragali. According to Kochs postulate, strain XZYB1 and XZYB4 were selected for noninvasive inoculation to milk vetch leaves and strain GX1 for noninvasive inoculation to milk vetch living plants for pathogenicity test. Disease can be developed in both the detached leaves and the in vivo leaves, and the symptoms on the inoculated leaves were consistent with those in the field. The re-isolated strains were still identified as S.astragali. Therefore S.astragali was determined as the pathogen of the milk vetch leaf spot disease, which was called as milk vetch Stemphylium leaf spot. This is the first report of the disease in Henan province and GZAR, which also provides a scientific basis and theoretical guidance for the diagnosis of Stemphylium leaf spot of other crops and follow-up control strategies of the leaf spot disease.
Key words
morphological; phylogenetic tree; pathogenicity test; Stemphylium astragali; Astragalus sinicus
紫云英Astragalus sinicus L.又名紅花草,是豆科黄芪属二年生草本植物。它常作为重要的蜜源植物和绿肥作物而被广泛栽培。作为绿肥作物,紫云英常与稻田轮作,在水稻种植前将上一季的紫云英翻压入土以提高土壤肥力,并且它还能改善土壤理化性质,最终提高作物产量[1]。在中国,一千多年前吴陆玑的《毛诗草木鸟兽虫》中就记载了紫云英已经被人们使用[2];明清时代,长江流域的紫云英已经种植广泛;民国时期,我国南部地区、中原地区均有紫云英种植,分布十余省[3]。
紫云英主要在中日韩等亚洲国家种植较为普遍,因此,目前关于紫云英的真菌病害记录也多集中于这些地区,记录较多的为白粉病和菌核病。中国和日本均有黄芪白粉菌Erysiphe astragali侵染引起的紫云英白粉病的记录[4-6]。中国、日本和韩国均有豌豆白粉菌E.pisi侵染引起的紫云英白粉病的记录[4,7-8]。据戴芳澜《中国真菌总汇》记载,蓼白粉菌Erysiphe polygoni也可以侵染紫云英叶片引起紫云英白粉病,而核盘菌Sclerotinia sclerotiorum和杯状核盘菌S.ciborioides可侵染紫云英引起菌核病[5]。日本报道了由三叶草核盘菌S.trifoliorum侵染引起的紫云英菌核病[9]。据《中国真菌志》第26卷记载,灰葡萄孢Botrytis cinerea可以侵染紫云英引起灰霉病[10]。此外,据美国农业部农业研究局数据中心记录显示,早在1952年日本就报道了由苜蓿霜霉Peronospora aestivalis侵染引起的紫云英霜霉病;在1955年日本报道了由黄芪枝孢Cladosporium astragali侵染引起的紫云英叶枯病。据《中国真菌志》第14卷记载,变黑枝孢菌C.nigrellum可以侵染紫云英叶片引起叶斑病[11]。在我国大陆和台湾地区有记载黄芪尾孢菌Cercospora astragali可以侵染引起紫云英褐斑病[5,12]。中国和日本曾报道了Neoovularia nomuriana 可以侵染紫云英叶片引起紫云英白斑病[13-15]。日本、韩国及我国浙江省曾有记录黄芪匍柄霉Stemphylium astragali可以侵染紫云英叶片引起紫云英叶斑病[16-18],但缺乏详细的病害症状、病原菌形态及分子生物学证据。
为加速现代农业发展,我国正大力恢复和发展绿肥生产,紫云英的种植面积和产量也在逐步增大,因此控制紫云英病害的发生和危害极为重要。本研究在紫云英的主产区河南和广西进行田间调查时,发现了一种紫云英叶斑病。为明确其病原菌种类,我们进行了病原菌的分离、鉴定及致病性测定。
1 材料与方法
1.1 田间症状的观察与样品的采集
2019年4月上旬和2020年3月中旬分别在河南省信阳市和广西壮族自治区南宁市紫云英种植田发现一种症状相似的紫云英叶斑病。对其发病症状、发病部位进行拍照记录,并采集病样带回实验室。
1.2 病原菌的分离、纯化及保存
采用常规组织分离法对病样进行病原菌的分离,待菌株產孢后,挑取单孢纯化。纯化得到的菌株分别用斜面(PDA)法和滤纸片法各保存一份,斜面于4℃冰箱保存,带菌滤纸片放入灭菌的羊皮纸袋中,置于超净工作台吹干后-20℃冰箱保存。
1.3 形态学鉴定
将菌株在PDA平板上活化5 d后,用灭菌的打孔器在菌落边缘打取菌饼(d=5 mm)备用。
菌落形态特征观察:将菌饼接种于PCA平板(d=60 mm)中央,置于25℃恒温温箱持续光照培养,观察生长状况并测量菌落直径计算生长速率。
产孢表型观察:参考《中国真菌志》第30卷[19]的方法诱导产孢,7~10 d后,取载玻片置显微镜下观察,并拍照记录分生孢子在分生孢子梗上的着生情况(产孢表型)和产孢梗(细胞)延伸的方式。
马铃薯葡萄糖琼脂(PDA)培养基配方:马铃薯200 g、葡萄糖20 g、琼脂 20 g、蒸馏水1 000 mL;马铃薯胡萝卜琼脂(PCA)培养基配方:马铃薯200 g、胡萝卜200 g、琼脂 20 g、蒸馏水1 000 mL。
1.4 分子生物学鉴定
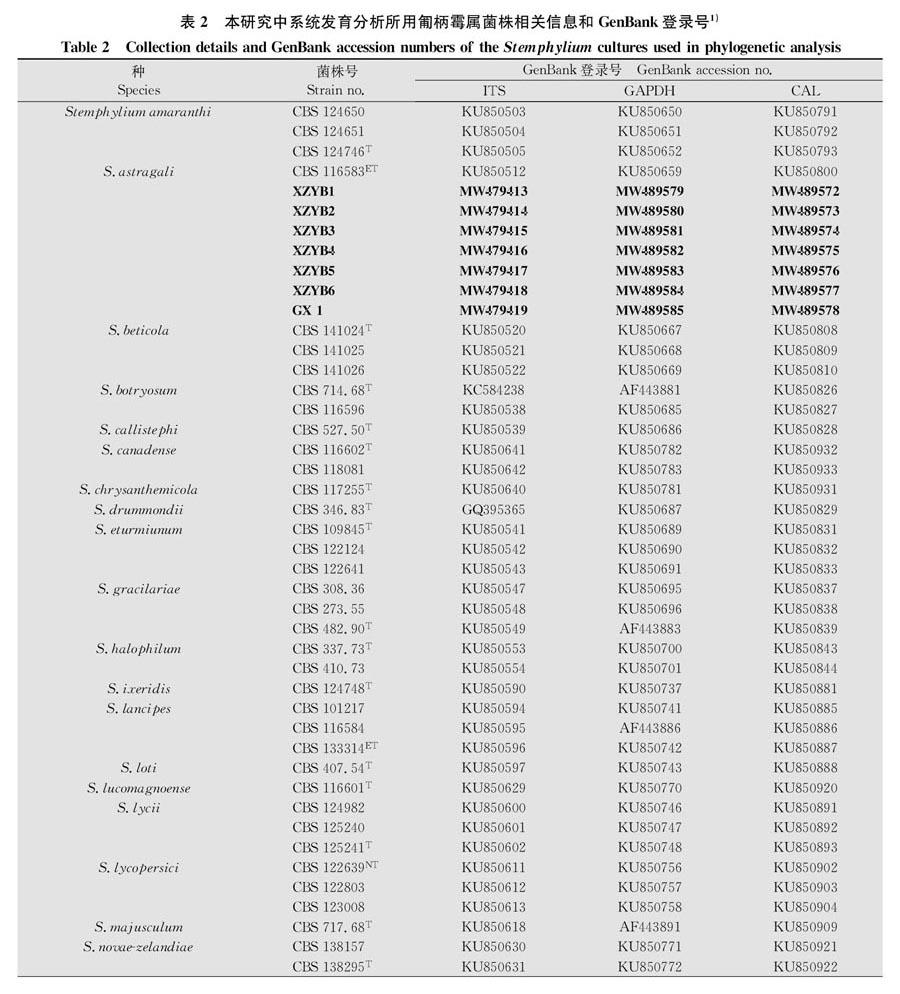
将菌株在PDA平板上培养5 d后,收集菌丝,使用QS法[20]快速提取DNA。用引物(表1)分别扩增ITS、GAPDH和CAL基因。扩增体系(50 μL): 2×PCR-MIX溶液(聚合美生产,速率为1 kb/10~15 s)25 μL,无菌去离子水20 μL,上下游引物(10 μmol/L)各2 μL,模板DNA 1 μL。将PCR扩增产物送至铂尚生物公司测序,测序结果使用Chromas软件进行检查校对,最终将所得的所有序列上传NCBI序列数据库获得登录号(表2)。依据Woudenberg 等[21]的报道下载相关参考序列,参考序列登录号及相关菌株信息见表2。使用MAFFT v.7.221、Bioedit和ALTER(http:∥www.sing-group.org/ALTER/)分别进行序列比对、修剪拼接和格式转换,使用Cipres网页上(https:∥www.phylo.org/)的XSEDE工具进行ML法(最大似然法)的系统发育学分析;使用PAUP软件(4.0b10版本)进行MP法(最大简约法)的系统发育学分析。选择Alternaria alternata作为系统发育树的外群。
1.5 致病性测定
依据柯赫氏法则,选取紫云英健康植株,分别采用离体叶片接种法和活体植株接种法进行致病性测定。将保藏的分离物移到PDA平板上置于培养箱内培养5 d,用灭菌的打孔器在菌落的边缘打取多个菌饼(d=5 mm)备用。温室内种植紫云英,离体接种选取健康的带叶茎段,并使用棉签蘸取75%乙醇对叶片进行表面消毒处理。采用无伤接种法,将菌饼接于叶片上,重复3次,以无菌PDA块作对照,接种后用湿棉花包裹茎段,放在铺有湿润滤纸的保鲜盒中保湿,在培养箱中25℃恒温避光培养,定期观察并记录叶片发病情况。活体接种选取健康的紫云英植株,用棉签蘸取75%乙醇对紫云英活体植株叶片进行表面消毒处理。采用无伤接种法,每株紫云英随机接15个菌饼,重复3次,以无菌PDA块作对照,将接种的盆栽紫云英放在大的塑料收纳箱中,用加湿器加湿,塑料收纳箱用保鲜膜密封后放在恒温温室(25±1℃)培养,定期观察并记录植株发病情况。
2 结果与分析
2.1 紫云英叶斑病田间症状
在河南信阳市紫云英田间和广西南宁市田间所发现的叶斑病,病斑淡褐色至褐色,形状不规则,边缘带有黄色晕圈,有的具轮纹,湿度高时病斑中央产生灰褐色霉层。单个小叶片上可出现多个病斑,发病后期多个病斑可连成片,造成整个叶片干枯死亡(图1)。该病害在紫云英生长中后期普遍发生,田间植株发病率高达60%~100%。
2.2 形态学观察
从河南省紫云英叶斑病病样上共分离得到6株菌,编号为XZYB1~XZYB6;从广西壮族自治区紫云英叶斑病病样上分离得到1株菌,编号为GX1。纯化时发现这7株菌形态学特征基本一致。代表性菌株XZYB4在PCA平板上(25℃下全光照)菌落初期为白色,随着生长,菌落正面逐渐变为灰白色,菌落背面逐渐变为灰黑色,培养5 d后菌落直径可达50 mm。
分生孢子梗直立,单生,不分支,淡褐色,分为短梗和长梗两种。短梗无隔,长度(6.2~)6.3~12.1(~14.9)μm;长梗2~5个横隔,长度(21.2~)26.8~41.3(~44.1)μm,分生孢子梗宽度(4.4~)4.9~6.7(~7.3)μm。分生孢子梗末端形成膨大且颜色加深的产孢细胞,分生孢子着生于产孢细胞上,褐色,卵形或椭圆形,表面具疣状突起,具横隔、纵隔或斜纵隔(横隔1~4个,纵隔或斜纵隔1~5个),分隔处明显缢缩,大小为(10.5~)14.4~23.4(~29.5)μm ×(9.3~)11.9~17.4(~18.5)μm,随着孢子成熟颜色加深(图2)。
2.3 系统发育学分析
首先将所获得的ITS序列在NCBI网站进行BLAST比对分析,初步确定它们为匍柄霉属Stemphylium真菌。进一步,联合ITS-GAPDH-CAL三个基因片段(其中ITS:1-540;GAPDH:545-1 113;CAL:1 118-1 832,不同基因片段之间插入了4个N)使用最大似然法和最大简约法构建系统发育树进行系统发育学分析,MP、ML两种建树方法获得相似的拓扑结构,ML的拓扑结构表示的系统学关系见图3,结果显示菌株XZYB1~XZYB6、GX1与黄芪匍柄霉S.astragali的衍生注释模式菌株(CBS 116383)聚在一个进化支,其自举值均为100,此外这8个菌株的DNA碱基序列完全相同或几乎完全相同。
2.4 致病性测定
菌株XZYB1和XZYB4离体叶片接种60 h后可见菌饼萌发的菌丝侵染叶片。取下菌饼,继续观察发病情况,在接种5 d后接种点出现褐色病斑,病斑周围失绿呈现黄色晕圈,该症状与田间症状相似,而空白对照组叶片不发病。从发病叶片病健交界处再分离得到的菌株与接种菌株相同。
菌株GX1活体植株接种5 d后,植株均出现发病症状,15个接种点的发病数分别为12、8个和12个。发病叶片出现褐色不规则病斑,有的呈轮纹状,病斑边缘失绿为黄色晕圈。从发病叶片病健交界处再分离得到的菌株与接种菌株相同。
3 结论与讨论
对我们分离获得的菌株进行形态学鉴定和分子生物学鉴定(ITS、GAPDH和CAL多基因系统发育树分析),确定XZYB1~XZYB6、GX1等7株菌为黄芪匍柄霉S.astragali。依据柯赫氏法则,将田间病样上分离得到的菌株进行回接做致病性测定,获得与寄主在自然状态下非常相似的发病症状,同时将接种发病部位进行再分离,得到和最初分离菌株一样的菌株,验证了黄芪匍柄霉就是该紫云英叶斑病的致病菌。为与其他叶斑类病害相区别,将该菌引起的病害命名为紫云英匍柄霉叶斑病。
黄芪匍柄霉最早由日本科学家Yoshii于1929年从日本的紫云英上分离得到,最初命名为Thyrospora astragali,在1956年,确定该种衍生注释模式菌株为CBS 116583。1960年由日本科学家Yamamoto对其重新进行分类并正式归为匍柄霉属,更名为Stemphyliun astragali[17,21,25]。1991年,《浙江植物病虫志:病害篇(第一集)》中首次记录了我国浙江省发现由黄芪匍柄霉侵染引起的紫云英叶斑病[16],但仅有对其病原菌形态学的文字描述,无形态附图和分子证据。2001年出版的《Korean species of Alternaria and Stemphylium》和2004年出版的《List of plant diseases in Korea》中记录,在韩国,黄芪匍柄霉可以侵染紫云英叶片引起叶斑病[8,18]。从该病原菌被首次鉴定至2019年,已报道的寄主均为紫云英。 Vaghefi等2020年首次报道在澳大利亞黄芪匍柄霉可以侵染小扁豆Lens culinaris叶片引起叶斑病[26]。至此,黄芪匍柄霉引起病害的寄主仅有紫云英和小扁豆,均属豆科绿肥作物,分布于中国、日本、澳大利亚和韩国。
本研究首次在我国河南省和广西壮族自治区发现由黄芪匍柄霉引起的紫云英叶斑病,并基于多基因系统发育学分析和形态学鉴定相结合的方法对病原菌进行了鉴定。紫云英匍柄霉叶斑病在中日韩三国均有报道,尤其是国内近几年恢复了绿肥生产,多个省已经大面积种植紫云英,该病害很可能在今后流行至河南、广西、浙江以外的其他省份,这将对我国绿肥产业发展产生不利影响。此外,黄芪匍柄霉在澳大利亚已经有对小扁豆的侵染致病记录,因此该病原菌对我国小扁豆的生产也具有潜在威胁,进一步研究紫云英叶斑病的发病规律、防治策略等十分重要。
参考文献
[1] 曹卫东, 包兴国, 徐昌旭, 等. 中国绿肥科研60年回顾与未来展望[J]. 植物营养与肥料学报, 2017, 23(6): 1450-1461.
[2] 李忠义, 唐红琴, 何铁光, 等. 绿肥作物紫云英研究进展[J]. 热带农业科学, 2016, 36(11): 27-32.
[3] 周健, 袁国保, 耿月明, 等. 对我国紫云英发展的思考[J]. 中国种业, 2012(12): 19-22.
[4] HANLIN R T, AMANO K. Host range and geographical distribution of the powdery mildew fungi [J]. Mycologia, 1986, 82(4): 533.
[5] 戴芳澜. 中国真菌总汇[M]. 北京: 科学出版社, 1979.
[6] PEREGRINE W T H, SIDDIQI M A. A revised and annotated list of plant diseases in Malawi [J]. Phytopathological Papers, 1972, 16:1-51.
[7] SHIN H D. Erysiphaceae of Korea [M]. Suwon, Korea: National Institute of Agricultural Science and Technology, 2000.
[8] CHO W D, SHIN H D. List of plant diseases in Korea [M]. Fourth edition. Korean Society of Plant Pathology, 2004.
[9] RICHARDSON M J. An annotated list of seed-borne diseases [M]. Fourth Edition. Zurich: International Seed Testing Association, 1990.
[10]张中义. 中国真菌志. 第二十六卷, 葡萄孢属 柱隔孢属[M]. 北京:科学出版社, 2006.
[11]张中义. 中国真菌志. 第十四卷, 枝孢属 黑星孢属 梨孢属[M]. 北京:科学出版社, 2003.
[12]HSIEH W H, GOH T K. Cercospora and similar fungi from Taiwan [M]. Taiwan: Maw Chang Book Company, 1990.
[13]BRAUN U. A monograph of Cercosporella, Ramularia and allied genera (phytopathogenic hyphomycetes). Additions to host range and distribution [M]. München: IHW-Verlag: 1995.
[14]VIDEIRA S I R, GROENEWALD J Z, BRAUN U, et al. All that glitters is not Ramularia [J]. Studies in Mycology, 2016, 83: 49-163.
[15]VIDEIRA S I R, GROENEWALD J Z, NAKASHIMA C, et al. Mycosphaerellaceae-Chaos or clarity?[J]. Studies in Mycology, 2017, 87: 257-421.
[16]葛起新. 浙江植物病虫志 病害篇 (第一集)[M]. 上海:上海科学技术出版社, 1991.
[17]YOSHII H. Studies on leaf spot disease of milk vetch [J]. Journal of Plant Protection, 1929, 16: 533-537.
[18]YU S H. Korean species of Alternaria and Stemphylium [M]. Suwon, Republic of Korea,
National Institute of Agricultural Science and Technology: 2001.
[19]张天宇. 中国真菌志. 第三十卷, 蠕形分生孢子真菌[M]. 北京:科学出版社, 2010.
[20]CHI M H, PARK S Y, LEE Y H. A quick and safe method for fungal DNA extraction [J]. The Plant Pathology Journal, 2009, 25(1): 108-111.
[21]WOUDENBERG J H C, HANSE B, VAN LEEUWEN G C M, et al. Stemphylium revisited [J]. Studies in Mycology, 2017, 87: 77-103.
[22]WHITE T J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics [M]. San Diego: CA Academic Press, 1990.
[23]BERBEE M L, PIRSEYEDI M, HUBBARD S. Cochliobolus phylogenetics and the origin of known, highly virulent pathogens, inferred from ITS and glyceraldehyde-3-phosphate dehydrogenase gene sequences [J]. Mycologia, 1999, 91(6): 964-977.
[24]CARBONE I, KOHN L M. A method for designing primer sets for speciation studies in filamentous ascomycetes [J]. Mycologia, 1999, 91(3): 553-556.
[25]YAMAMOTO W. Synonymous species of Alternaria and Stemphylium in Japan [J]. Transactions of the Mycological Society of Japan, 1960, 2: 88-93.
[26]VAGHEFI N, THOMPSON S M, KIMBER R B E, et al. Multi-locus phylogeny and pathogenicity of Stemphylium species associated with legumes in Australia [J]. Mycological Progress, 2020, 19(4): 381-396.
(責任编辑:田 喆)
