萎缩芽胞杆菌MQ19ST15鉴定及对甘蓝枯萎病的盆栽防效
2021-10-12陈云云李惠霞张海英徐生军刘永刚
陈云云 李惠霞 张海英 徐生军 刘永刚
摘要 为筛选用于甘蓝枯萎病的生防菌并明确其对病原菌的抑菌活性和盆栽防治效果,对从荒漠沙土中分离、筛选的细菌菌株MQ19ST15进行了对峙培养、抑菌活性物质测定、盆栽防效测定和种类鉴定。结果表明,菌株MQ19ST15能够显著抑制病原菌的菌丝生长,使菌丝出现膨大、变形扭曲及分支增多等畸变,抑菌率达54.95%。抑菌活性物质检测显示,该菌株能产生淀粉酶、蛋白酶、果胶酶及β-1,3-葡聚糖酶;抗菌脂肽物质合成相关基因扩增显示其基因组DNA中具有surfactin、iturin、fengycin和bacillomycin 4种抗菌脂肽物质的合成调控基因。盆栽试验结果显示,该菌株对甘蓝枯萎病的防控效果为53.03%。通过菌落形态、16S rRNA基因和gyrB基因序列分析将其鉴定为萎缩芽胞杆菌Bacillus atrophaeus。
关键词 甘蓝枯萎病; 萎缩芽胞杆菌; 抑菌活性; 盆栽防效
中图分类号: S 476
文献标识码: A
DOI: 10.16688/j.zwbh.2020565
Identification of Bacillus atrophaeus MQ19ST15 and its control efficacy against Fusarium wilt on potted cabbage plants
CHEN Yunyun1,2, LI Huixia1, ZHANG Haiying2,3, XU Shengjun2,3*, LIU Yonggang1,2*
(1. College of Plant Protection, Gansu Agricultural University, Biocontrol Engineering Laboratory of Crop Diseases
and Pests of Gansu Province, Lanzhou 730070, China; 2. Institute of Plant Protection, Gansu Academy of
Agricultural Sciences, Lanzhou 730070, China; 3. Scientific Observation and Experimental Station of Crop
Pests in Tianshui, Ministry of Agriculture and Rural Affairs, Tianshui 741200, China)
Abstract
In order to discover biocontrol bacteria against the cabbage Fusarium wilt and clarify their inhibitory activity against plant pathogens and control effect on potted plants, the bacterial strain MQ19ST15, isolated and screened from sandy soil, was subjected to dual culture, determination of antibacterial active substances, determination of their control effects on potted plants and species identification. The results showed that strain MQ19ST15 could significantly inhibit the mycelial growth of plant pathogens and caused the mycelium to expand, distort and branch, with an inhibition rate of 54.95%. The detection results of inhibitory substances showed that the strain could produce amylase, protease, pectinase and β-1,3-glucanase. The amplification results of the genes related to the synthesis of antimicrobial lipopeptides showed that there were synthetic genes of four antimicrobial lipopeptides (surfactin, iturin, fengycin and bacillomycin) in its genome. The pot experiment results showed that the control efficacy of this strain against cabbage Fusarium wilt was 53.03%. It was identified as Bacillus atrophaeus by colony morphology, 16S rRNA gene and gyrB gene sequence analysis.
Key words
cabbage Fusarium wilt; Bacillus atrophaeus; inhibitory activity; control effect on potted plants
甘藍枯萎病是由尖孢镰刀菌十字花科专化型Fusarium oxysporum f.sp.conglutinans侵染引起的土传真菌病害[1],在全世界多数甘蓝栽培地区都有发生。2003年李明远等[2]在国内首次报道了该病,随后此病陆续在我国北京[3]、山西[4]、甘肃[5]等甘蓝主产区发生。甘蓝是甘肃省高原夏菜的主打产品,在兰州、定西等地有悠久的种植历史,2009年甘肃省定西市安定区[5]发现此病,平均发病率达20%以上,最高达到45.68%[6]。甘蓝枯萎病在甘蓝生长期均可发生,主要症状表现为叶片变黄、萎蔫、掉叶,植株维管束组织变褐、阻塞,并最终导致整株死亡,严重影响甘蓝的质量和产量。选用抗病品种是甘蓝枯萎病的主要防治措施,但是抗病性极易丧失,生产中缺乏真正有效的抗病品种,因此化学防治依然是防治此病害的重要手段,如使用嘧菌酯悬浮剂和甲霜·噁霉灵水剂组合灌根[7]和采用棉隆微粒剂和氰胺化钙土壤净化剂处理土壤[8]等方法具有一定的防治效果。但是,化学农药的使用易带来诸如病原菌产生抗药性、农药残留超标、作物品质下降、土壤盐渍化及地下水污染等一系列食品安全和生态环境问题。因此,亟待开发新型、高效、环境友好的生物防治技术产品。
生防菌防控农作物病害是一种绿色、安全、对环境友好的方法,是当前植物病害绿色防控的研究热点,其有益作用已经在多种重要的农作物病害防治试验中得到证实。生防菌的抑菌活性主要通过菌株产生的一些具抑菌作用的次级代谢产物体现,如分泌水解酶和抗菌脂肽物质。已有研究表明细菌产生的蛋白酶[9]、纤维素酶、葡聚糖酶、几丁质酶[10-11]等水解酶可破坏真菌细胞壁致使菌丝畸变[12]。抗菌脂肽物质种类较多,常见的有surfactin、fengycin、iturin、 bacillomycin等,其具有抗菌、消炎、抗病毒等多种作用,且抗菌谱广、作用迅速强大、不易产生耐药性,具有广阔的应用前景[13-14]。当前已有多种生防菌制剂被成功开发使用,然而,生防菌与土壤生态环境中的微生物群落之间经常存在相互作用,外源生防菌的引入可以引起农作物根际土壤微生物群落组成发生变化,因此生防菌的使用有很大的地域适应性。由于上述原因
目前国内外的一些商品化生防菌制剂在防治甘蓝枯萎病时效果并不理想,这就迫切需要挖掘本地特有的微生物资源,研究适合甘肃生态环境的生防菌用于甘蓝枯萎病的防控。
本研究从采自甘肃省武威市民勤县的荒漠沙土中分离、筛选和鉴定出针对甘蓝枯萎病的生防细菌,并评价其对甘蓝枯萎病的防治效果,以期为开发稳定有效的甘蓝枯萎病生防菌剂提供潜在的菌株。
1 材料与方法
1.1 供试材料
荒漠土壤:采自甘肃省武威市民勤县黄坝湾(103°8′46″E,38°32′52″N),共500 g。
甘蓝枯萎病菌:尖孢镰刀菌十字花科专化型Fusarium oxysporum f.sp. conglutinans,代号FOSY-2-1,由中国农业科学院蔬菜花卉研究所提供。
甘蓝:‘中甘21,北京中蔬园艺良种研究开发中心。
药剂:70%代森锰锌可湿性粉剂(WP),南通宝叶化工有限公司;10亿芽胞/g枯草芽胞杆菌可湿性粉剂(WP),台湾百泰生物科技股份有限公司。
1.2 试验方法
1.2.1 土壤细菌的分离、纯化与保存
采用梯度稀释法、平板涂布法和平板划线法分离纯化土壤中细菌。将土样混合均匀后,称取1.0 g土样置于装有9 mL无菌水的试管中,梯度稀释到10-5,从最后3个浓度的试管中分别取100 μL涂布于LB固体培养基上,培养72 h后挑取不同形态菌落划线于LB固体培养基上,对菌落进行纯化。将分离纯化后的细菌转移至LB液体培养基,在恒温振荡器(28℃、150 r/min)中培养72 h后,装入终浓度20%甘油中保存于-80℃冰箱中以备进一步筛选。
1.2.2 拮抗细菌的筛选
采用平板对峙培养法[15]。将甘蓝枯萎病菌在PDA平板上培养5 d,从菌落边缘用无菌打孔器打取长势一致且直径相同的菌饼,在直径90 mm的PDA平板距边缘2 cm的相对位置处,分别接种甘蓝枯萎病菌和10 μL保存于-80℃冰箱的候选细菌菌液,以病原菌单独培养作为对照,培养7 d。挑选具有抑菌效果的细菌进行复筛,将初筛得到的菌株菌液在LB平板上划线培养48 h,然后在直径90 mm的PDA平板距边缘约2 cm的相对位置处,分别接种甘蓝枯萎病菌和细菌单菌落,每组设3个重复,倒置于25℃恒温培养箱中培养,以病原菌单独培养作为对照,连续观察菌落生长情况,培养至对照处理中病原菌菌落直径≥4.5 cm,记录各处理病原菌半径及抑菌带宽度,计算抑菌率。同时,从对峙培养的平板中抑菌带边缘和对照菌落边缘挑取菌丝于光学显微镜下观察形态,对比并拍照记录。
抑菌率=(对照病原菌菌落半径-生防菌对峙的病原菌菌落半径)/对照病原菌菌落半径×100%。
1.2.3 抑菌活性物质检测
将拮抗细菌分别接至淀粉酶检测培养基[16]、蛋白酶检测培养基(LB固体培养基900 mL、7%脱脂牛奶100 mL)、果胶酶检测培养基[17]和β-1,3-葡聚糖酶检测培养基(LB固体培养基、1%羧甲基纤维素钠),28℃培养3~5 d。观察蛋白酶检测培养基中菌落周围是否产生透明圈,若有,则视为具有产生蛋白酶的能力。用革兰氏碘溶液淹没果胶酶检测培养基和淀粉酶检测培养基,如菌落周围可见一个清晰的圈,说明该菌株产生果胶酶和淀粉酶。用0.01%的刚果红溶液对β-1,3-葡聚糖酶检测培养基进行染色,如可见一个清晰的色圈产生,说明该菌株产生β-1,3-葡聚糖酶。
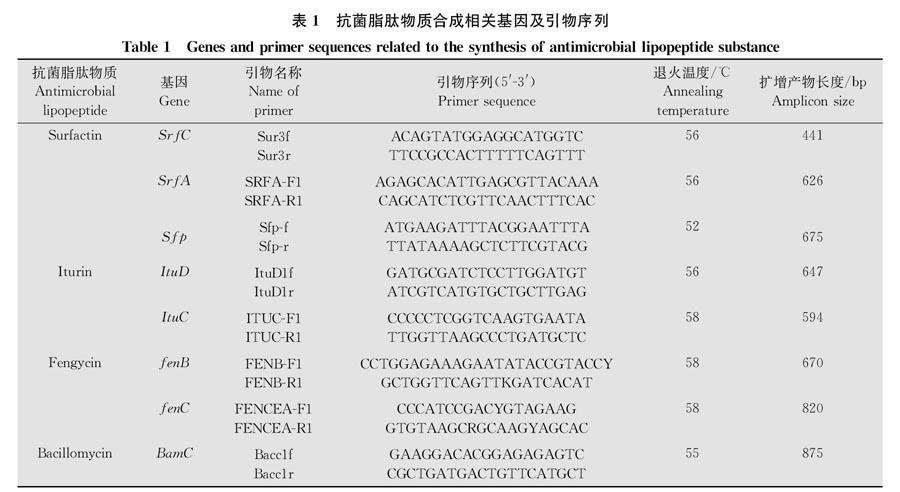
采用细菌基因组提取试剂盒(天根,北京)提取菌株MQ19ST15的基因组DNA,以此为模板,选择8对引物对常见4种抗菌脂肽物质surfactin、fengycin、iturin和bacillomycin的合成调控基因进行扩增,相关基因及引物序列见表1,引物合成由生工生物工程(上海)有限公司完成。使用25 μL PCR反应体系:2×EasyTaq PCR SuperMix 12.5 μL,引物(10 μmol/L)各1 μL,DNA模板2 μL,ddH2O 8.5 μL。反應条件: 95℃预变性 5 min; 95℃变性 1 min,退火温度(表1)退火 1 min, 72℃延伸 1 min,35个循环;72℃延伸 10 min。扩增产物经1%琼脂糖凝胶电泳检测。
1.2.4 盆栽防效测定
采用灌根法进行盆栽试验。将病原菌接种至PLB液体培养基(马铃薯200 g/L,乳糖20 g/L,蒸馏水1 000 mL),于25℃、150 r/min摇床上培养3 d后收集菌液备用;拮抗细菌接种至50% PDB+50% LB液体培养基中,于28℃、150 r/min摇床上培养24 h后收集菌液(1×108 cfu/mL)备用。将孢子浓度为1×105个/mL的菌液与园艺土壤按质量比1∶10混合均匀得到病土,挑选长势一致的2~3叶期健康甘蓝幼苗用乙醇消毒的刀片进行伤根处理并移栽至装有病土的盆中(直径10 cm),每盆1株,设4个处理:1)甘蓝幼苗移栽后用50 mL清水灌根;2)移栽后用50 mL拮抗菌液灌根;3)移栽后用50 mL 10亿芽胞/g枯草芽胞杆菌WP 400倍药液灌根;4)移栽后用50 mL 70%代森锰锌WP 1 000倍药液灌根。每处理10株,试验重复3次,以清水灌根处理为对照。在移栽当天、第7天和第14天分别进行3次灌根。移栽后40 d,根据甘蓝枯萎病病情分级标准[18]记录病情级别。0级,无症状;1级,1片叶叶脉轻微变黄;2级,1~2片叶叶脉轻至中度变黄;3级,除心叶外,其余叶中度变黄或萎蔫;4级,全部叶片重度变黄或萎蔫;5级,叶片完全萎蔫并死亡。计算病情指数和防治效果。
病情指数(DI)=∑各级病株数×相应病级调查总株数×最高病级×100;
防治效果=对照病情指数-处理病情指数对照病情指数×100%。
1.2.5 菌株的分类鉴定
1.2.5.1 形态学特征
将拮抗细菌划线接种于LB固体培养基上,28℃培养48 h,观察菌落颜色、形状、边缘、表面、透明度和菌体的形态特征并进行革兰氏染色。
1.2.5.2 分子生物学鉴定
采用细菌基因组提取试剂盒(天根,北京)提取菌株MQ19ST15的基因组DNA,选取细菌16S rRNA基因的通用引物27F和1492R,使用25 μL体系(同1.2.3)在PCR热循环仪上进行扩增。PCR反应条件: 94℃预变性5 min;94℃变性30 s,55℃退火45 s,72℃延伸1 min,30个循环; 72℃延伸10 min。
利用引物UP1和UP2r扩增gyrB基因,使用25 μL体系(同1.2.3)在PCR热循环仪上进行扩增。PCR反应条件:94℃预变性4 min;94℃变性1 min,60℃退火1 min,72℃延伸2 min,35个循环;72℃延伸10 min。
扩增产物经1%琼脂糖凝胶电泳检测后送至生工生物工程(上海)有限公司测序,测序结果在NCBI数据库中进行BLAST比对。使用MEGA-X软件构建系统发育树,进行系统进化分析。
1.3 数据统计与分析
采用Excel 2010和SPSS 21.0软件对试验处理组间的结果进行统计和单因素方差分析,应用Duncan氏新复极差法检验差异显著性。
2 结果与分析
2.1 拮抗菌的分离和筛选
从沙土中共分离纯化获得45株细菌,经初筛得到6株具有抑菌效果的菌株,对其进行复筛,结果(表2,图1)表明,菌株MQ19ST15的抑菌效果最为稳定和突出,抑菌率为54.95%,抑菌带宽度为5.28 mm,显著大于其他菌株,因此选择菌株MQ19ST15作为目标菌株进行后续试验。病原菌受到拮抗菌MQ19ST15抑制后,菌落边缘明显停止生长,在光学显微镜下观察,发现抑菌带边缘的菌丝出现膨大、变形扭曲及分支增多现象(图2)。
2.2 菌株MQ19ST15抑菌活性物质检测
将菌株MQ19ST15接种在抑菌活性检测培养基上,结果(图3)显示,拮抗菌MQ19ST15具有产淀粉酶、蛋白酶、果胶酶及β-1,3-葡聚糖酶的能力。抑菌脂肽活性物质的8个基因扩增结果表明(图4),除ItuC基因外,其余7个基因片段均可被扩增,说明该菌基因组DNA中具有基因SrfC、SrfA、Sfp、ItuD、fenB、fenC和BamC。
2.3 菌株MQ19ST15对甘蓝枯萎病的防治效果
盆栽试验结果(表3,图5)表明,3种处理对甘蓝枯萎病均有一定的防治效果,其中菌株MQ19ST15菌液(1×108 cfu/mL)的防效为5303%,与70%代森锰锌WP 1 000倍液的防效无显著差异,显著高于10亿芽胞/g枯草芽胞杆菌WP的防效28.76%。
2.4 菌株MQ19ST15的分类鉴定
2.4.1 形态学特征
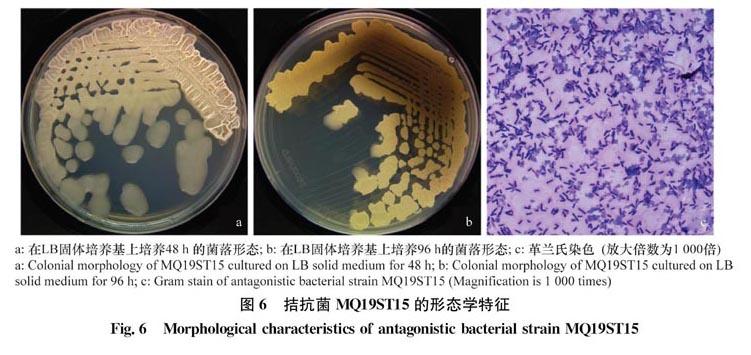
拮抗菌MQ19ST15在LB固体培养基上培养48 h后,菌落呈淡黄色,不透明,边缘不整齐,表面有褶皱(图6a),培养96 h后菌落及培养基逐渐变为深褐色,有色素产生(图6b)。革兰氏染色结果显示为阳性,菌体为杆状(图6c)。
2.4.2 分子生物学鉴定
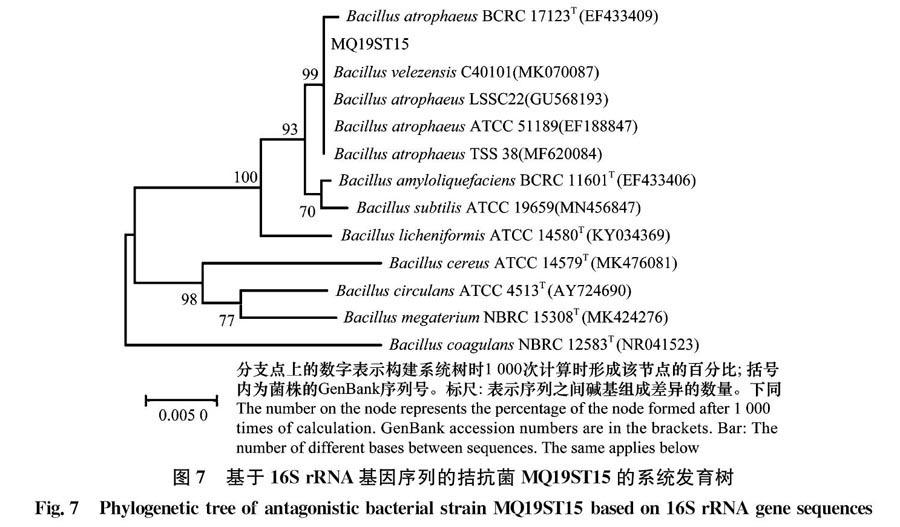
以拮抗菌MQ19ST15基因组DNA为模板,使用16S rRNA基因通用引物27F和1492R进行PCR扩增并测序,得到1 399 bp的序列,将序列提交至GenBank数据库进行BLAST比对,结果显示,该菌为芽胞杆菌属细菌,其与萎缩芽胞杆菌Bacillus atrophaeus 和贝莱斯芽胞杆菌B.velezensis均具有较高的同源性,序列同源性达100%,从构建的系统发育树(图7)中可以看出二者处在同一分支上。利用引物UP1和UP2r扩增gyrB基因,测序得到1 175 bp的序列,与萎缩芽胞杆菌的gyrB基因序列同源性达98%,构建的系统发育树(图8)显示菌株MQ19ST15与萎缩芽胞杆菌属于同一分支。因此,依据16S rRNA基因和gyrB基因序列分析,结合菌株MQ19ST15的形态学特征,将其鉴定为萎缩芽胞杆菌B.atrophaeus。
3 结论与讨论
芽胞桿菌属是目前应用较为广泛的生防细菌,大量研究表明其具有许多优秀的生防特性,在我国已报道的甘蓝枯萎病生防菌研究中也以芽胞杆菌居多。卢彩鸽等[19]从黑龙江漠河地区的永久冻土层中分离得到1株对甘蓝枯萎病菌有较强抑制作用的拮抗细菌,鉴定为解淀粉芽胞杆菌Bacillus amyloliquefaciens。本研究从河西走廊荒漠沙土中筛选出的拮抗细菌MQ19ST15在平板对峙试验中对甘蓝枯萎病菌抑制率达54.95%,能够显著抑制病原菌的菌丝生长,使菌丝出现膨大、变形扭曲及分支增多现象。通过形态学观察,结合16S rRNA基因和gyrB基因序列分析将其鉴定为萎缩芽胞杆菌Bacillus atrophaeus,在此之前,尚未见关于萎缩芽胞杆菌防治甘蓝枯萎病的报道。赵爽等[20]从北京郊外的菜田土壤中分离获得一株具显著抑菌活性的产芽胞细菌T99,试验得出其对甘蓝枯萎病的防治效果优于化学药剂多菌灵。赵达等[21]研究发现枯草芽胞杆菌B30对甘蓝枯萎病菌具较强的抑菌活性,其发酵液的施用时期对甘蓝枯萎病的温室防效影响显著,发酵液灌根后3 d再接种病原菌的效果最好,可明显降低植株发病率和病情指数。本试验筛选出的萎缩芽胞杆菌MQ19ST15的盆栽试验结果显示,该菌株可明显降低甘蓝枯萎病的病情指数,其防效可达53.03%,与70%代森锰锌WP 1 000倍药液的防效相当,但显著高于10亿芽胞/g枯草芽胞杆菌WP 400倍药液的防效。
抑菌活性物质检测显示,菌株MQ19ST15具有产生淀粉酶、蛋白酶、果胶酶、β-1,3-葡聚糖酶的能力,其基因组DNA中具有surfactin、iturin、fengycin和bacillomycin 4种抗菌脂肽活性物质的合成调控基因SrfC、SrfA、Sfp、ItuD、fenB、fenC和BamC,说明该菌株可能代谢产生上述4种抗菌脂肽活性物质。杨雪等[22]分离的7株萎缩芽胞杆菌均对病原真菌瓜类枯萎病菌和油菜菌核病菌具有较强的拮抗活性,部分菌株可产生脂肽物质,具有不同程度的降解纤维素活性和固氮活性。另外,有关萎缩芽胞杆菌次级代谢产物的研究表明,其分泌的抗菌肽、抗藻类物质以及多种小分子物質不仅在农作物生物防治方面具有重要意义,还在工业酶生产、环境保护、污染治理等众多领域有广阔的应用前景[23]。在本次试验中,除抑菌活性外,从盆栽植株大小可见该菌或许可促进植株生长,其促生能力有待后续研究。综上所述,菌株MQ19ST15具有较好的生防潜能,是一株值得开发的生防细菌。
参考文献
[1] 蒲子婧, 张艳菊, 刘东, 等. 甘蓝枯萎病研究进展[J]. 中国蔬菜, 2012(6): 1-7.
[2] 李明远, 张涛涛, 李兴红, 等. 十字花科蔬菜枯萎病及其病原鉴定[J]. 植物保护, 2003, 29(3): 44-45.
[3] 张扬, 郑建秋, 吴学宏, 等. 北京延庆甘蓝枯萎病发生和危害调查[J]. 中国农学通报, 2007, 23(5): 315-320.
[4] 景云飞. 晋中市甘蓝黄叶病的发生与防治[J]. 山西农业科学, 2009, 37(5): 64-66.
[5] 申永铭, 李海源, 陈爱昌, 等. 甘肃定西地区甘蓝枯萎病病原菌的分离与鉴定[J]. 植物保护, 2017, 43(4): 180-184.
[6] 刘小娟, 禄冈强, 陈爱昌, 等. 定西市甘蓝枯萎病发生情况调查[J]. 农业科技与信息, 2020, 585(4): 11-12.
[7] 陈爱昌, 魏周全, 刘小娟, 等. 不同药剂组合灌根防治甘蓝枯萎病试验[J]. 黑龙江农业科学, 2018(7): 68-70.
[8] 陈爱昌, 魏周全, 刘小娟, 等. 三种土壤处理剂防治甘蓝枯萎病试验[J]. 黑龙江农业科学, 2019(3): 59-60.
[9] 邢介帅, 李然, 赵蕾, 等. 生防芽孢杆菌T2胞外蛋白酶的纯化及其抗真菌作用[J]. 植物病理学报, 2008, 38(4): 377-381.
[10]左豫虎, 康振生, 杨传平, 等. β-1, 3-葡聚糖酶和几丁质酶活性与大豆对疫霉根腐病抗性的关系[J]. 植物病理学报, 2009, 39(6): 600-607.
[11]KARTHIKA S, VARGHESE S, JISHA M S. Exploring the efficacy of antagonistic rhizobacteria as native biocontrol agents against tomato plant diseases [J]. 3 Biotech, 2020, 10(7): 1-17.
[12]刘洋, 朱天辉, 郑磊, 等. 一株内生拮抗细菌的分离鉴定及其抗菌机理研究[J]. 植物保护, 2016, 42(1): 33-39.
[13]VELHO R V, MEDINA L F C, SEGALIN J, et al. Production of lipopeptides among bacillus strains showing growth inhibition of phytopathogenic fungi [J]. Folia Microbiologica, 2011, 56(4): 297-303.
[14]金清, 肖明. 新型抗菌肽——表面活性素、伊枯草菌素和丰原素[J]. 微生物与感染, 2018, 13(1): 56-64.
[15]田书鑫, 刘南南, 王桂清. 对峙培养法在生防菌抑制效果研究中的应用[J]. 河南农业科学, 2019, 48(8): 1-6.
[16]胡荣, 方琳琳, 付朦, 等. 淀粉酶高产菌的筛选、鉴定、诱变及生产优化[J]. 江西师范大学学报(自然科学版), 2019, 43(5): 496-500.
[17]荆卓琼, 郭致杰, 徐生军, 等. 解淀粉芽孢杆菌HZ-6-3的筛选鉴定及其防治番茄灰霉病效果的评价[J]. 草业学报, 2020, 29(2): 31-41.
[18]杨宇红, 吕红豪, 杨翠荣, 等. 甘蓝枯萎病苗期抗性鉴定技术及抗源筛选[J]. 植物保护学报, 2011, 38(5): 425-431.
[19]卢彩鸽, 张殿朋, 刘伟成, 等. 一株甘蓝枯萎病拮抗细菌的筛选、鉴定及其抑菌活性测定[J]. 华北农学报, 2014, 29(1): 195-202.
[20]赵爽, 刘伟成, 裘季燕, 等. 产芽孢细菌T99生防作用评价及其活性产物分析[J]. 中国生物防治, 2008, 24(4): 345-349.
[21]赵达, 刘伟成, 裘季燕, 等. 枯草芽孢杆菌B03对植物病原真菌的抑制作用[J]. 安徽农业科学, 2007, 35(15): 4554-4555.
[22]杨雪, 谢永丽, 陈兰, 等. 青海极端生境7株萎缩芽孢杆菌的生物活性[J]. 福建农林大学学报(自然科学版), 2020, 49(4): 459-466.
[23]刘思靖. 萎缩芽孢杆菌次级代谢产物的研究进展[J]. 现代化工, 2019, 39(12): 48-51.
(责任编辑:杨明丽)
