胡杨根际可培养细菌的分离及抑制瓜列当种子萌发研究
2021-10-12王宁包慧芳崔华星侯敏龙宣杞詹发强杨蓉艾尼江·尔斯满史应武
王宁 包慧芳 崔华星 侯敏 龙宣杞 詹发强 杨蓉 艾尼江·尔斯满 史应武


摘要 从胡杨生存的干旱强光照逆境中获得新的细菌资源,从中筛选新的可抑制瓜列当种子萌发的生防菌。采用3种分离培养基,以稀释涂布法对塔里木河流域3处胡杨根系样品进行可培养细菌分离,通过分析分离菌株16S rRNA基因序列确定其种属分类。采用皿内培养法测定其对瓜列当种子萌发的抑制活性,利用盆栽试验检测分离菌株M2-3对瓜列当寄生的防治效果。结果分离获得98株细菌,分属于28个属,马赛菌属Massilia、Pontibacter、玫瑰单胞菌属Roseomonas为优势菌属。其中,菌株M2-3与Pontibacter salisaro HMC5104T的相似度最高,为9792%,其菌体发酵液10倍稀释液对瓜列当种子萌发抑制率为87.8%,盆栽试验表明该菌株对瓜列当防效可达369%,具备进一步开发可能性。
关键词 胡杨; 根系微生物; 瓜列当; 种子萌发
中图分类号: S 476
文献标识码: A
DOI: 10.16688/j.zwbh.2020493
Isolation of culturable bacteria from the rhizosphere of Populus euphratica and inhibition activity on the seed germination of Orobanche aegyptiaca
WANG Ning, BAO Huifang, CUI Huaxing, HOU Min, LONG Xuanqi, ZHAN Faqiang,
YANG Rong, AINJIANG Osman*, SHI Yingwu*
(Institute of Applied Microbiology, Xinjiang Academy of Agricultural Sciences, Xinjiang Key Laboratory of Special
Environmental Microbiology, Urumqi 830091, China)
Abstract
New bacterial resources were obtained from the drought and high light environment where Populus euphratica grows and new biocontrol resources for inhibiting the seed germination of Orobanche aegyptiaca were screened. Culturable bacteria were isolated from three P.euphratica root samples in Tarim River basin by dilution plating method and identified by 16S rRNA gene sequence analysis. In vitro culture method was used to determine the inhibition activity on the seed germination of O.aegyptiaca. Pot experiment was used to detect the control effect of M2-3 against the parasitism of O.aegyptiaca. Results showed that 98 bacteria strains were isolated, belonging to 28 genera, among which Massilia, Pontibacter and Roseomonas were the dominant bacteria.The similarity between strain M2-3 and Pontibacter salisaro strain HMC5104T was 97.92%.The inhibiting rate of 10-fold diluted fermentation filtrate on seed germination of O.aegyptiaca was 87.8%, and the control efficacy was up to 36.9%. The strain M2-3 had the potential for further development.
Key words
Populus euphratica; root microorganism; Orobanche aegyptiaca; seed germination
瓜列当Orobanche aegyptiaca Pers.又称分枝列当,是列当科Orobanchaceae列当属Orobanche一年生全寄生性植物,由于没有叶绿素,不能进行光合作用,其真根退化为吸盘,与寄主植物的根系相连,利用寄主的营养物质与水分进行异养生长[1]。作为一种恶性杂草,瓜列当不仅直接影响作物的长势和产量,由于其对寄主光合作用与激素平衡等生理的负面影响,还易导致其他病害的发生。瓜列当在世界各地普遍发生,主要寄生番茄、哈密瓜、西瓜、甜瓜,其次是向日葵、葫芦、胡萝卜、白菜以及一些杂草,已成为农业种植体系中的严重公害[2-3]。
由于列当的寄生模式为地下寄生并且同寄主植物根系直接相连,因此常规除草剂很难直接与其地下部接触。目前,尚无针对列当专一性强且适用于大规模推广应用的防除措施[4]。由于绿色环保越来越引起关注和重视,利用微生物进行列当杂草防除的研究日益增多。已经报道的具有防除列当潜能的微生物主要分离自列当病原菌、寄主植物共生菌和其他微生物,包括镰刀菌Fusarium spp.、根瘤菌Rhizobium spp.、洋葱曲霉Aspergillus alliaceus、丛枝菌根真菌(arbuscular mycorrhizal fungi)、假單胞菌Pseudomonas spp.、芽胞杆菌Bacillus spp.等[5]。由于目前开发的生防菌有些引起寄主植物产生病害,有些防效不稳定,利用特定生境开展新型抗瓜列当生防资源收集迫在眉睫[6]。
胡杨是位于新疆塔里木河流域的珍贵森林资源,是唯一一种能够生长于干旱、半干旱地区的乔木植物,具有很高的耐旱耐盐性[7]。胡杨根际土壤作为一种特殊环境,其微生物群落结构研究逐渐成为热点[8],胡杨与列当属一些野生种生存环境相似,且其根际生防菌资源及活性物质尚未被充分挖掘与研究,本研究从新疆塔里木河胡杨林地根围土收集寡营养、抗逆性强的细菌资源用于抗瓜列当种子萌发试验,初步研究结果报道如下。
1 材料与方法
1.1 材料
1.1.1 根围土样品采集
菌株分离用根围土(深度5~20 cm),
采集自塔里木河天然胡杨林,3份样品均存于无菌纸袋内存放于4℃。采样信息见表1。
1.1.2 培养基
R2A培养基:酵母浸出粉0.5 g/L,蛋白胨0.5 g/L,酪蛋白水解物0.5 g/L,葡萄糖0.5 g/L,可溶性淀粉0.5 g/L,K2HPO4 0.3 g/L,MgSO4 0.024 g/L,丙酮酸钠0.3 g/L,琼脂15.0 g/L,pH(7.2±02)。TSA培养基:胰蛋白胨15 g/L,大豆胨5 g/L,NaCl 5 g/L,琼脂15 g/L,pH(7.3±0.2)。MA培养基: MgCl2 5.9 g/L,Na2HPO4 8.0 mg/L,CaCl2 18 g/L,MgSO4 3.2 g/L,Na2O·mSiO2 4.0 mg/L,H3BO3 22 mg/L,SrCl2 34 mg/L,NH4NO3 1.6 mg/L,NaF 2.4 mg/L,FeC6H5O7 0.1 g/L,NaHCO3 0.16 mg/L,KBr 0.55 g/L,NaCl 19.45 g/L,酵母提取物 1.0 g/L,蛋白胨5.0 g/L,pH(7.2±02)。 上述3种培养基用于可培养细菌的分离纯化及后续继代培养。
1.1.3 主要试剂和仪器
引物 27F/1492R、PCR mix kit 购自生工生物工程(上海)股份有限公司;细菌基因组 DNA提取试剂盒购自天根生化科技(北京)有限公司;独脚金内酯人工合成类似物(GR24),购自北京酷来搏科技有限公司。
仪器:超净工作台SW-CJ-2F,上海博迅实业有限公司;恒温培养箱 BI-250A,施都凯仪器设备有限公司;振荡式摇床 ZWY-2102C,上海智城分析仪器制造有限公司;高速离心机 H1650,湖南湘仪实验室仪器开发有限公司;PCR 扩增仪 T100、凝胶成像仪Gel DocTMXR+,Bio-Rad;显微镜SZ61,奥林巴斯(深圳)工业有限公司。
1.2 方法
1.2.1 菌株的分离
将1 g新鲜土壤样品加入装有9 mL灭菌生理盐水的试管中,150 r/min振荡20 min,吸取1 mL土壤悬液进行10倍梯度稀释,取10-2、10-3、10-4、10-5稀释液0.1 mL分别涂布于3种分离培养基上,28℃恒温培养30 d,从第7天开始,每日挑取新出现的菌落用相同的分离培养基进行纯化,纯化后的菌株置于甘油中保藏,存放于-80℃冰箱。
1.2.2 菌株的分类鉴定及构建系统发育树
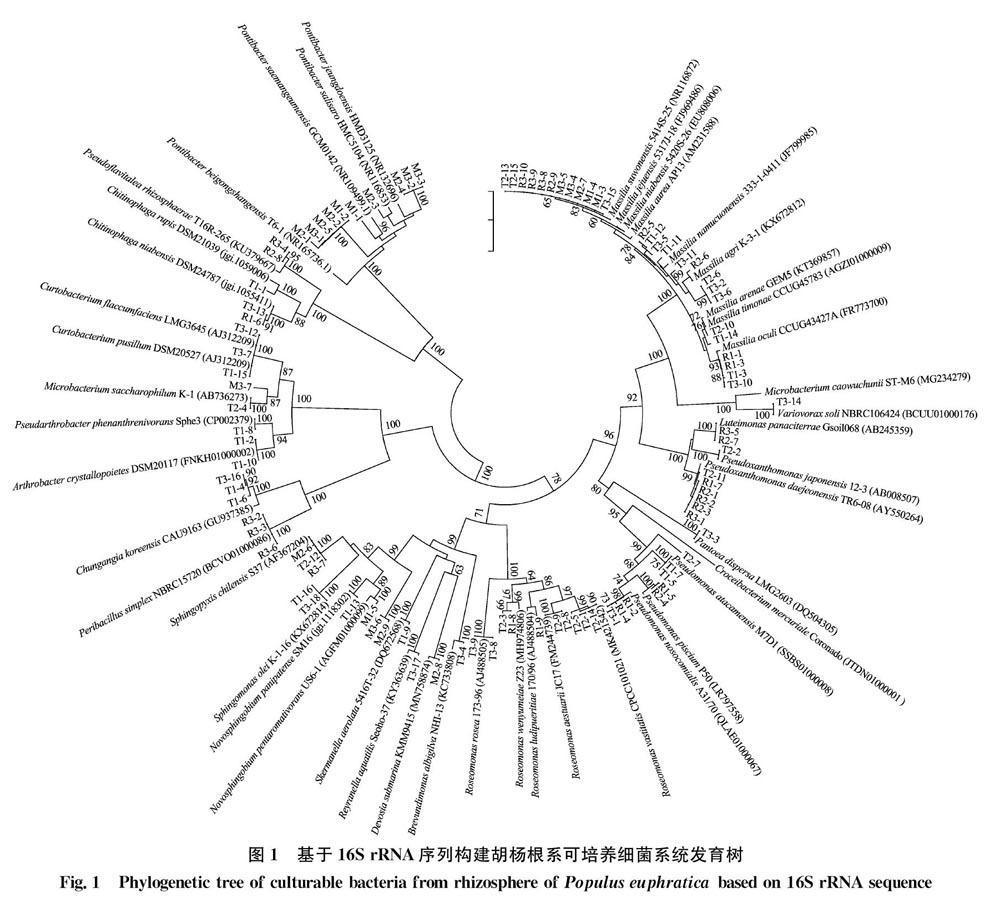
利用细菌基因组DNA提取试剂盒提取分离菌株的基因组DNA,采用16S rRNA特异性引物进行PCR扩增。引物序列为27F: 5′-AGAGTTTGATCCTGGCTCAG-3′, 1429R: 5′-AAGGATGGTGATGCCGCA-3′。PCR扩增体系(50 μL):PCR mix 25 μL,ddH2O 17 μL,DNA模板4 μL,10 μmol/L引物各2 μL。扩增程序为:95℃ 5 min;94℃ 45 s,56℃ 45 s,72℃ 2 min,30个循环。利用0.8% 琼脂糖凝胶电泳检测PCR产物,将1 600 bp处可观察到条带的PCR产物送至生工生物工程(上海)股份有限公司测序。利用Eztaxon 数据库(https:∥www.ezbiocloud.net)对测序结果进行同源比对。挑选与之同源性高的模式菌株16S rRNA序列,比较其与参试菌株的序列相似性。利用 MEGA 6.0软件,采用邻接法(neighbor-joining)进行系统进化树的构建及多样性分析,自展值(bootstrap)为1 000。
1.2.3 瓜列当种子的预培养
将瓜列当种子依次在1.0%(m/V)次氯酸钠溶液和75%乙醇中超声清洗5 min和1 min进行表面消毒。用无菌生理盐水冲洗3遍后置于超净工作台内自然晾干。将直径为80 mm的玻璃纤维滤纸片摆放于事先铺有2层普通定性滤纸的培养皿(直径9.0 cm)中,随后将晾干的瓜列当种子均匀置于玻璃纤维滤纸片中央,每张滤纸片上约30~60粒。将上述培养皿封口,保持一定湿度,置于25℃的黑暗环境培养5 d待用。
1.2.4 菌株无细胞发酵液制备
将待测菌株分别接种于R2A、MA和TSA培养基中,37℃培养24 h。挑取已活化菌株转接于相应的液体培养基中,于37℃,150 r/min的摇床中振荡培养,同时以空白培养基为对照。振荡培养18 h后,每瓶取30 mL培养液5 500 r/min,离心7 min。离心后的上清液经045 μm的微孔滤膜过滤,过滤后的上清液即为无细胞发酵滤液。
1.2.5 菌株发酵液对瓜列当种子萌发抑制试验
将预培养的铺有瓜列当种子的玻璃纤维滤纸片转移至新灭菌培养皿中,依次添加30 μL 10倍稀释的发酵滤液和30 μL0.1 mg/L独角金内酯类似物GR24(上海源叶生物科技有限公司)。培养皿中间放1张对折3次的湿润定性滤纸保湿,然后用封口膜将培养皿封口。分別以添加无菌水和只加0.1 mg/L GR24 为阴性和阳性对照,各处理重复6次。随后将培养皿放入25℃黑暗环境下继续培养。7 d后,用体视显微镜观察并记录瓜列当种子萌发数量和种子总数,利用公式(1)和(2)计算萌发率和萌发抑制率。
GR=[(GN-GH)/(GT-GH)]×100%(1)
式中GR为萌发率,GN为处理列当种子萌发数量,GT为列当种子总数, GH为无菌水处理列当种子萌发数量。
IR=(GRT-GRN)/GRT×100%(2)
式中IR为萌发抑制率,GRN为处理列当种子萌发率,GRT为对照中列当种子萌发率。
1.2.6 菌株M2-3对瓜列当的盆栽防效
培养土配制:将本地农田土壤过孔径0.5 cm筛网,将过筛土壤、草炭和蛭石按照2∶1∶1的体积比配制。接种土配制:每千克培养土添加0.20 g瓜列当种子,边加种子边翻动土壤,确保混匀。取100 g接种土放于7 cm×7 cm×11 cm的营养钵中,将长势一致的4~6叶番茄苗移入营养钵中,每个营养钵移栽2株苗。采用灌根方式于移栽当日、移栽后15、30 d将浓度为1×107 cfu/mL M2-3菌液5 mL浇入营养钵内,对照组加入等量清水,每处理设10个重复,按需浇水、施肥,并于移栽后35 d统计瓜列当寄生数量,依据公式(3)计算寄生强度,公式(4)计算防除效果。
PF=NO/NT(3)
式中PF为寄生强度,NO为瓜列当寄生数量,NT为番茄株数。
CE=(CPF-DPF)/CPF×100%(4)
式中CE为防除效果,CPF为对照寄生强度,DPF为处理寄生强度。
2 结果与分析
2.1 菌株的分离
土壤样品采自塔里木河流域天然胡杨林,3份样品均为胡杨根系5~20 cm地下浅层土。利用3种分离培养基进行可培养细菌的纯化。所分离细菌以白色、红色、黄色居多,根据颜色、形状、大小、光滑度等特征进行初步去重整理。结果共分离到98株细菌,其中分离自样点3的菌株数最多,共35株,占比 35.7%,分离自樣点1的菌株数最少,为30株,占比30.6%。
2.2 菌株鉴定及细菌多样性分析
对所分离的菌株进行16S rRNA扩增、测序及序列比对,利用邻接法构建系统发育树(图1)。 结果表明,98株细菌分属于20个科28个属,以草酸杆菌科Oxalobacteraceae为主,其次为Hymeno-bacteraceae、醋酸杆菌科Acetobacteraceae,3个科总占比高达48.0%。
为从样品中获得更多的细菌种属,本试验采用MA、R2A、TSA 3种培养基进行分离,此类培养基多用于盐碱环境及寡营养环境细菌的分离,纯化菌株分别以3类培养基首字母命名。结果表明,马赛菌属Massilia、Pontibacter和玫瑰单胞菌属Roseomonas为优势菌属。鞘氨醇盒菌属Sphingopyxis、马赛菌属和芽胞杆菌属Bacillus是3种培养基均能分离到的菌属,马赛菌属也是本次分离菌种数量最多的属。MA、TSA培养基均分离到新鞘脂菌属Novosphingobium,R2A、TSA培养基均分离到假黄单胞菌属Pseudoxanthomonas、Chitinophaga、玫瑰单胞菌属、假单胞菌属Pseudomonas 4个属的细菌。3种培养基中,TSA分离到的细菌属最多,有21个属,R2A分离到9个属,MA上分离的最少,有8个属,但菌株M1-1(与Hymenobacteraceae的Pontibacter saemangeumensis 菌株 GCM0142T相似性为95.05%),菌株M2-3(与Pontibacter salisaro 菌株 HMC5104T相似性为97.92%),均从MA培养基上分离得到。
不同样点分离到的可培养细菌多样性也存在差异。在门水平,3个采样点分离的细菌主要分布在变形菌门Proteobacteria,HY1样点还分离到放线菌门Actinomycetes(133%)、拟杆菌门Bacteroidetes(133%)和厚壁菌门Firmicutes(6.7%);HY2样点分离到拟杆菌门(18.2%)、放线菌门(30%);HY3样点分离到厚壁菌门(14.3%)、拟杆菌门(14.3%)和放线菌门(5.7%)。在属水平上,HY1、HY3单独分离到6个属,占比分别为20%和17.1%,HY2单独分离到4个属,占比12.1%。
2.3 Pontibacter属菌株抑制瓜列当种子萌发分析
3个样点共分离得到10株Pontibacter属细菌,将菌株发酵液稀释10倍后用于瓜列当种子萌发抑制试验,统计结果见表2。M1-1、M1-2、M2-1、M2-2、M2-5、M3-1的发酵液可使列当种子萌发的芽管变黄,但对芽管长度抑制效果不明显。M2-4、M3-2、M3-3的发酵液对列当芽管有一定致畸效果,可见芽管长势不壮。M2-3的发酵液对列当种子的萌发抑制率效果最显著,可达878%,菌株发酵液作用后部分列当种子仍处于休眠状态。部分菌株的萌发抑制效果见图2。
2.4 菌株M2-3对瓜列当的盆栽防效
如表3所示,用M2-3菌液对营养钵进行灌根处理,每个营养钵瓜列当寄生数平均为22.6株,寄生强度较对照下降6.6,防除效果达369%。盆栽试验结果表明,M2-3对瓜列当有明显防除作用(图3)。
3 讨论
本研究对新疆塔里木河流域天然胡杨林的根系土壤样品进行细菌分离培养,采样时间为2018年7月,此时气温高,光照辐射时间长,蒸腾作用强,利于抗逆微生物的获得。从3份土壤样品中分离鉴定出98株细菌,经16S rRNA序列比对分析,它们分属于变形菌门、拟杆菌门、放线菌门和厚壁菌门,此结果与先前的研究结果基本一致。程冬梅等[9]对该区域根际微生物多样性分析发现,厚壁菌门、变形菌门、拟杆菌门、放线菌门和疣微菌门Verrucomicrobiae是主要的微生物门类。许孟博[10]对该区域的地表层和地表下层土壤微生物多样性分别进行了研究,结果表明,二者样品中微生物种群组成有较大的差别,地表层样品中的微生物主要包括栖热-奇球菌门Deinococcus-Thermus、放线菌门和变形菌门,地表下层样品中的优势种群为厚壁菌门、放线菌门、变形菌门和拟杆菌门。
本次分离到的可培养细菌中,许多属具有生态效应及应用潜能。如3个样点的主要分离属马赛菌属多与植物有关,可在土壤和水体中找到,目前有其用于污染物治理和植物促生的报道[11-12]。假黄单胞菌属在自然界中与氮素转化有关,是影响NH-N转化的关键重氮营养群落[13]。HY1、HY3样点中分离到的Chitinophaga也在植物根系环境中起到促生作用,近期也有关于其特有几丁质酶的用途研究[14-15]。Pontibacter属菌株广泛存在于海洋、沙漠、农田等自然界,随着微生物分类学的发展,该属中多个种被发现,Pontibacter aydingkolensis就是本实验室从艾丁湖沉积层发现并命名的,但该属菌株的应用潜能尚未充分发掘[16]。
瓜列当是恶性入侵性根寄生杂草,已报道的可用于瓜列当生物防治的细菌有铜绿假单胞菌Pseudomonas aeruginosa、熒光假单胞菌P.fluorescens、萎缩芽胞杆菌Bacillus atrophaeus和枯草芽胞杆菌B.subtilis,这些细菌主要在种子萌发及胚根生长过程起作用[17]。筛选出的Pontibacter属部分菌株对瓜列当种子萌发有明显抑制作用,尤其是M2-3菌株,发酵液稀释10倍后对瓜列当种子萌发抑制率接近90%,盆栽试验也证明该菌株可减轻瓜列当对寄主番茄的寄生,因此,在该菌株的次生代谢产物中可能有可作为生物农药的先导化合物。
本试验对胡杨林根际可培养细菌种类进行初步探索,未来可继续优化培养方案,以期获
得更多的可培养微生物资源,由于首次发现Pontibacter属菌株的除草生防潜能,同属不同种菌株对瓜列当种子萌发抑制能力不同,具体田间防效还需后续试验验证。
参考文献
[1] CLARKE C R, TIMKO M P, YODER J I, et al. Molecular dialog between parasitic plants and their hosts [J]. Annual Review of Phytopathology,2019,25(8): 57-69.
[2] AHMAD T, AHMAD B, TARIQ R M S, et al. Assessment of the yield loss imparted by Orobanche aegyptiaca in tomato in Pakistan [J]. Annals of the Brazilian Academy of Sciences, 2018, 90(4): 3559-3563.
[3] BERENDSEN R L, PIETERSE C M, BAKKER P A. The rhizosphere microbiome and plant health [J]. Trends in Plant Science, 2012, 17(12): 478-486.
[4] LOUARN J, CARBONNE F, DELAVAULT P, et al. Reduced germination of Orobanche cumana seeds in the presence of arbuscular mycorrhizal fungi or their exudates [J/OL]. PLoS ONE, 2012, 7(11):e49273.DOI:10.1371/journal.pone.0049273.
[5] BARGHOUTHI S, SALMAN M. Bacterial inhibition of Orobanche aegyptiaca and Orobanche cernua radical elongation [J]. Biocontrol Science and Technology,2010,20(4):134-147.
[6] MABROUK Y, ZOURGUI L, SIFI B, et al. Some compatible rhizobium leguminosarum strains in peas decrease infections when parasitised by Orobanche crenata [J]. Weed Research, 2007, 47(1): 44-53.
[7] JIA Huixia, LIU Guangjian, LI Jianbo, et al.Genome resequencing reveals demographic history and genetic architecture of seed salinity tolerance in Populus euphratica [J].Journal of Experimental Botany,2020,71(6):1-14.
[8] 吐尔逊阿依·麦麦提依明, 玛依古丽·库尔班, 马丽艳木·阿木东, 等. 新疆Kiyik废弃古河道天然胡杨林地可培养细菌的多样性研究[J]. 新疆农业科学, 2016, 53(5): 921-934.
[9] 程冬梅, 唐雅丽, 张坤迪, 等. 新疆天然胡杨林地区根际微生物的种群分析[J]. 生态科学, 2013, 32(6): 711-717.
[10]许孟博. 新疆胡杨林根际可培养细菌的多样性及两个潜在新分类单元的多相分类学研究[D]. 武汉: 武汉大学, 2011.
[11]HENRIKE M, ANDRI F, MARKUS G, et al. Draft genome sequences of six type strains of the genus Massilia [J/OL]. Microbiolagy Resource Announcements, 2020, 18(9): e00226-20. DOI: 10.1128/MRA.00226-20.
[12]郭宇泽, 丁雪敏, 姚岚, 等. 马西利亚菌B260的分离鉴定及促进育苗的效果[J]. 生物技术通报, 2019, 35(9): 144-149.
[13]WU Xiaotong, SUN Yu, DENG Liting, et al. Insight to key diazotrophic community during composting of dairy manure with biochar and its role in nitrogen transformation [J]. Waste Management, 2020, 105(3):190-197.
[14]MIRZA A M, HZ Z, JIASEN C, et al. Sclerotia of a phytopathogenic fungus restrict microbial diversity and improve soil health by suppressing other pathogens and enriching beneficial microorganisms [J]. Journal of Environmental Management, 2020, 259(1):1098-1111.
[15]SHARMA S, SINGH R, KAUR R. In silico characterization of a unique plant-like “Loopful” GH19 chitinase from newly isolated Chitinophaga sp. YS-16 [J]. Current Microbiology 2020,779(9):43-53.
[16]OSMAN G, ZHANG Tao, LOU Kai, et al. Pontibacter aydingkolensis sp. nov., isolated from soil of a salt lake [J]. International Journal of Systematic and Evolutionary Microbiology, 2016, 66(12): 2545-2555.
[17]崔華星,王宁,侯敏,等. 生防菌DNKAS对加工番茄分枝列当的防治应用[J]. 中国农业科技导报, 2020,22(12):105-114.
(责任编辑:杨明丽)
