一株引起田间昆虫流行病的虫生真菌的多基因序列鉴定
2021-10-12黄姗宋章永
黄姗 宋章永
摘要 本研究采用形态学鉴定、单基因、多基因序列系统发育进化分析等方法对引起山东临沂地区的白菜地夜蛾科昆虫流行病的病原真菌进行鉴定,明确了此病原真菌的系统分类地位。通过菌株的菌落特征、培养特征和产孢特性初步确定引起山东临沂地区夜蛾科昆虫流行病的病原菌系绿僵菌属Metarhizium spp.,通过多基因序列测定、系统发育进化分析,进一步确定引起流行病的菌株为莱氏绿僵菌Metarhizium rileyi,菌株命名为SDMr01。用浓度为1.0×108个/mL的SDMr01孢子懸浮液分别浸泡小菜蛾Plutella xylostella及斜纹夜蛾Spodoptera litura 2龄幼虫进行致病性测定,14 d后累计校正死亡率分别为77.1%、80.5%。结果表明,莱氏绿僵菌SDMr01对部分夜蛾科害虫具有良好的生防潜力及开发应用前景。
关键词 莱氏绿僵菌; 多基因序列分析; 分离鉴定; 致病力
中图分类号: S 476.12
文献标识码: A
DOI: 10.16688/j.zwbh.2020539
Identification of pathogenic fungus causing field pests epidemics based on multiple-gene sequence analysis
HUANG Shan1*, SONG Zhangyong2
(1. Weifang Nursing Vocational College, Weifang 262500, China;
2. Southwest Medical University, Luzhou 646000, China)
Abstract
Morphological identification, singular gene and multigene phylogenetics methods were used to identify entomogenous fungi which lead to Noctuidae epidemics in China cabbage field in Linyi, Shandong province. Morphological observation indicated that the entomogenous fungus was Metarhizium. Molecular phylogenetic analysis confirmed that the entomogenous fungus was Metarhizium rileyi, named as SDMr01. The mortalities of 2nd instar larvae of Plutella xylostella and Spodoptera litura infected by 1.0×108 spore/mL SDMr01 suspension were respectively measured by immersion method. The corrected accumulative mortalities rate reached 77.1% and 80.5% 14 days after treatment, respectively. The results demonstrated SDMr01 had good biocontrol potential and application prospects against some Noctuid insects.
Key words
Metarhizium rileyi; multiple gene sequence analysis; isolation and identification; pathogenicity
昆虫病原真菌是寄生于昆虫并引起昆虫死亡的一类真菌,多数寄主范围广,可感染多种昆虫。目前研究较多的有球孢白僵菌Beauveria bassiana、绿僵菌Metarhizium spp.、玫烟色棒束孢Isaria fumosorosea、青霉Penicillium、拟青霉Paecilomyces等[1-4]。近年来,国内外一些研究表明,球孢白僵菌,布氏白僵菌Beauveria brongniartii,金龟子绿僵菌Metarhizium anisopliae,莱氏绿僵菌Metarhizium rileyi等对草地贪夜蛾具有良好的生防潜能[5]。
莱氏绿僵菌,旧称莱氏蛾霉,可侵染多种鳞翅目害虫的幼虫,田间经常能观察到莱氏绿僵菌引起害虫种群的自然流行疾病。早在1974年,Kish等首次模拟出了莱氏绿僵菌的流行病学模型,利用此模型较为准确的预测出了田间害虫死亡率,为莱氏绿僵菌的开发应用奠定了基础[6]。大量的研究表明,莱氏绿僵菌引起昆虫流行病的暴发受多种因素的影响,包括生物因素和非生物因素,其中非生物因素中较为重要的是环境温度、湿度及风力。适于害虫流行病暴发的环境温度是25℃左右,湿度在70%~75%。因此,在全年温度较高,降水量较大的热带地区容易暴发害虫流行病[7-8]。
本课题组在山东临沂地区调查发现,每年的5月-10月间时常发生农作物害虫流行病,为明确引起2018年昆虫流行病的病原真菌种类,课题组于2018年9月在临沂地区田间白菜地采集了大量病虫尸体,分离到一株优势菌株,经形态学鉴定和分子生物学鉴定,明确引起该地昆虫流行病的病原菌为绿僵菌属的莱氏绿僵菌。并测定了分离菌株对2种夜蛾科昆虫幼虫的毒力,旨在为该病原真菌在害虫生物防治中的应用奠定基础。
1 材料与方法
1.1 供试材料与菌种采集
供试菌株:将自山东临沂地区白菜地采集大量死亡的僵虫尸体,初步鉴定僵虫有斜纹夜蛾Spodoptera litura、粉纹夜蛾Trichoplusia ni、小菜蛾Plutella xylostella、菜青虫 Pieris rapae 等,经分离纯化获得菌株。
供试昆虫:小菜蛾、斜纹夜蛾第1代虫卵采自农田蔬菜地,将虫卵在(24±1)℃、RH 60%~90%、L∥D=12 h∥12 h的人工气候培养箱中孵化,孵化的幼虫在相同条件下用人工饲料饲养[9]。挑选第2代大小一致的2龄幼虫作为供试虫源。
SMAY(萨氏麦芽糖琼脂培养基):蛋白胨2.5 g,酵母提取物5.0 g,琼脂粉18 g,麦芽糖40 g,加蒸馏水至终体积1 000 mL。1/4 SDAY(1/4萨氏葡萄糖蛋白胨琼脂培养基):蛋白胨2.5 g,酵母提取物5.0 g,琼脂粉18 g,葡萄糖10 g,加蒸馏水至终体积1 000 mL。PDA(马铃薯葡萄糖琼脂培养基):葡萄糖20.0 g,琼脂15.0 g,马铃薯小块200.0 g,添加蒸馏水至终体积1 000 mL。
试剂:PCR扩增试剂(10×Buffer、10 mmol/L dNTPs、25 mmol/L MgCl2、5 U/μL rTaq酶)购自TaKaRa公司;DNA小量提取试剂盒购自加拿大MBI Fermentas公司;DNA纯化试剂盒购自Axygen公司;葡萄糖,麦芽糖,酵母提取物,蛋白胨,购自生工生物工程(上海)股份有限公司。
1.2 菌株的分离纯化
用无菌接种环轻轻蘸取僵虫表面的绿色分生孢子粉,用划线法分别接种于PDA、SMAY、1/4SDAY平板上,置于25℃的恒温培养箱中培养。每天观察菌落的生长状况,用尖头镊子夹取优势菌的菌丝体进行再次接种,让其继续生长,并观察生长情况,经过几次转接即可获得纯培养物。将菌株命名为SDMr01。
1.3 菌株形态学观察
在SMAY上培养菌株SDMr01,采取真菌插片培养法培养至产生分生孢子,取下盖玻片制作临时装片,置于显微镜下观察菌株的菌丝,孢子梗,分生孢子等形态,结合菌株的菌落形态初步判断菌株的分类地位。
1.4 基因扩增与测序
用玻璃涂布棒将制备好的菌株SDMr01的分生孢子悬浮液均匀涂布于 SMAY 平板上,置于25℃下恒温培养,10 d后收集新鲜的菌丝及分生孢子。将菌丝及分生孢子加液氮进行充分研磨,提取基因组DNA。采用真菌通用引物ITS1/ITS4扩增ITS序列。同时扩增β-tubulin、EF1α和 rpb2[10]基因。基因扩增引物如下:ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′。
β-tubulin上游:5′-CATTATACCGAAGGAGCTGAGCTCG-3′,下游:5′-CGTCCATACCCTCACCTGTGTAC-3′。EF1α上游:5′-ATGGGTAAAGGAAGACAAGACTCAC-3′,下游:5′-GGAAAGTACCCATGATCATGTTCTTG-3′。rpb2上游:5′-CAGTGTTGGTTCACCGGCCGAG-3′,下游:5′-TTTCCCATGGCCTTGTTTACCC-3′。50 μL PCR反應体系:10×PCR Buffer 5 μL、10 mmol/L dNTPs 2 μL、25 mmol/L MgCl2 3 μL、10 μmol/L引物各1 μL、25 ng/μL DNA 模板 4 μL、5 U/μL rTaq 1 μL、超纯水33 μL。PCR反应程序:94℃预变性5 min;94℃变性15 s,50℃退火45 s,72℃延伸45 s,35个循环;72℃延伸5 min。用 1% 琼脂糖凝胶电泳检测扩增产物,对目的DNA片段进行回收纯化,纯化产物连接转化大肠杆菌感受态细胞JM109,挑取阳性克隆送华大基因公司测序。
1.5 系统发育进化分析
将测序得到的基因序列提交到GenBank,用BLAST完成序列比对,确定其种属分类地位,选取绿僵菌属各模式菌株的EF1α、rpb2、β-tubulin 基因序列,用序列比对软件Clustal 1.83分别对各基因序列进行比对,用分子进化遗传分析软件MEGA 7构建菌株单基因系统发育进化树。通过PhyloSuite软件中的模型计算软件ModelFinder计算EF1α、rpb2、β-tubulin 基因序列的最佳模型,分别利用MrBayes 3.2.6软件的BI法和Iqtree软件中的最大似然法构建多基因系统发育进化树。贝叶斯分析中设定运行代数mcmc=1 000 000,通过节点上的后验概率值来评估构建的进化树。最大似然法分析中设定bootstrap=5 000,通过节点上的自举值来评估构建的进化树,判断菌株所属种类。
1.6 致病性测定
菌株SDMr01接种于SMAY培养基,于25℃下培养10 d待其产孢。用无菌刀片将分生孢子刮下,置于0.05%(V/V)吐温-80溶液中,用磁力搅拌器搅拌30 min,待孢子完全被打散均匀后,用无菌纱布过滤,获得纯孢子悬浮液,血球计数板计数确定孢子浓度为1×108个/mL。将小菜蛾、斜纹夜蛾2龄幼虫分别放入孢子悬浮液中浸泡30 s,以无菌005%(V/V)的吐温-80水溶液浸泡幼虫为对照,浸泡接种后置于干净的培养皿中自然晾干,然后统一放置于25℃,相对湿度为80%的气候箱中饲养(饲养方法同上)。每2 d观察昆虫的死亡情况,直到各处理中昆虫的死亡数量不再变化为止。各处理供试昆虫30头,设重复3次。毒力测定过程中,挑出死亡的试虫进行保湿培养,观察是否变为僵虫,从僵虫中再次分离菌株,观察其形态特征,并特异性扩增其ITS片段,比较是否与分离菌株SDMr01一致,以完成柯赫氏法则验证。试虫的校正死亡率用Windows Excel和DPS软件处理。
死亡率=死虫数/试虫数×100%;
校正死亡率=[(处理组死亡率-对照组死亡率)/(1-对照组死亡率)]×100%。
2 结果与分析
2.1 菌种形态学特征
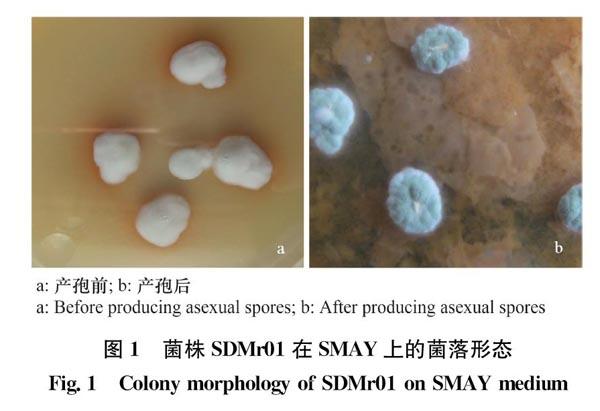
菌株SDMr01在SMAY平板上培养3 d即有白色绒毛状菌丝长出,菌丝与培养基结合紧密不易挑起,随后菌落不断扩大且变得干燥,干燥的菌落背面皱裂,呈红褐色。7 d左右,在菌落中央开始长出绿色的分生孢子,而后向内、外蔓延,最终分生孢子覆盖整个菌落,使其呈橄榄绿色(图1)。
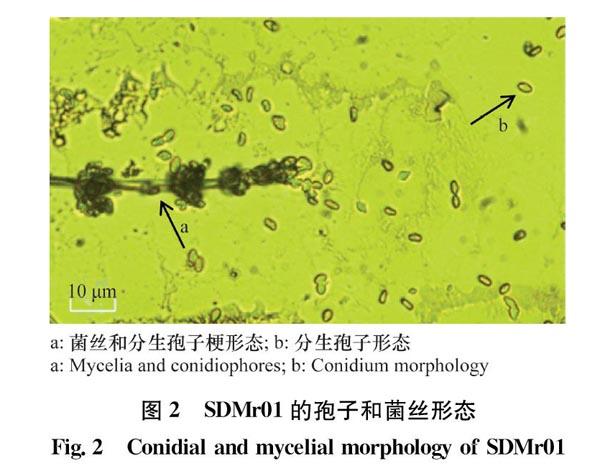
插片培养法培养菌株SDMr01,用光学显微镜观察菌丝、孢子梗及孢子形态特征(图2),镜下分生孢子梗分支簇致密,单轴生,呈葡萄穗状(图2a箭头),在短尖上着生分生孢子,分生孢子呈椭圆形,两端略尖,光滑,颜色呈淡绿色(图2b箭头)。有些分生孢子连接在一起,大小约为(3.0~3.5)μm×(30~5.0)μm(图2b箭头所示)。以上分生孢子梗及分生孢子的特征与已报道的莱氏绿僵菌较一致。
2.2 基因扩增与测序
分别扩增菌株SDMr01的ITS、EF1α、rpb2、β-tubulin 基因序列,扩增产物的电泳检测结果如图3所示,经测序获得4个基因序列的大小分别为597、746、840、960 bp,将4条序列提交Genbank数据库,获得登录号分别为MT737785,MW672104、MW661285、MW677604。4条序列的BLAST 比对结果均显示菌株SDMr01与莱氏绿僵菌一致性最高。
2.3 单基因系统发育进化分析
以白僵菌为外群,构建基于ITS序列单基
因MP系统进化树,结果如图4所示,分离菌株SDMr01与莱氏绿僵菌位于同一进化分支,支持率为100%,与国内莱氏绿僵菌菌株DT2011N7进化关系最近,确定菌株SDMr01的分类地位为绿僵菌属。基于3个蛋白编码基因EF1α、rpb2、β-tubulin 分别构建单基因MP系统发育进化树(图5~7),从图中可以看出3个单基因系统进化树的聚类结果较为一致,但在更细的进化分支中略有不同,基于EF1α的单基因MP系统进化树表明莱氏绿僵菌菌株ARSEF936与ARSEF1972进化关系较近,位于同一个进化分支,而菌株SDMr01位于另外一个独立进化分支。但基于rpb2单基因MP系统发育进化树表明菌株SDMr01与菌株ARSEF1972位于同一个进化分支,亲缘关系较近,菌株ARSEF936则位于独立的进化分支。基于β-tubulin 单基因MP系统发育进化树表明菌株ARSEF1972、ARSEF 936与SDMr01位于同一个进化分支。
2.4 多基因系统发育进化分析
为进一步明确分离菌株SDMr01的分类地位及其系统发育进化关系,分别用BI法和MP法构建了基于EF1α、rpb2、β-tubulin 3个基因的聯合序列进化树(图8、图9),两种算法显示的结果较为一致。从多基因进化树分析可知所选26株绿僵菌可划分为6大分支,即蝗绿僵菌M.acridum分支、白色绿僵菌M.album分支、黄绿绿僵菌新西兰变种M.novozealandicum分支和
莱氏绿僵菌分支4个独立分支,金龟子绿僵菌复合种分支、黄绿绿僵菌复合种分支2个复合种分支,金龟子绿僵菌M.anisopliae、平沙绿僵菌M.pinghaense、罗伯茨绿僵菌M.robertsii、柱状绿僵菌M.lepidiotae、金龟子绿僵菌大孢变种M.majus和贵州绿僵菌M.guizhouense这6个种聚集于金龟子绿僵菌复合种分支,自展值为100;瘿绵蚜绿僵菌M.pemphigi、 黄绿绿僵菌小孢变种M.minus和黄绿绿僵菌M.flavoviride 这3个种聚集于黄绿绿僵菌复合种分支,自展值也为100。分离菌株SDMr01位于莱氏绿僵菌分支,与ARSEF 1972和 ARSEF 936聚集于同一分支,自展值为100。上述分析结果表明,多基因系统进化树分析进化关系比单基因系统进化树更为准确,分支节点自展值较单基因进化树中同一节点高,因而更能准确反映各菌株间的亲缘关系远近。
2.5 菌株致病性
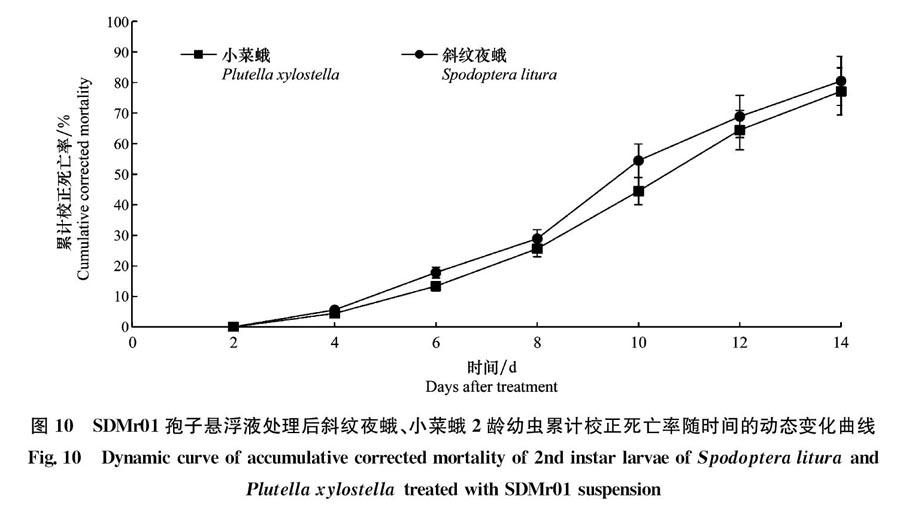
室内致病性测定结果表明,菌株SDMr01对小菜蛾、斜纹夜蛾2龄幼虫均具较强的致病力。卡方检验结果表明,与对照组相比,SDMr01菌株浓度1×108个/mL的孢子悬浮液对斜纹夜蛾和小菜蛾2龄幼虫的致死率均有显著差异(P<005),且对两种昆虫的致死率都是随着时间的增加而增高(图10),接种3 d就有昆虫死亡。接种14 d,小菜蛾、斜纹夜蛾2龄幼虫的累计校正死亡率分别为77.1%、80.5%。但浓度为1×108个/mL的孢子悬液对两种昆虫的致死率无显著差异(P>005)。
3 讨论
莱氏绿僵菌是一种重要的昆虫病原真菌,因分布广泛且能引起田间害虫流行病,所以在有害生物综合治理(IPM)方面有很大的开发和应用潜力[11-12]。国外早在十九世纪七八十年代就进行了该菌的致病性、菌种资源开发及侵染机制等方面的研究。国内自1975年分离到此菌后也开展了大量的研究,唐维媛等[13]测定了来自山东、河南、安徽等地的莱氏绿僵菌(曾用名:莱氏野村菌)对斜纹夜蛾的毒力,并筛选出了毒力较强的菌株。宋章永等[14]优化了菜氏绿僵菌微菌核液体发酵工艺,为其生防制剂的开发应用提供依据。杜广祖等[15]进行了云南莱氏绿僵菌田间自然发生流行动态研究,探索了莱氏绿僵菌田间自然发生流行规律。但莱氏绿僵菌的种属分类地位却经过了多次变动,2014年Kepler等通过多基因系统进化分析,结合绿僵菌属相关近缘属种的形态学特征,提出大部分产绿色孢子的野村菌属中的种均应归至绿僵菌属的观点,认为莱氏野村菌N. rileyi应归于绿僵菌属[16]。
本研究先通过ITS序列初步确定了分离菌株SDMr01的分类地位。然后再通过3个功能基因EF1α、β-tubulin、rpb2 分别构建系统发育进化树进一步确定各菌株的系统发育进化关系,3个基因的系统发育进化分析结果一致,明确了SDMr01为莱氏绿僵菌。但基于EF1α和rpb2 的单基因系统发育进化树中,有些分支的自展值不高。基于β-tubulin基因序列构建的绿僵菌属MP系统进化树,大部分分支节点自展值高于60,准确度最高,因此β-tubulin基因可用于绿僵菌属的遗传关系分析,这一结论与罗卿权等的研究结果一致[17]。
与单基因系统发育进化分析相比,本研究使用的多基因系统发育进化分析,具有更高的分辨力和可信度, BI法和MP法构建的多基因系统发育进化树显示出了高度的一致性,且各分支节点的自展值均较高,除个别分支节点外,自展值均超过85,这表明利用多基因系统发育进化树分析进化关系具有较高的可信度。
本研究通过传统的真菌鉴定方法和多基因系统进化分析方法确定了引起山东临沂地区田间害虫流行病的病原菌为莱氏绿僵菌,室内生防试验验证了其对小菜蛾和斜纹夜蛾的致病力,这对筛选高效、广谱的生物防治菌种具有重要意义。下一步将进行该菌株的田间自然流行病的诱导研究,以期为莱氏绿僵菌SDMr01菌株的开发应用奠定基础。
参考文献
[1] 蒲蛰龙, 李增智.昆虫真菌学[M]. 合肥:安徽科学技术出版社, 1996.
[2] 何恒果, 李正跃, 陈斌, 等.虫生真菌对害虫防治的研究与应用[J].云南农业大学学报, 2004, 19(2): 167-173.
[3] 王清海, 万平平, 黄玉杰, 等.虫生真菌在害虫生物防治中的应用研究[J].山东科学, 2005, 18(4): 37-41.
[4] 曾智, 孙运军, 钱荣华, 等. 我国微生物农药的研究应用现状与前景[J].农业现代化研究, 2008, 29(2): 254-256.
[5] 卢辉, 唐继洪, 吕宝乾, 等.草地贪夜蛾的生物防治及潜在入侵风险[J].热带作物学报, 2019, 40(6): 1237-1244.
[6] KISH L P, SAMSON R A, ALLEN G E. The genus Nomuraea Maublanc [J]. Journal of Invertebrate Pathology, 1974, 24(2):154-158.
[7] TORRES L, COTES A M. Effect of cryopreservacion on the viability and the biocontrol activity of Nomuraea rileyi against Spodoptera frugiperda (Lepidoptera: Noctuidae) [J]. Revista Colombiana De Entomología, 2005, 31(2):133-138.
[8] FRONZA E, SPECHT A, HEINZEN H, et al. Metarhizium (Nomuraea) rileyi as biological control agent [J]. Biocontrol Science & Technology, 2017,27(11):1-22.
[9] 于海勇. 斜纹夜蛾幼虫表皮对莱氏野村菌侵染的防御功能研究[D].重庆:重庆大学,2011.
[10]BISCHOFF J F, HUMBER R R A. A multilocus phylogeny of the Metarhizium anisopliae lineage [J]. Mycologia, 2009, 101(4):512-530.
[11]吕思行, 郑常格, 江敏华, 等.一株昆虫病原性真菌莱氏野村菌的分离与鉴定[J].广东农业科学, 2015, 42(15): 53-56.
[12]AMBETHGAR V. Potential of entomopathogenic fungi in insecticide resistance management (IRM): a review [J]. Journal of Biopesticides, 2009, 2(2): 177-193.
[13]唐维媛, 彭小东, 王欢, 等.不同地域莱氏野村菌的培养性状及对斜纹夜蛾的毒力[J].湖南农业大学学报, 2013, 39(3): 279-281.
[14]宋章永, 殷幼平, 姜伟, 等.莱氏野村菌微菌核一步液体发酵新工艺[J].中国生物防治学报, 2014, 30(5): 660-664.
[15]杜廣祖, 郑亚强, 苏锦尧, 等.云南莱氏野村菌田间自然发生流行动态研究[J].环境昆虫学报, 2018, 40(5): 160-168.
[16]KEPLER R M, HUMBER R A, BISCHOFFJ F, et al. Clarification of generic and species boundaries for Metarhizium and related fungi through multigene phylogenetics [J]. Mycologia, 2014, 106(4):811-829.
[17]罗卿权, 路广亮, 徐颖.一株淡剑灰翅夜蛾病原性真菌莱氏绿僵菌的多基因序列鉴定[J].植物保护学报, 2018, 45(3): 614-621.
(责任编辑:杨明丽)
