外源茉莉酸对菊芋镉胁迫下光合特性及镉积累的影响
2021-10-05王丹媚王孝源任晴雯张丽宇吴玉环
张 云 王丹媚 王孝源 任晴雯 唐 可 张丽宇 吴玉环 刘 鹏,*
1 浙江师范大学化学与生命科学学院, 浙江金华 321004; 2 杭州师范大学生命与环境科学学院, 浙江杭州 310036; 3 中国科学院沈阳应用生态研究所, 辽宁沈阳 110016
镉(Cadmium, Cd)在环境中无法降解, 毒性强易迁移, 是重金属污染的研究热点[1]。随着城市化和工业化发展, 我国遭到破坏的农田已有近2000万公顷,镉污染面积就达56.65%[2]。植物对它的吸收主要依赖其土壤中的存在形态, 南方红壤酸度较低[3], 各类结合态和稳定态的镉易转变为活泼的交换态, 这大大增加了有效态镉的迁移[4]。被污染的农作物一旦随食物链进入人体, 则会严重危害生命健康[5]。现阶段, 生物修复技术存在超富集植物种类有限、生长周期长、生物量小等问题, 在实际应用中无法发挥优势[6]。正因如此, 发掘更多富集型作物以及寻找减轻镉对植物毒害的方法已经刻不容缓。
菊芋(Helianthus tuberosusL.)别名洋姜, 菊科(Compositae)向日葵属(Helianthus)多年生草本植物,具有生长繁殖快、生物量大等特点, 能生存于各种条件苛刻的自然环境[7]。辽宁沿海地区对其大面积种植改良辽南滩涂盐碱土地, 极大增加了土壤利用率; 此外, 当地企业采用深加工解决菊糖供不应求的问题, 积极带动了经济发展[8]。李俊凯等[9]在探究南京市某铅锌矿场内14种优势物种时发现, 它还能吸附镉、铬、铜、锰、铅和锌6种重金属。陈良等[2]也发现, 南芋5号具有较强的土壤镉修复能力。由此可见, 菊芋的开发潜力不可忽视, 其在改善土壤重金属污染问题中应用前景广阔。
茉莉酸(jasmonic acid, JA)是一类植物内源信号物质, 由α-亚麻酸代谢, 具有环状结构[10], 能有效改善生物修复法中作物生长缓慢、产量低、修复周期长的缺点[11]。Ali等[12]在提高油菜(Brassica campestrisL.)镉耐受性时发现, 25 μmol L-1的JA是一种“胁迫改善分子”, 可以减少叶片对镉的吸收,提高胁迫相关抗氧化酶活性, 保护叶绿体免受活性氧(reactive oxygen species, ROS)损伤, 植株光合产物增加, 对抗镉的能力得以增强。目前, 关于菊芋非生物胁迫的研究主要集中在耐盐碱和耐干旱领域,有关其耐镉机制的涉足较少, 且尚未见使用JA缓解镉污染对菊芋幼苗生长毒害的相关报道。基于上述背景, 本研究选用耐镉性差异较大的2个品种菊芋作为试验对象, 设置低、中、高(75、150、300 mg kg-1)3个水平的镉浓度, 模拟土培胁迫, 采用25 μmol L-1的JA作为缓解因子, 探究该浓度JA对不同程度镉处理下菊芋的生长指标、光合特性以及镉积累的影响, 旨在为揭示外源JA提升植物抗镉机制奠定理论基础, 也为种植菊芋修复土壤镉污染提供参考。
1 材料与方法
1.1 试验概况
试验于2018年6月至2020年7月在浙江师范大学生物园和植物学实验室内进行, 前期以河南开封、四川成都、湖北咸宁、山东潍坊、四川资阳、重庆、江西宜春、陕西榆林、江苏徐州、河北保定10个不同地区的菊芋进行筛选, 植株块茎均在生物园内种植1年以上。最终经简单序列重复区间扩增(inter-simple sequence repeat, ISSR)鉴定遗传多样性和耐镉性分析, 选用亲缘关系较远且耐镉差异大的榆林菊芋和成都菊芋作为研究材料, 进行胁迫处理以及叶面喷施JA缓解试验。参照鲍士旦[13]的方法测定供试土壤基本理化性质: pH 5.83, 有机质21.71 g kg-1, 全氮0.64 mg kg-1, 碱解氮26.13 mg kg-1, 速效磷58.47 mg kg-1, 速效钾144.79 mg kg-1, 全镉1.38 mg kg-1, 有效镉0.95 mg kg-1。
1.2 试验设计
2019年8月30日, 挑选大小相似且具有较多芽眼的菊芋块茎, 流水洗净后用蒸馏水冲洗3遍, 采用0.05%的多菌灵进行表面消毒。随后播种于沙盘中, 将环境温度设置为25℃, 光照强度125 μmol m-2s-1, 光暗交替时间为12 h/12 h, 湿度为(60±5)%,待幼苗长至6 cm大小时移栽入花盆进行胁迫试验。设置以下8个处理组: (1) CK组(未加镉); (2) 75Cd组(75 mg kg-1Cd); (3) 150Cd组(150 mg kg-1Cd); (4)300Cd组(300 mg kg-1Cd); (5) JA组(25 μmol L-1JA);(6) 75Cd+JA组(75 mg kg-1Cd+25 μmol L-1JA); (7)150Cd+JA组(150 mg kg-1Cd+25 μmol L-1JA); (8)300Cd+JA组(300 mg kg-1Cd+25 μmol L-1JA)。镉离子的供给采用CdCl2·2.5H2O水溶液形式, 浓度以纯镉计算。将pH调节至4.5, 每盆施加100 mL, 花盆底部流出的液体需倒回盆内。使用25 μmol L-1的JA均匀喷洒叶片正反面, 直至有水珠形成, CK组喷施等量蒸馏水。每组设9个重复, 每盆定植1株菊芋,花盆(内径15 cm, 高10 cm)盛土量为2 kg, 采用南方红壤作为育苗基质, 沙和土的比例为2∶3。每天上午9时每盆喷施JA溶液20 mL, 下午5时浇灌50 mL的1/2 Hongland营养液。胁迫的第7、14和21天测定菊芋的叶绿素含量和气体交换参数, 21 d后测定生长指标、叶绿素荧光参数以及各器官的镉含量。试验所用镉浓度和JA浓度均由文献参考[2,7,10,12]及大量预试验所得。
1.3 测定项目及方法
1.3.1 形态学指标 每个重复随机选取3株菊芋,去离子水洗净后用滤纸将表面水分吸干。采用精度为0.1 cm的直尺测量主根长度, 根茎基部到最高顶部的绝对距离为其株高。选取生长点下3~5片功能叶, 随后使用Li-3000C叶面积仪测定叶面积, 最后再通过ImageJ软件进行分析计算。将植株置于105℃杀青20 min, 随后调节到80℃烘干至质量恒定, 分析秤称量。各项结果以平均值为准。
1.3.2 光合指标 选取幼苗生长点下第3片新叶,利用SPAD-502PLUS叶绿素仪测定其叶绿素的相对含量[14]。上午8:00—11:00光线充足期间, 采用Li-6400便携式光合作用测量仪测定叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)以及蒸腾速率(Tr), 叶室温度设置为25℃, 光照强度1500 μmol m-2s-1, CO2量浓度控制为(400±5) μmol mol-1, 相对湿度为70%左右[15]。植株进行暗处理30 min, 随后使用叶绿素荧光仪PAM-210测定叶片的初始荧光(Fo), PSII有效光化学电子产量(Fv/Fm),光化学猝灭系数qP), 非光化学猝灭系数(qN)以及光合相对电子传递速率(ETR), 每个处理至少选取4个叶片[16]。
1.3.3 镉富集及转移系数 取样后用蒸馏水洗净根、茎、叶, 恒温烘干研磨, 与土壤样品分别过20目筛(20孔/645.16 mm2), 采用HNO3-HClO4(体积比为3∶1)进行湿法消解。各试样经水相针式滤器过滤,使用火焰原子吸收分光光度计进行测定, 最后带入标准曲线计算镉含量, 每个样品重复3次。生物富集率(bioconcentration factor, BCF)=植物组织中Cd含量/土壤中的Cd含量。转移系数(translocation factor, TF)=叶或茎中Cd含量/根中Cd含量[15]。
1.3.4 叶片镉离子分布 将洗净的新鲜叶片浸泡于2 mmol L-1荧光探针(Probe)与有机溶剂DMSO的混合液中30 s, 迅速取出置于激光共聚焦显微镜下成像, 观察镉离子的分布情况[17]。
1.4 数据处理
利用Microsoft Excel 2019整理数据及绘制图表,借助SPSS 22.0进行方差分析和显著性检验(P<0.05),采用最小显著差异法(LSD)进行多重比较, 使用Origin 9.0软件绘图以及Photoshop进行图像调整。
2 结果与分析
2.1 外源JA对菊芋镉胁迫下生长特性的影响
叶面喷施25 μmol L-1JA不仅有利于植株生长,而且对镉胁迫下菊芋各形态学指标的恢复具有促进作用(表1)。无镉条件下, 2个品种菊芋JA组株高出现一定程度增加, 成都菊芋的叶面积和根长显著提升(P<0.05), 其干重为CK组的1.23倍, 榆林菊芋上述指标变化不明显。胁迫组中, 低镉刺激了根系生长; 中高镉组, 成都菊芋株高较对照组下降10.40%和24.45%, 榆林菊芋下降6.03%和15.46%; 两干重均随镉浓度的增大不断减小, 叶面积则呈先升后降趋势。喷施JA后, 成都菊芋的叶面积在中高镉下分别较胁迫组提升15.23%和10.68%; 根长同样为中高镉组缓解效果最佳; 其干重在3个水平下分别为胁迫组的1.21、1.17和1.26倍。榆林菊芋株高虽有所增长, 但未达到显著水平; 叶面积在低中镉组效果明显, 根长则在中镉下改善最突出。说明, 即便在高浓度镉胁迫下, 这2个品种的菊芋仍能存活, 但二者长势严重受损, JA能有效减轻不同程度镉污染对植株的毒害, 并且对耐镉性弱的成都菊芋缓解效果优于耐镉性强的榆林菊芋。
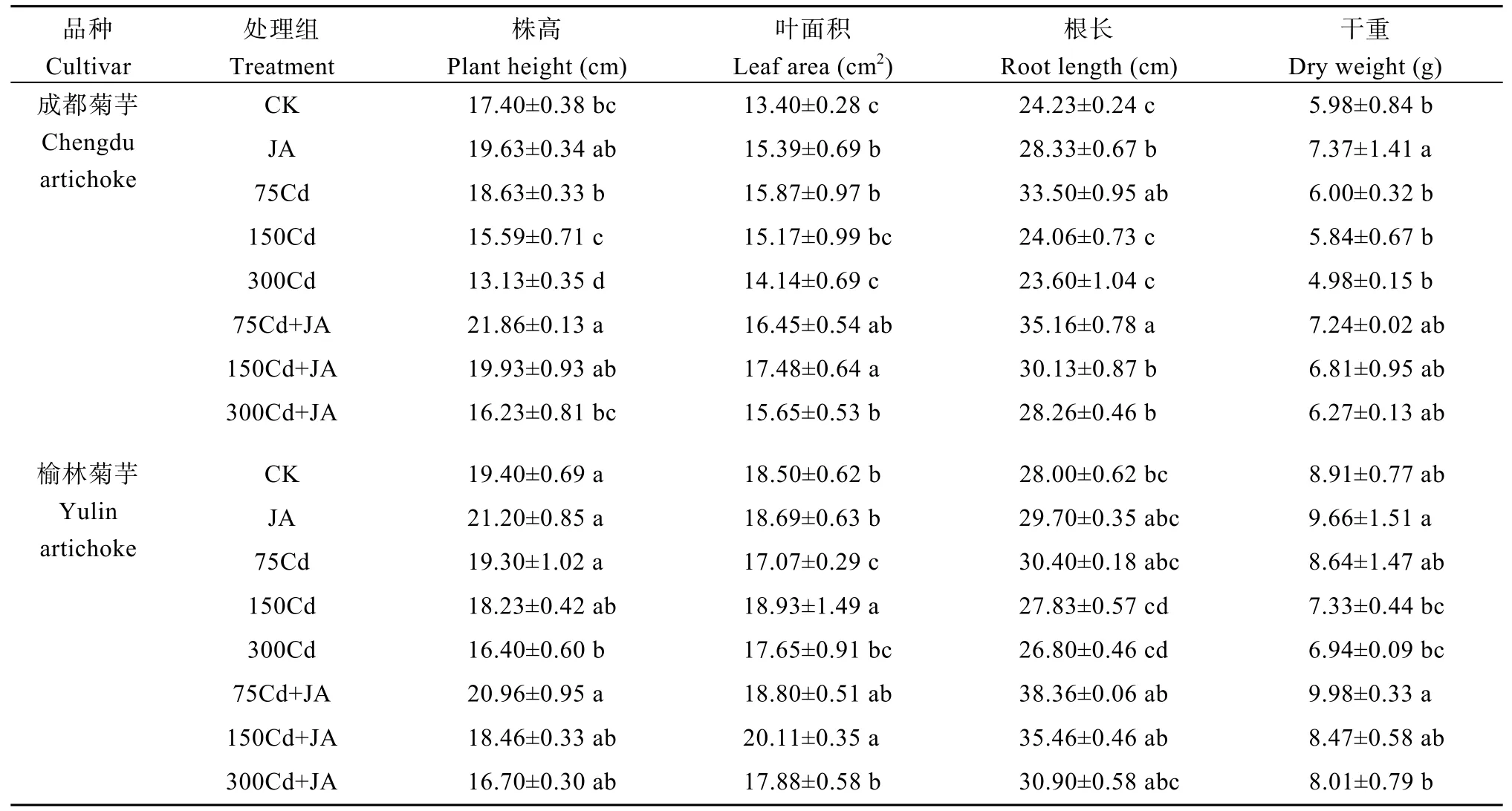
表1 外源JA对镉胁迫下菊芋生长特性的影响Table 1 Effects of exogenous JA on growth characteristics of Helianthus tuberosus L. under cadmium stress
2.2 外源JA对菊芋镉胁迫下叶绿素含量的影响
叶绿素是光合作用的重要场所, 植物光合能力强弱与其含量有着密切联系。由图1可知, 各时间段两菊芋品种JA组的SPAD值明显高于CK组。胁迫处理时, 成都菊芋第7天和第14天的叶绿素含量仅在高镉组下降到显著水平(P<0.05), 分别较对照组减少27.16%和30.37%, 第21天时, 其低中高镉组的SPAD值均大幅降低, 榆林菊芋各组的下降趋势与其一致。JA缓解后, 二者的叶绿素含量持续增加,榆林菊芋在75 mg kg-1Cd+25 μmol L-1JA处理的第7天达到最大值, 为胁迫组的1.27倍, 相同条件下,成都菊芋在第21天才达到最大增长量。表明, 随着镉浓度升高以及胁迫时间延长, 植株叶绿素含量会受到较大影响, 外源JA能有效缓解镉胁迫下叶绿素合成障碍, 并对各时间段3个镉浓度下两品种菊芋的促生效应均较为显著。
2.3 外源JA对菊芋镉胁迫下叶绿素荧光参数的影响
叶绿素荧光参数的变化, 能反映重金属对植物光合生理的抑制程度。由表2可知, JA组2个品种菊芋的初始荧光(Fo)、光化学淬灭系数(qP)以及电子传递速率(ETR)无显著变化(P>0.05)。胁迫组中, 随着镉浓度升高, 二者的PSII最大光化学量子产量(Fv/Fo)显著降低, 并在300Cd组出现最小值; 成都菊芋Fo在低中高镉组分别较对照组增加22.60%、53.11%和91.53%, 榆林菊芋增加13.97%、34.93%和67.25%; 高镉下, 成都菊芋qN(非光化学淬灭系数)为CK组的1.55倍, 榆林菊芋为1.40倍, 且二者qP最低。JA作用后,Fo恢复至正常水平,Fv/Fm及qP大幅回升; 除低镉处理组, 榆林菊芋中高胁迫组的qN持续减小; 成都菊芋ETR在低高浓度镉处理下缓解效果最好, 分别较胁迫组提升16.32%和5.53%。说明, 除Fo和qN与镉浓度呈正比关系, 其余各指标均随胁迫程度的加重不断减小, 外源JA减轻了重金属镉对菊芋光合生理的抑制作用, 且以高镉胁迫下的缓解效应更佳。

表2 外源JA对菊芋镉胁迫下叶绿素荧光参数的影响Table 2 Effects of exogenous JA on chlorophyll fluorescence parameters of Helianthus tuberosus L. under cadmium stress
2.4 外源JA对菊芋镉胁迫下气体交换参数的影响
JA可以促进2个品种菊芋净光合速率(Pn)以及蒸腾速率(Tr)的提升, 并随处理时间的延长不断增大,胞间CO2浓度(Ci)下降不显著(P>0.05), 气孔导度(Gs)未呈现出上升曲线, 推测JA对这2个指标的效能存在一定阈值(图2)。胁迫组Pn在高镉后期出现最小值, 成都菊芋为CK组的58.15%, 榆林菊芋为60.50%; 此外, 榆林菊芋Tr降幅明显小于成都菊芋,说明其耐镉性高于成都菊芋; 二者Ci都随镉浓度的增加表现出先升后降的趋势, 暗示重金属镉对菊芋光合作用的抑制为非气孔限制型。JA缓解后, 成都菊芋Pn除第14天中镉组未达显著水平, 其余各组的缓解效果均较为显著; 榆林菊芋Gs在75 mg kg-1Cd+JA处理的第7天、第14天以及第21天时, 分别为胁迫组的111.82%、121.76%和114.05%; 成都菊芋Ci在后期中镉组减少9.66%, 榆林菊芋处理中后期均为高镉组效果最佳; 两菊芋品种的Tr值在各处理组各时间段的提升效果均较为显著。说明, 镉胁迫减小了2个耐受性不同菊芋的Pn、Gs和Tr值, 而Ci呈上升趋势, 外源JA能有效促进植株的气体交换参数恢复至正常水平。
2.5 外源JA对菊芋生物富集和镉转运的影响
从表3可知, 2个不同菊芋品种各器官镉含量大小为根>叶>茎, 且耐镉性强的榆林菊芋生物富集系数(BCF)明显高于耐镉性弱的成都菊芋。高镉胁迫下, 二者各器官镉含量都达到了峰值, 成都菊芋BCF与土壤镉浓度成正比, 转移系数(TF)变化曲线与榆林菊芋相同, 均呈先增大后减小的趋势; 榆林菊芋各器官镉含量与胁迫程度无直接关联, 其根部表现为先降后升,而叶部与之相反, 茎部则呈持续下降趋势。JA缓解组中, 2个品种菊芋各部位的镉含量持续减少, BCF显著降低(P<0.05)。二者各器官镉含量显著下降, 除茎部外,其余组织的BCF仍大于1, TF小于1。表明, 菊芋的镉吸附能力较强, 且体内的镉多贮存于根部, 外源JA通过减少镉离子的向上转移, 从而减轻光合作用的抑制效应, 以此加强植株对镉毒的耐受能力。
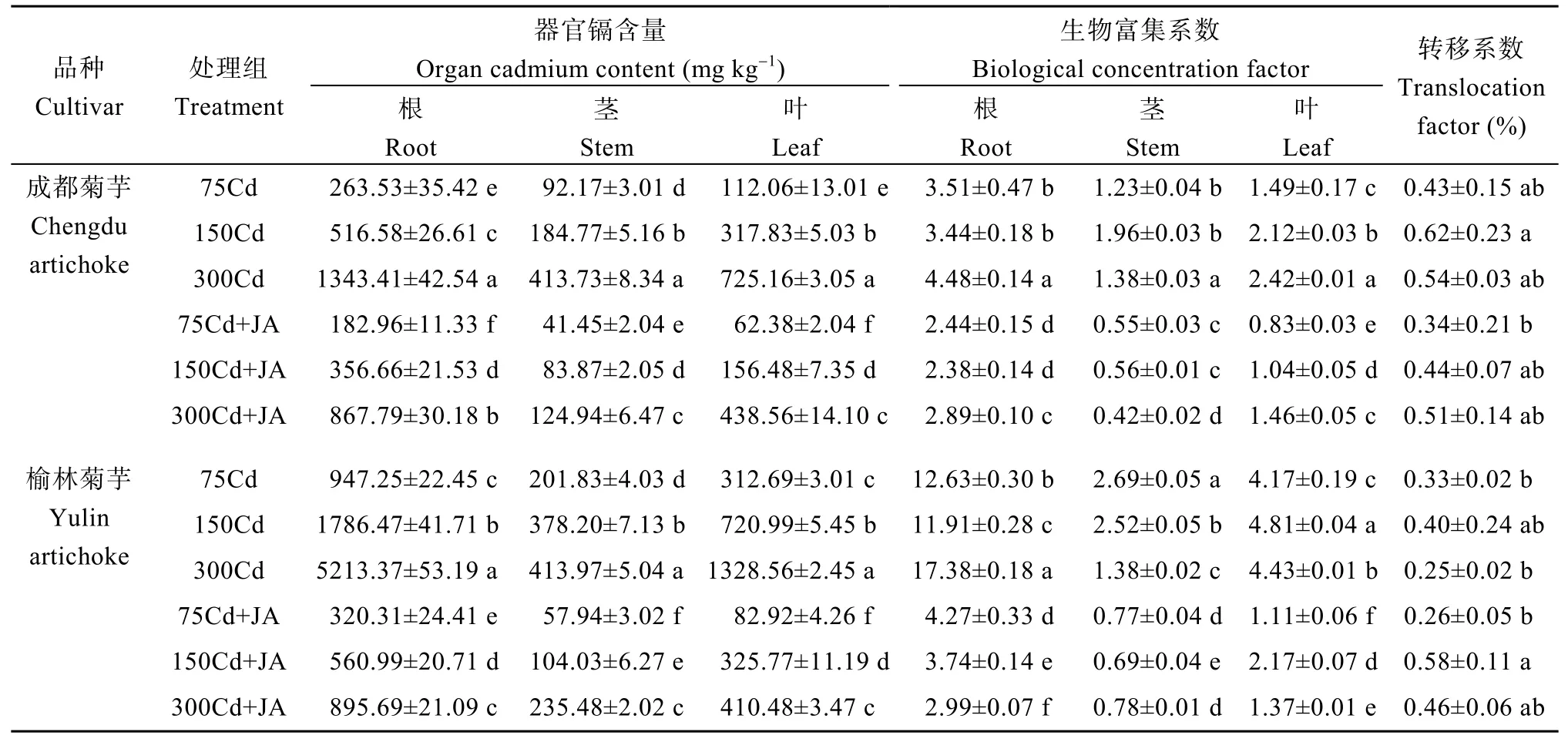
表3 外源JA对菊芋根茎叶中镉含量的影响Table 3 Effect of exogenous JA on cadmium content in root stem and leaves of Helianthus tuberosus L. under cadmium stress
2.6 外源JA对菊芋叶片中镉离子分布的影响
采用荧光探针(probe)能更直观地判断叶片中镉离子的分布情况。从图3可知, 激光共聚焦显微镜下DMSO无法激发出荧光信号, 但溶解于其中的探针可以, 叶片中镉离子激发的荧光在气孔处聚集,并呈现出一定的规律。CK组和单独JA处理组均未出现任何荧光信号; 而胁迫组中, 随着镉浓度升高,气孔周围散发的绿色荧光愈加明显; 此外, 叶片气孔开合度显著减小, 保卫细胞也变得皱缩干瘪。比较2个品种菊芋发现, 不同程度镉胁迫下, 榆林菊芋激发的荧光信号明显强于成都菊芋; 喷施JA后,二者叶片中镉离子激发的荧光信号逐渐向保卫细胞中扩散, 并在胞内形成星星点点的光斑; 与此同时,气孔开合度有了一定程度的增大, 保卫细胞也恢复到充盈状态。综上, 镉离子随着蒸腾作用大量积聚在气孔处, 这不仅限制了保卫细胞的开合, 还严重影响了植株的气体交换, JA信号减少了根系对镉的吸收, 减轻镉毒胁迫。
3 讨论
3.1 JA对镉胁迫下菊芋生长特性的影响
植株生长特性受多种因素影响, 是评价环境质量和重金属胁迫的关键指征。镉污染危害巨大, 根系将其转运至叶肉细胞, 导致叶绿体受损, 叶绿素合成障碍, 气孔开放减小, 光合作用随之减弱, 植株表现为失绿发黄, 生物量和生产量严重降低[18]。菊芋生长快, 生物量大, 在土壤修复中具有广阔前景[9]。本研究2个品种菊芋在300 mg kg-1重镉污染下仍能存活, 但株高、根长、叶面积和干重均随胁迫程度的加重不断下降, 高会玲等[7]同样发现镉胁迫下南芋2号和南芋5号生长受限。本试验中, 低镉组榆林菊芋的根长较CK组增长8.57%, 成都菊芋增长38.26%, 蒋汉明等[19]也论述了低镉刺激互花米草(Spartina alternifloraLoisel.)、小麦(Triticum aestivumL.)、小白菜(Brassica chinensisL.)等根系的生长。随着镉浓度增加, 二者的叶面积呈先升后降趋势, 说明在一定范围内, 植株通过增大叶面积维持光合产物供给, 但胁迫加剧会超出植株生理可调节范围, 这也许是该指标后期下降的原因[20]。喷施25 μmol L-1JA后, 成都菊芋的株高在低镉组达到峰值,为CK组的1.26倍, 榆林菊芋变化不显著(P>0.05)。二者的根长、叶面积和干重均以耐镉性弱的成都菊芋缓解效果更突出。综上, JA可以通过增大叶面积增加光合产物积累, 维持根系生长确保水分和营养物质供给, 从而增强菊芋耐镉性, 但品种间的效果存在差异。
3.2 JA对镉胁迫下菊芋叶绿素及光合特性的影响
叶绿素是光合作用的重要色素, 其含量高低反映了叶片对光的吸收和转化能力[21]。本试验中, 镉抑制了菊芋叶绿素合成, JA缓解后SPAD值大幅提升, 榆林菊芋低镉组第7天达到最大值, 为胁迫组的1.27倍, 成都菊芋第21天才达到峰值。根据郑黎明等[20]对镉胁迫下荻叶绿素合成受阻的论述, 分析这是因为不同品种对JA信号的响应存在差异, 诱导叶绿素合成相关酶的时间不同。通常植株的Fv/Fm较为恒定, 而逆境下显著减小[22]。随着镉浓度升高,该值和qP减小,Fo和qN增大, ETR先升后降, 刘星星[23]在镉胁迫下菊芋的生理响应中也有相似发现。可见, 高镉抑制了叶片对光的捕获能力, 电子传递受阻, 光能无法转换, 植株以热能形式耗散剩余能量以防光损伤。喷施JA后, 两品种菊芋的Fv/Fm及ETR明显增大,Fo和qN恢复至CK组水平, 推测JA保护了类囊体膜的完整性, 电子传递速率加快, 促进了光化学转化效率, 这为暗反应的光合碳同化积累更多物质能量, NADPH减少, 避免了超氧阴离子造成的器官损害[24]。由此可知, JA可能直接或间接地参与了菊芋叶片对光能的吸收、转化和传递, 而其对NADPH/NADP+的比例以及光合碳同化的影响还需更深入的研究。
3.3 JA对镉胁迫下菊芋气体交换的影响
胞间CO2是植物光合碳同化的物质来源, 气体交换参数也是评价光合作用的重要指标。本试验中,2个品种菊芋胁迫组的Gs及Tr较CK组明显减小,Pn在高镉后期出现最低值, 成都菊芋为CK组的58.15%, 榆林菊芋为60.50%, 说明叶片单位面积光合同化能力受损, 这与叶绿素含量下降、光摄取能力以及电子传递速率减弱等结果对应。Gs减小会导致CO2供应不足, 造成光合速率减慢。成都菊芋胁迫组的Gs大幅下降, 榆林菊芋各处理组虽不断减小,但未达显著水平。二者的Ci并未随气孔导度的下降出现趋同变化, 判断镉对菊芋光合作用的抑制是由非气孔因素造成, 陈良等[2]和高会玲等[7]对菊芋耐镉性的研究也证实了这一点。研究表明, 外源JA能有效减轻镉胁迫下水稻(Oryza sativaL.)[25]、玉米(Zea maysL.)[26]的光损伤。本试验以叶面喷施25 μmol L-1JA的方式对镉胁迫下的菊芋进行处理, 结果显示各品种菊芋的Pn、Gs以及Tr逐渐升高, 而Ci明显下降(图2), 表明叶片的气体扩散阻力减小, 蒸腾速率增快, 胞间CO2浓度随之降低, 植株的光合碳同化能力得以恢复。麻云霞等[27]在H2O2对酸枣幼苗镉胁迫下生长及生理特性的相关研究中得出,Ci下降可能是H2O2通过调节光合碳同化关键酶活性,保证CO2的稳定和运输, 从而减少胞间CO2所占的份额, 推测JA对菊芋也存在类似的作用。
3.4 JA对菊芋镉积累的影响
应用富集型植物解决土壤镉污染是生态保护的关键, 植株耐受性决定了体内的重金属含量。龙葵(Solanum nigrumL.)、马兰(Kalimeris indica(L.) Sch.Bip.)、鬼针草(Bidens pilosaL.)对镉的吸收存在差异,这是它们的遗传特性所致[28]。选取耐镉性不同且亲缘关系较远的2个品种菊芋作为试验对象, 结果具有代表性。二者各器官镉含量大小为根>叶>茎, 猜测根部细胞壁固定限制了镉离子迁移, 蒸腾作用减弱, 木质部的运输量减少, 进而减轻地上部损伤[29]。方继宇等[30]在马缨丹(Lantana camaraL.)镉胁迫下的生长响应中发现, 植株地上部的镉主要储存于茎内, 叶片中的含量相对较低。李志贤等[14]观察龙葵地上部的镉聚集在叶片, 本试验菊芋地上部镉富集的器官同样为叶片。喷施JA后, 2个品种菊芋的镉含量降低, BCF和TF明显减小, Lei等[31]证实JA能使拟南芥地上部和地下部的镉含量减少。激光共聚焦显微观察可知, 镉离子主要聚集在保卫细胞周围,气孔开合受限, 这与镉对菊芋光合作用的抑制属于非气孔限制型契合, 暗示镉离子可能通过质外体或共质体途径向上转移。JA缓解后, 明显看到气孔处的荧光信号减弱, 保卫细胞恢复饱满, 植株镉富集和转移系数下降,Gs和Tr有所回升。推测外源JA一方面促进了根尖细胞分泌有机酸, 络合游离镉离子,减少植株对镉的吸收和转移, 另一方面也可能是JA信号调控了离子通道蛋白以及气孔的开合, 镉离子被转运至胞内, 通过液泡区室化等作用进行解毒,具体机制还需进一步的研究加以验证。
4 结论
高镉污染下, 菊芋生长受限, 喷施25 μmol L-1JA增强了植株抗镉性。榆林菊芋的叶绿素含量在低镉组第7天最大, 成都菊芋第21天才达到峰值, 推测它们对JA信号的响应存在差异, 适当地延长处理时间, 对耐镉性较弱的菊芋具有一定意义。二者的叶绿素荧光参数、气体交换参数显著提升(P<0.05),各器官镉含量大小为根>叶>茎, 除茎部外其余组织BCF均大于1, TF小于1。气孔周围的荧光信号减弱,保卫细胞恢复充盈。综上, 25 μmol L-1的JA能减少菊芋对镉的吸收和转运, 减轻气体交换以及光合速率的抑制, 并对耐镉性差异较大的两个品种菊芋低中高镉污染下各具有一定作用。
