花生全基因组抗病基因鉴定及其对青枯菌侵染的响应分析
2021-10-05罗怀勇李威涛郭建斌陈伟刚周小静晏立英廖伯寿姜慧芳
张 欢 罗怀勇 李威涛 郭建斌 陈伟刚 周小静 黄 莉 刘 念 晏立英 雷 永 廖伯寿 姜慧芳
中国农业科学院油料作物研究所 / 农业农村部油料作物生物学与遗传育种重点实验室, 湖北武汉 430062
植物抵抗外界微生物刺激而形成的系统称为植物固有免疫系统, 可分为2个层次。第1个层次是植物模式识别受体(pattern-recognition receptors,P R R S)识别病原相关的分子模式(p a t h o g e nassociated molecular patterns, PAMPs)触发免疫反应(PAMP-triggered immunity, PTI); 第2个层次是病原菌产生效应物抑制对PTI的基本免疫反应, 而植物抗病基因(resistance gene,Rgene)通过编码靶向抗性蛋白直接或间接识别病原菌, 进而诱导效应器触发免疫(effector-triggered immunity, ETI)重建植物的抗性[1-2]。
目前植物中已经克隆了150多个抗病基因[3], 编码的蛋白质具有共同的结构域, 如卷曲螺旋(coiled coil, CC)、核苷酸结合区(nucleotide binding site,NBS)、Toll-白细胞介素区(toll-interleukin-1 receptor,TIR)、富含亮氨酸重复区(leucine-rich repeat, LRR)、激酶结构域(kinase, KIN) 和跨膜结构域(transmembrane domain, TM)。胞质NBS-LRR基因分为2类:TNL (TIR-NBS-LRR)和CNL (CC-NBS-LRR), 分别拥有TIR或CC结构域[4]。如过表达TNL型抗病基因GmKR3增强大豆对多种病毒的抗性[5], 棉花GhTNL1抗病基因的表达减缓植物叶片黄化、萎蔫现象[6], 番茄CNL型抗细菌性斑点病基因SlNBRP1过表达增加其植株抗病性[7], 水稻中NL型Pi9抗病基因组成型表达抗稻瘟病[8]。包含Kinase和LRR结构域的跨膜受体蛋白, 如受体样蛋白(RLP)和受体样激酶(RLK)也参与其中。RLK型基因SlDALR1正调控番茄对Pst DC3000的抗性[9], RLP型基因TaRLP1.1参与小麦对小麦锈病的防御反应[10]。
花生是世界上重要的油料和经济作物, 广泛种植于热带和亚热带地区。中国是世界最大的花生生产国, 也是最大的花生消费国。据国家统计局统计,2019年中国花生产量1751.96万吨, 占世界产量近40%。青枯病是我国花生的主要病害之一, 是由茄科雷尔式菌侵染引起的一种细菌性土传病害, 由于防治困难, 严重影响我国花生的品质和产量[11]。培育和种植抗青枯病花生品种是防治青枯病危害最为经济有效的途径。目前, 已获得的抗青枯病基因有: 拟南芥抗青枯病基因RRS1和ERECTA[12-13], 辣椒抗青枯病基因CaLRR-RLK1和CaLRR51[14-15], 花生中参与青枯病响应的基因AhRLK1和AhRRS5[16-17], 对于花生抗病基因的获得还需要开展更多的研究。
四倍体花生全基因组测序已在2019年完成[18-19],为在全基因组水平研究花生抗病基因提供便利。目前尚没有关于花生全基因组抗病基因鉴定的相关研究, 本研究利用生物信息学分析鉴定了花生全基因组抗病基因数量及染色体分布, 结合抗、感病品种接种青枯病菌后转录组分析, 鉴定了与青枯病抗性有关的差异表达抗病基因, 旨在为克隆花生抗病基因以及抗病分子育种奠定基础。
1 材料与方法
1.1 花生材料和青枯病菌株
花生抗病品种远杂9102和感病品种徐州68-4由中国农业科学院油料作物研究所花生遗传育种团队提供。青枯病菌为茄科雷尔式菌(Ralstonia solanacearum)生理小种1, 生化型III, 分离自红安病害苗圃试验基地[20]。
1.2 R基因的筛选和分类
根据植物抗病基因数据库(PRGdb; http://prgdb.org/), 利用基因所包含的保守结构域CC、TIR、NBS、LRR、TM和Kinase对花生全基因组进行抗病基因的筛选和分类, 将抗病候选基因分为CK、CT、CL、CLK、CN、CNL、CNT、CTNL、T、TN、TNL、TRAN、L、N、NL、KIN、RLK、RLP共18个类别。
1.3 染色体分布
从花生数据库(https://www.peanutbase.org/)下载花生品种Tifrunner基因组1.0版本, 利用软件TBtools提取抗病候选基因的染色体位置信息,MapChart软件绘制出抗病候选基因在染色体上的分布图。
1.4 花生材料接种青枯病菌和取样
参照Chen等[21]使用的方法进行青枯菌培养、花生幼苗培养及接种。接种后12、24、48、72、96 h分别对花生主根部位取样, 处理组标记为RT12/ST12、RT24/ST24、RT48/ST48、RT72/ST72和RT96/ST96, 对照组标记为RC12/SC12、RC24/SC24、RC48/SC48、RC72/SC72和RC96/SC96。试验设3次重复, 样品立即冷冻于液氮中, 并在–80℃下保存。由武汉菲沙基因信息有限公司完成转录组测序。
利用RSEM[22], 调用Bowtie2软件的比对结果进行统计, 得到每个样品比对到每个转录本上的Reads数目, 并对其进行FPKM[23](Fragments Per Kilobase per Million bases)转换。根据抗感材料对照组和处理组(RC/RT/SC/ST)各时间点的3个生物学重复FPKM均值大于1, 将抗病基因的表达情况分为抗感病材料中均表达、仅在抗病材料中表达、仅在感病材料中表达、抗感病材料中均不表达4类。使用DESeq2[24]对5个时间点RT-vs-RC、RT-vs-ST和RT-vs-SC三个组分别进行差异表达分析, 筛选阈值为FDR (false discovery rate) < 0.05, log2FC (fold change (condition 2/condition 1) for a gene) >1或log2FC < –1。使用TBtools对RT-vs-RC、RT-vs-ST和RT-vs-SC 3个组差异表达上调的R基因各个时间点作韦恩分析, 筛选出的差异表达基因使用Microsoft Excel作折线图和RStudio[25]制作热图。
1.5 抗病基因qRT-PCR分析
以RNA-seq测序的根组织RNA为模板, 采用诺唯赞HiScript II Q RT SuperMix for qPCR试剂盒, 反转录合成cDNA。用Primer 5.0软件设计引物, 采用诺唯赞ChamQ Universal SYBR qPCR Master Mix试剂盒进行qRT-PCR试验, 反应体系(20 μL)包含2×ChamQ Universal SYBR qPCR Master Mix 10 μL、上下游引物(10 μmol L–1) 各0.4 μL、cDNA 2 μL、ddH2O 7.2 μL。反应程序为95℃预变性30 s, 95℃变性10 s, 60℃退火30 s, 72°C延伸20 s, 40个循环。每个反应进行3次重复, 花生内参基因Actin的引物为actin-F: 5′-TAAGAACAATGTTGCCATACAGA-3′,actin-R: 5′-GTTGCCTTGGATTATGAGC-3′。按 照2−ΔΔCT计算基因相对表达量。
2 结果与分析
2.1 花生R基因的鉴定和染色体分布
在花生Tifrunner参考基因组[18]中共筛选得到4156个抗病候选基因, 分为TNL、CNL、RLK、RLP等18个类别(表1)。在典型的5类抗病基因中, 基因数目较多的是RLK型(536个)和RLP型(490个), 占总抗病候选基因数目的12.90%和11.79%, 其次是NL型(232个)和CNL类抗病基因(182个), 占抗病候选基因总数的5.58%和4.38%, TNL型抗病基因(149个)占抗病候选基因总数的3.59%。非典型的13个抗病类型中, 仅含Kinase保守结构域的KIN型抗病候选基因数目为1714个, 占总抗病候选基因数目的41.24%; 其余12个类别候选基因含有NBS/CC/TIR/TM/LRR/Kinase等保守结构域的不同组合形式, 占比0.05%~5.32%,共853个。抗病候选基因分布于花生20条染色体上(图1), 在染色体B02上的抗病基因数量最多, 为334个, A01和A06上抗病基因数量最少, 为137个。
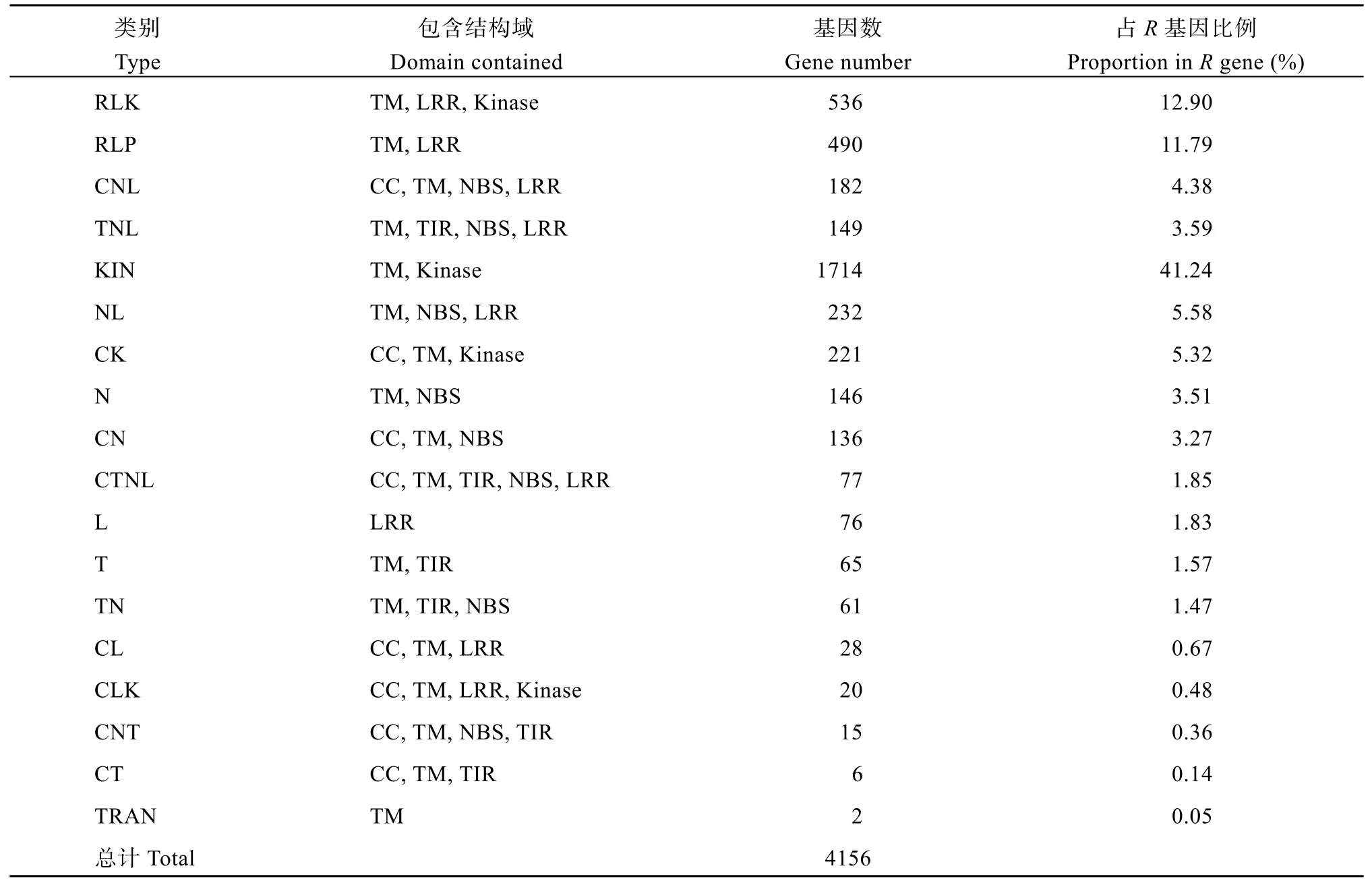
表1 花生R基因的数量和分类Table 1 Number and type of R genes in peanut
2.2 抗病候选基因对青枯病侵染的响应
在接种青枯菌后5个时间点中, 抗病材料远杂9102对照组(RC)共2383个抗病候选基因表达, 处理组(RT)有2337个表达; 在感病材料徐州68-4对照组(SC)共2304个候选基因表达, 处理组(ST)有2325个表达。抗感材料中表达的抗病候选基因数目基本一致。抗病材料(RC+RT)中特异表达的基因有111个,感病材料(SC+ST)中特异表达的有104个, 抗病、感病材料均有表达的基因2216个, 抗、感病材料中均不表达的有1725个。根据FPKM值将所有抗病基因分为5组(图2), 从图2可看出, FPKM值在1~5的抗病候选基因数量最多, 占总表达基因数目的42.6%~46.8%; FPKM值在50以上最少, 基因数量在1.8%~2.3%, 植物体内大部分的抗病基因转录水平较低。
2.3 差异表达R基因的鉴定
在接种青枯菌12 h的样品中, 通过对RT12-vs-RC12、RT12-vs-ST12和RT12-vs-SC12 3个组差异表达基因的分析, 鉴定出2类差异表达R基因: 第1类是3个在抗病材料接种青枯菌后诱导表达的基因,在RT12的表达量显著高于RC12、ST12和SC12, 推测其受到青枯菌侵染的诱导表达(图3-a~c); 第2类是33个在抗病材料中持续上调表达的差异基因, 在RT12和RC12中的表达量差异不显著, 但是显著高于ST12和SC12 (图3-f)。通过类似的方法, 在接种青枯菌24、48、72和96 h后, 鉴定到第1类差异表达R基因分别有1、0、1和0个(图3-d, e); 第2类差异表达R基因有42、41、39和28个, 在抗病材料中差异不显著, 但显著高于感病材料(图3-g~j)。
综合所有时间点, 第1类差异表达R基因只在对应的时间点特异上调表达。但是在第2类差异上调的65个抗病候选基因中, 有27个R基因在4个时间点及以上差异表达, 在5个时间点连续差异上调表达的R基因11个, 有9个R基因在12~72 h连续差异上调表达, 3个R基因在24~96 h连续差异上调表达, 在12、24、72、96 h差异上调表达的R基因2个, 在12、24、48、96 h差异上调表达1个, 12、48、72、96 h差异上调表达1个(图3-k)。
2.4 抗青枯病QTL区间候选基因表达差异分析及qRT-PCR验证
前期在远杂9102和徐州68-4构建的RIL群体中, 通过QTL分析鉴定到1个主效抗青枯病QTLqBWRB02.1[26]。通过对其候选区间分子标记的比对发现, 该QTL位于Tifrunner B02染色体4.05~6.12 Mb区间内, 该区间包含13个抗病候选基因, 其中6个候选基因在接种青枯菌后表达, 7个不表达。在表达的6个基因中, 有3个包含在上述鉴定到的第2类差异表达基因中, 其表达情况如图4-a所示。针对Arahy.5D95TJ设计了特异荧光定量引物, F:5′-TGCAAGGTACAATAAGGAGACAGG-3′, R: 5′-AATACTAGCCTCCAATAAGCATCC-3′。qRT-PCR结果显示该基因的表达趋势(图4-b)与转录组测序结果(图4-c)基本一致。
3 讨论
抗病基因在植物抵抗细菌、真菌、病毒等病原体过程具有非常重要的作用[27]。本研究根据保守结构域在花生参考基因组中鉴定出4156个抗病候选基因, 将其分为18类抗病分型。豆科植物木豆、菜豆、大豆中分别鉴定到289、337和465个NBS-LRR类抗病基因[28], 各占全基因组基因数目的0.5%、1.1%和1.9%[29-31]。本研究发现, 典型抗病基因NBS-LRR类641个, 占花生全基因组数目的0.8%, 推测抗病基因数目与基因组大小没有直接的联系。
单子叶植物谷子、玉米、水稻各有NBS-LRR类家族基因数目为411、21和545个, 但是没有发现TNL型抗病基因[32-34]。在双子叶植物三裂叶薯、黑籽南瓜、番茄、葡萄、鹰嘴豆中CNL型抗病基因数目大于TNL型[35-39], 而向日葵、大豆、拟南芥等植物中TNL型抗病基因数目大于CNL型[40-42], 本研究鉴定出花生抗病基因CNL型182个, TNL型149个(CNL/TNL约1.2倍), 这说明双子叶植物中CNL型和TNL型抗病基因可能有不同的进化模式。
在植物中, RLK和RLP富含植物激素信号和植物病原菌互作途径[43], RLK类抗病基因作为胁迫表达相关基因的一部分参与植物体应答逆境和与防御相关的过程[44], 在4种棉属植物中鉴定出1641个RLK基因[45], 在马铃薯、萝卜、苜蓿和二穗短柄草中分别鉴定出479个[46]、292个[47]、329个[48]和268个[49]PLK基因, 本研究在花生全基因组中筛选鉴定得到RLK型抗病基因536个。总共有82个RLP基因在杨树基因组中被鉴别出来[50], 在普通烟草中共鉴定出70个RLP基因[51], 本研究在花生全基因组中筛选鉴定得到RLP型490个, 这些基因可能参与应答青枯菌诱导的防御反应。
抗病基因在染色体上的分布不均匀。如NBS-LRR类抗病基因在甘薯13号染色体有54个而11号染色体仅有3个[52]; 同样的, 番茄中NBS类抗病基因在4号染色体所含数目最多[37]。花生为杂交起源的异源四倍体作物, 包含来自2个祖先物种的全部染色体组, 抗病基因在B组染色体上数目大于A组染色体, 并且花生染色体B02上抗病基因数目最多。
已有研究表明, 花生中AhRRS5[16]和AhRLK1[17]基因在烟草中过表达显著增加了对青枯菌的抗性, 分别下载CDS序列并比对到花生Tifrunner参考基因组[18], 结果显示最高同源序列为染色体B05上Arahy.WIN0ZV基因和A03上Arahy.8BA7G9基因,将其鉴定为CNL型和RLK型抗病基因。本研究筛选到2类差异表达的抗病候选基因, 第1类是5个在抗病材料接种青枯菌后差异表达高于抗病对照以及感病材料, 推测这些基因是受到青枯菌诱导后上调表达, 初步判定与花生的抗青枯病特性相关; 第2类, 有65个在抗病材料中持续上调表达的差异基因,这一类基因在接种青枯菌前后, 抗病材料远杂9102中的表达量始终高于感病材料徐州68-4, 其中有27个抗病候选基因在4个时间点以上连续差异上调表达。这2类差异表达基因含11种抗病类别, 基因数目从多到少为NL (14)、N (9)、KIN (8)、RLP (7)、CN (7)、CTNL (6)、RLK (4)、CNL (4)、CK (4)、TNL (2)和TN (2)。本研究还验证了花生青枯病QTL区间的抗病候选基因Arahy.5D95TJ属于第2类持续上调表达抗病基因N型, 在抗病材料远杂9102中4个时间点连续表达。通过Interproscan分析发现, 该基因可能包含与已克隆抗病基因不同的CC和LRR结构域,推测Arahy.5D95TJ可能与AhRRS5具有相同的靶向位点, 通过相同或相似的信号通路来参与对青枯菌的防御反应。本研究结果可为开展花生青枯病抗病基因的克隆和功能验证, 以及解析花生响应青枯菌胁迫的抗性应答机制提供参考。
4 结论
发掘候选抗病基因4156个, 在染色体上呈不均匀分布; 得到差异表达的5个响应青枯菌诱导型和65个持续上调表达抗病候选基因, 验证了一个持续上调表达抗病候选基因Arahy.5D95TJ。研究结果可为花生抗病基因的克隆、鉴定及其抗病育种奠定基础。
