大豆种子颜色遗传调控机制研究进展
2021-10-05邱红梅侯云龙王新风马晓萍崔正果胡金海王跃强邱丽娟
邱红梅 陈 亮 侯云龙 王新风 陈 健 马晓萍 崔正果 张 玲 胡金海 王跃强,* 邱丽娟
1 吉林省农业科学院 / 大豆国家工程研究中心, 吉林长春 130033; 2 中国农业科学院作物科学研究所 / 农作物基因资源与遗传改良国家重大科学工程, 北京 100081
大豆种皮色是基本的生物学性状, 也是重要的农艺性状, 可用来描述品种特性, 同时也是一种进化性状[1]。野生大豆一般为黑色种皮, 当前大豆品种多为黄色种皮[2]。在进化过程中, 大豆种皮从黑色逐渐演变成黄、绿、褐、双色[3]。每种颜色类型按深浅的不同又可细分若干种, 如黄色种皮有白黄、淡黄、浓黄、暗黄等。绿色种皮有淡绿、绿、深绿, 统称为青豆[4]。褐色种皮有茶色、淡褐、褐、深褐及红褐等。双色种皮分为虎斑和鞍挂2种, 底色一般为黄、褐或绿, 虎斑是种皮上有如老虎的条纹, 鞍挂是种脐两侧有如马鞍状的色斑[5-6]。大豆种皮色多样性高, 表型易于观察, 是大豆中较早开展遗传研究的性状之一[7]。1910年, Piper和Morss[8]首次报道大豆种皮色在杂交子代有分离现象, 但并未明确其遗传规律。1918年, Terao[9]报道子叶颜色与黄、绿种皮色的遗传关系。1928年, Owen[10]报道了黑色种皮与棕色茸毛位点连锁。
迄今, 种皮色从经典遗传到分子标记再到功能基因等研究都取得了显著进展[11-12]。此外, 由于黑豆的保健功能, 种皮中化学物质构成也备受关注[13]。研究表明, 深色种皮中主要含有花色苷和原花青素,二者的组成比例和分布决定了种皮的着色程度[14]。花色苷属多酚类化合物, 来源类黄酮生物合成途径,具有酚羟基结构。它对活性氧等自由基具有很强的捕捉能力, 因此抗氧化能力强, 具有药用价值。青豆种皮中主要含有叶绿素, 叶绿素含量决定了绿色程度[15]。控制绿色种皮的基因存在于野生大豆中, 属于古基因, 但野生大豆种皮的花色苷含量更高, 使种皮显现黑色。大豆经驯化后, 黄种皮的以食用为主; 黑豆列入中药名录, 常入中药[16-18]。随着人们生活水平的提高和健康意识的加强, 黑豆和青豆也逐渐受到市场欢迎[19]。鉴于种皮色、子叶色与外观品质及内在营养价值密切相关, 本文归纳了控制大豆种子颜色的遗传位点、相关基因与调控机制、类黄酮生物合成途径三方面的研究进展, 以期总结大豆种子颜色的遗传调控机制, 为种子外观品质及营养组分遗传改良等研究提供参考。
在已发表的综述中, 总结了控制大豆种皮色的5个经典遗传位点与基因的相关研究进展[20]。本综述汇总了控制大豆种子颜色的9个经典遗传位点,并将位点-基因-等位基因的调控机制关联起来, 从点到线绘制了种子颜色的调控机制。此外将调控种皮色的相关基因与主要显色物质类黄酮代谢途径相结合, 又从代谢通路绘制了花色苷含量的遗传调控途径, 最终以基因为节点, 将遗传位点与代谢产物关联起来, 绘制出大豆种子颜色遗传调控网路。
1 控制大豆种子颜色的遗传位点
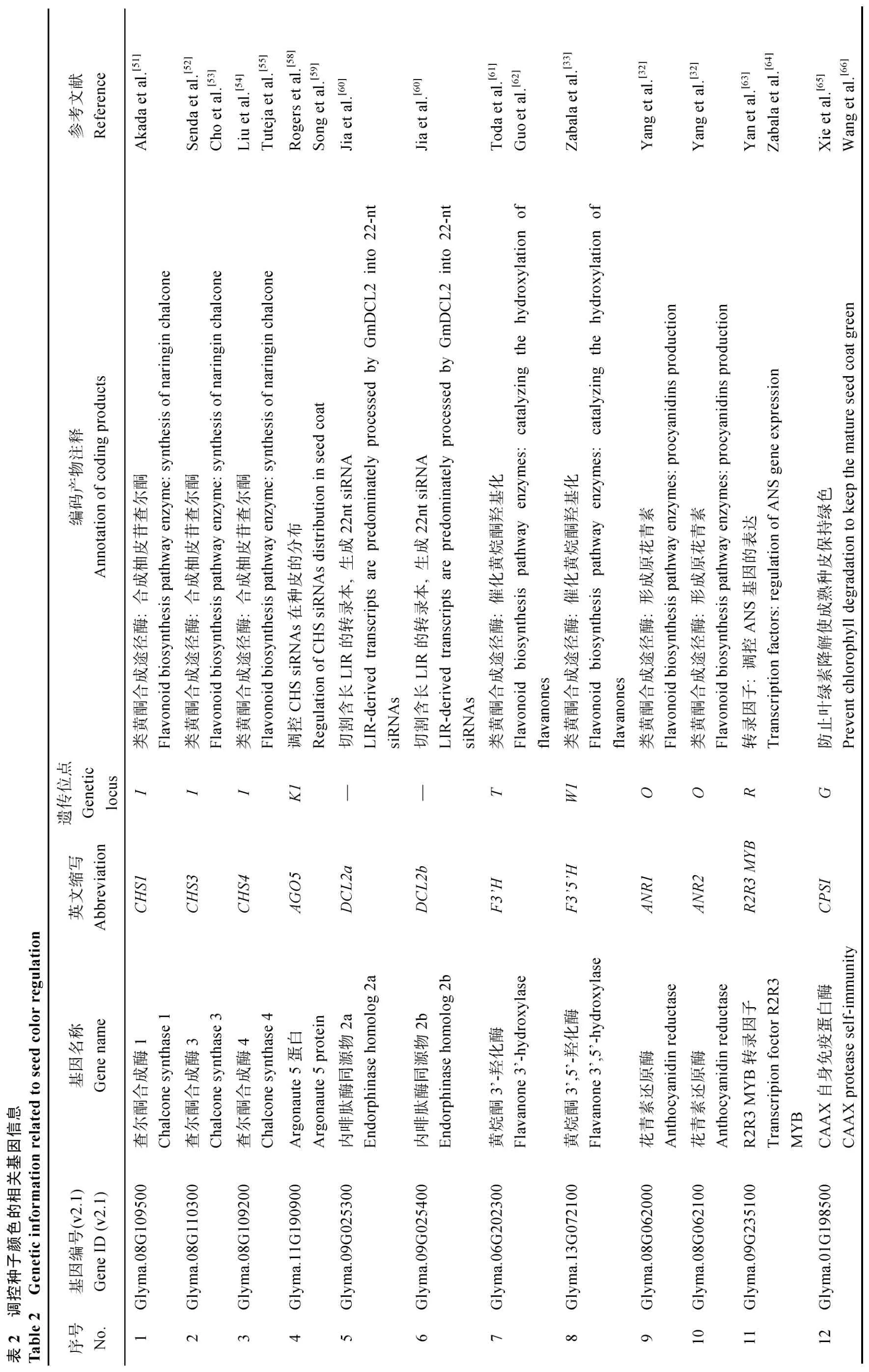
大豆种皮色类型多样, 子叶颜色也有黄绿之分,利用经典遗传学方法, 明确了9个遗传位点I、R、T、O、W1、K1、G、D1、D2, 分别位于8、9、6、8、13、11、1、1与11号染色体上(表1)[12,21-22]。此外, 还发现一个细胞质遗传位点CytG, 位于叶绿体内[9,23]。其中I和O位于同一染色体上, 但不存在连锁关系;G和D1位点连锁, 其他位点分属于不同染色体。这些位点间存在着相互作用, 遗传基础复杂[24-25]。I、R、T为控制种皮色的主效位点,I位点决定种皮是否含有花色素[26]。据报道I位点有4个等位基因, 分别为I、ii、ik、i, 显性关系顺序为I>ii>ik>i[27]。I基因型时, 种皮呈黄色, 我国北方育成品种多为该基因型。ii基因型时, 为黄种皮黑脐。ik基因型时, 种脐色素向外延伸至鞍区, 种皮为鞍挂(图1-c)。i基因型时,种皮含有花色素, 呈现黑或褐种皮[28]。R位点有4个等位基因, 分别为R、R*、r、rm, 在i基因型背景下, 种皮分别显现黑色、黑色、褐色、虎斑(图1-d~f),显性关系顺序为R>R*>rm>r[29]。T位点主要控制茸毛着色, 同时调控种皮的着色程度, 含有3个等位基因, 分别为T、t、tm, 表型分别为深褐种皮、棕色茸毛和浅褐种皮、灰色茸毛, 及同一株同时存在棕色和灰色茸毛、深褐和褐色种皮[30-31]。I、R、T位点间不同等位基因组合, 产生不同种皮颜色。IRT和IRt时, 种皮为黄色。ikRT和ikRt时, 种皮为鞍挂, 分别显现黑鞍和褐鞍。iRT和iRt时, 种皮为黑色与褐色。irT和irt时, 种皮为深褐色与褐色。

表1 控制种子颜色经典遗传位点信息Table 1 Information of classical genetic loci controlling seed color
O、W1位点只有在纯合隐性基因型i r背景下才影响大豆种皮的颜色[7]。O位点主要控制种皮的褐色程度, 显性O等位基因为褐色种皮, 隐性o等位基因为红褐色种皮(图1-h)[32]。W1位点同时控制种皮色和花色, 显性W1除控制紫花外又可使种皮为黑色, 隐性w1可部分抑制R基因的作用, 呈现淡褐色种皮[33]。K1与I位点存在典型的上位效应, 显性K1等位基因不会影响种皮花色素分布和含量, 隐性k1在表观上克服显性I和ii等位基因对种皮着色的抑制, 使种皮脐部、鞍区或更大区域含有花色素[34]。基因型IK1、iiK1、ikK1、iK1, 分别与基因型I、ii、ik、i种皮色一致(图1-a~d)。Ik1、iik1的种皮色分别为黑色和鞍挂(黄底黑鞍),Ik1的种子在脱水前完全膨大期种皮外缘有一窄条的非黑色区域, 表明鞍区花色苷向更大的区域扩展, 而导致成熟的种子显现黑色, 其与i基因型黑种皮遗传机制不同。I基因型时, 种皮、子叶一般为黄色, 显性G等位基因使种皮显现绿色, 隐性g等位基因使种皮为黄色[21]。D1、D2位点同时为隐性基因型时, 种皮、子叶才呈现绿色[35-37]。CytG位点为隐性时, 种皮、子叶均为绿色[38-39]。Kohzuma等[40]研究发现, 日本大豆绿子叶资源99.5%由cytG基因控制, 而中国大豆绿子叶资源均为d1和d2基因型。
近年, 伴随生物技术发展, 获得了控制种子颜色分子标记位点30余个, 分别位于1、3、5、6、7、8、9、10、11、12、13、18、19、20号染色体上(图2),这些标记位点表明调控种皮、子叶颜色的遗传基础复杂[41-42]。其中1、6、8、9、11、13号染色体的一些分子标记, 锚定到控制种皮、子叶色经典遗传位点区域。王吴彬等利用野生大豆染色体代换系, 在1号染色体发现分子标记Sat_160与绿色种皮紧密连锁, 该区域位于G位点[43-45]。宋健[12]利用全基因组关联分析也获得G位点连锁的SNP分子标记, 并利用遗传群体, 精细定位该区域, 最终实现候选基因克隆。此外, 宋健[12]利用BSA法定位了2个控制子叶色位点,qCC1和qCC2, 分别包括经典遗传位点D1和D2。T位点位于6号染色体分子标记Satt207和Satt589之间, 同时获得与之关联的SNP标记1个[46]。O位点位于8号染色体分子标记Satt286和Satt365之间, 同时发现与之关联的SNP标记1个。I位点位于8号染色体分子标记A454.p2和AW132402之间, 与Sat_162、SSR53和BARCSO YSSR_08_0539连锁, 同时得到与之关联的SNP标记6个[47]。目前报道的与I位点连锁的分子标记最多, 表明该位点主效应显著, 易被检测到。R位点位于9号染色体分子标记A668-1和K387-1 之间, 与BARCSOYSSR_09_1506和BARCSOYSSR_09_1535连锁, 同时发现与之关联的SNP标记1个[48-49]。W1位点位于13号染色体分子标记Satt348和Satt160之间, 同时获得与之关联的SNP标记1个[50]。这些分子标记的发现为目标性状候选基因克隆及分子调控机制研究奠定了基础。
2 大豆种子颜色相关基因及调控机制
目前已报道调控种皮颜色相关基因20个, 控制子叶颜色基因3个, 详细信息见表2。I位点内有3个基因,O位点内有2个基因, 其他经典遗传位点内均为1个基因。其中4、5、6、11号为花色素合成酶基因的调控基因, 12、13、14、23号为叶绿素调控基因, 其余15个基因均为类黄酮代谢途径酶基因。查尔酮合成酶(chalcon synthase, CHS)基因在大豆中含有9个同源基因, 其编码产物是类黄酮合成途径中的关键酶[51-52]。I位点内CHS1、3、4均有2个拷贝, 排列方式为CHS1-3-4和CHS4-3-1, 其中CHS1和CHS3可构成长倒置重复序列(long inverted repeats, LIR)[53]。该区域通过RNA干扰(RNAi)以组织特异性的方式沉默CHS基因的表达, 是自然界发生RNAi的典型例子之一[54-55]。I或ii等位基因, 可形成长倒置重复序列, 进而产生siRNAs, 使CHS基因沉默, 种皮为黄色[56]。ii基因型时CHS基因的拷贝数平均为10.6个, 较I基因型多3个拷贝数, 导致种脐含有花色素。隐性i基因型时, 位点内发生大片段缺失, 不能产生siRNAs, 丧失对CHS基因表达的抑制作用, 种皮、种脐为深色[57]。I位点对种皮色的调控机制复杂, 不仅有特殊的结构, 还发现3个靶向调控基因AGO5、DCL2a、DCL2b。AGO5位于K1位点, 是Argonaute基因家族的一员, 可靶向切割CHS基因的长倒置重复序列, 产生siRNAs调控种皮颜色[58]。通过转录组和基因组重测序发现,Clark18a中隐性k1的ago5基因存在129 bp的缺失,导致转录本中第7个外显子缺失[59]。该基因丧失产生siRNAs的功能, 使种皮鞍区CHS的mRNA富集,形成黑鞍。对不同资源材料的隐性k1位点进行克隆测序发现, 不同的缺失长度导致种脐两侧色斑形状差异, 但具体机制未见报道。DCL2a/2b编码产物为内啡肽酶同源物, 与AGO5基因的作用机制相同,也可靶向切割CHS基因的长倒置重复序列, 产生22个碱基的siRNAs[60]。当DCL2a和DCL2b被编辑突变后, 丧失对长重复序列的切割功能, 减少对CHS基因的抑制, 使种皮为褐色。
F3’H(flavanone-3’-hydroxylase)基因位于T位点, 编码类黄酮-3’-羟基化酶, 是细胞色素P450依赖的单加氧酶[61]。具有保守结构域GGEK, 能与血红素结合催化黄烷酮羟基化。隐性t位点, 含有3种等位基因, 分别有单碱基缺失和外显子区非同义突变, 最终导致基因功能缺失, 形成褐色种皮、灰色茸毛[62]。tm等位基因时,F3’H基因中插入一个20.5 kb-CACTA转座子。该转座子在生育期间的一些细胞中跳出, 恢复T基因型。导致同一株即有棕色又有灰色茸毛, 种皮也分别显现深褐和褐色[31]。F3’5’H(flavanone-3’,5’-hydroxylase)基因位于W1位点, 编码类黄酮-3’,5’-羟基化酶, 也是细胞色素P450依赖的单加氧酶, 催化黄烷酮羟基化[33]。隐性w1基因型时,F3’5’H基因的第3个外显子插入53 bp短序列, 导致移码突变缺失羟基化功能, 表型为白花、淡褐种皮。ANR1/2(anthocyanidin reductase)位于O位点内, 在染色体上串联排列, 编码产物为花青素还原酶, 可合成原花青素, 通过RNAi干涉验证了它改变种皮色的功能, 但遗传调控机制未见报道[32]。R2R3 MYB基因为转录因子, 位于R位点, 可调控花青素合成酶(anthocyanidin synthase, ANS)基因的表达[63]。r基因型时,R2R3 MYB基因有一个碱基C的缺失, 导致移码翻译产物提前终止, 比成熟的完整蛋白质短152个氨基酸[64]。R2R3 MYB基因的第2个内含子插入13 kb-CACTA转座子, 根据表型又分为2种等位基因型:R*和rm。R*基因型时, 转座子的CACTA序列具有更高的甲基化水平, 转座酶无法与之结合, 缺乏转座活性,R2R3 MYB基因的转录拼接得以正常进行, 尽管转录水平较低, 足够刺激花青素的产生, 从而形成黑色种皮。rm基因型时,CACTA区的甲基化水平较低, 转座酶可与之结合,阻止R2R3 MYB基因的内含子剪接, 导致棕色种皮背景; 同时在一些细胞中转座子被切除,R2R3 MYB得以转录调控ANS基因产生花色素, 形成黑色条纹。
CPSI基因编码CAAX自身免疫蛋白酶, 位于G位点, 可防止叶绿素降解使成熟种皮为绿色[65]。隐性g基因第8内含子的末端发生A-G碱基突变, 使基因翻译提前终止, 种皮为黄色[66]。G基因也可以调控种子的休眠, 在驯化过程中受到选择, 表明种皮色调控基因也存在其他重要功能。SGR1/2基因编码保持绿色蛋白, 位于D1和D2位点内。SGR基因通过转录或转录后水平, 调控叶绿素降解酶而参与叶绿素降解[67]。显性D1D2具有调控叶绿素降解功能, 子叶呈黄色。隐性d1d2由于单碱基的缺失及大片段插入, 缺失调控叶绿素降解功能, 使子叶保持绿色[12]。Psbm基因编码光系统II反应中心M亚基,位于CytG位点内, 为母系遗传基因。隐性psbm基因中蛋白编码区有5 bp的碱基插入, 产生移码突变导致基因翻译提前终止, 使叶绿素b降解受阻。显性Psbm基因使成熟种子为黄皮黄子叶, 隐性psbm基因使成熟种子为绿皮绿子叶[40]。表2中15~22号为类黄酮合成酶基因, 分别为查尔酮异构酶1A/2(chalconce isomerase, CHI1A/2)基因、黄烷酮-3-羟化酶(flavanone-3-hydroxylase, F3H)基因、二氢黄酮醇还原酶1/2 (dihydroflavonol 4-reductase, DFR1/2)基因、花青素合成酶2/3 (anthyocyanidin synthase,ANS2/3)基因、UDP类黄酮葡萄糖基转移酶(UDPflavonoid 3-O-glucosyltransferase, UF3GT)基因[68]。其中F3H、DFR1、DFR2分别位于控制花色的Wp、W3、W4的位点内。这些基因在不同颜色的种皮中差异表达, 并且随着种子发育时期而变化, 进而调控种皮色[69-70]。综上可知, 种子颜色由多基因调控,大部分基因的遗传调控机制已经解析(表3), 但仍有部分基因的分子调控机制未知。
3 大豆类黄酮生物合成途径及主要产物的生理功能
迄今, 已报道23个种子颜色调控基因, 除G、D1、D2、CytG基因外, 其他19个均在类黄酮合成途径通路上。因此充分了解类黄酮生物合成途径,可更好地明晰种皮色的调控机制。类黄酮是次生代谢产物中重要的一类, 其核心结构是由15个碳原子构成的苯丙烷[71]。其中2个六碳芳香环(A环和B环)被1个三碳杂环(C环)所连接, 在代谢通路上通过对C环的重排、氧化、烷化、糖基化等最终形成稳定的原花青素或花色苷[72]。二者为有色化合物, 使种皮、花和茸毛着色[73]。类黄酮生物合成属于次生代谢, 易受环境等因素影响, 调控机制非常复杂, 目前仍存在着未知代谢通路[74]。通过归纳总结已有研究成果, 将已报道的19个基因和相关代谢产物关联,绘制出种皮色相关基因调控的大豆类黄酮生物合成途径(图3)。
具体过程如下, 1分子香豆酰辅酶A(4-coumaroyl-CoA)和3分子丙二酰辅酶A (3 malonyl-CoA)在查尔酮合成酶(CHS)的作用下形成柚皮苷查尔酮(naringenin chalcone)。DCL2a/b和AGO5基因通过调节CHS基因的mRNA含量, 进而调控查尔酮合成酶的含量和活性, 由于该酶是类黄酮合成途径第1个酶, 对整个代谢途径都有限速调控功能。柚皮苷查尔酮在查尔酮异构酶(CHI)的催化下形成无色的三羟基黄烷酮(Naringenin)。三羟基黄烷酮之后产生3个分支, 分别在黄烷酮3’-羟化酶(F3’H)、黄烷酮3-羟化酶(F3H)、黄烷酮3’,5’-羟化酶(F3’5’H)的催化形成四羟基黄烷酮(eriodictyol)、二氢山萘酚(dihydrokaempferol)、五羟基黄烷酮(5’ OH Eriodictyol)[75]。四羟和五羟基黄烷酮在F3H的催化下形成二氢槲皮素(dihydroquercetin)和二氢杨梅素(dihydromyricetin), 二氢山萘酚在F3’H和F3’5’H的催化下也可形成二氢槲皮素和二氢杨梅素。二氢槲皮素、二氢山萘酚和二氢杨梅素在二氢黄酮醇还原酶(DFR)的催化下进一步还原形成不稳定的无色花色素, 然后再在花青素合成酶(ANS)的作用下形成花色素, 分别为矢车菊素(cyanidin)、天竺葵花素(pelargonidin)、翠雀花素(delphinidin)[76]。R位点的MYB转录因子基因调控ANS2/3基因的表达, 进而调控ANS酶的含量和活性, 调节花色素的含量, 影响种皮色[77]。花色素作为前体, 在花青素还原酶(ANR)和UDP类黄酮葡萄糖基转移酶(UF3GT)的催化下分别形成原花青素(proanthocyanins)和花色苷(anthocyanins)。UF3GT基因在种子成熟过程中表达量不断升高, 在种子成熟的中后期达到峰值。类黄酮生物合成途径的两大产物分别为原花青素和花色苷。花色苷含量高于原花青素时, 种皮呈黑色,反之成褐色。当原花青素高时, 二者比例决定褐色程度[78]。
?

?

?

?
原花青素和花色苷, 是植物中广泛存在的水溶性天然色素[79]。近年, 天然色素的功能和重要性逐渐凸显, 目前已应用于腊肠、果汁饮品、牙膏、再造烟叶等的染色上[80-83]。黑豆种皮富含原花青素和花色苷, 有研究报道将其应用于蚕丝织物染色[84]。关于黑豆皮的药用研究已有千年历史, 《名医别录》载, 黑豆皮中药称“料豆衣”。料豆衣味甘性凉, 能解毒利尿, 经常服食对增强造血功能、强健骨骼等大有裨益[85]。现代医学研究表明, 花色苷通过清除自由基, 具有明显的抑制高血脂、动脉硬化等心血管病的效果[86]。徐金瑞[87]通过体外试验证实, 黑豆皮中的花色苷具有显著改善生物体内脂质代谢, 降低氧化应激水平, 减少血管内皮细胞的过氧化损伤,并具有间接舒张血管的作用。张继曼[88]研究表明,黑豆红花色苷还具有降低糖尿病小鼠高血糖的作用。综上可知, 大豆种皮中的花色素可作为天然染料, 更具药用价值。因此充分解析种皮色遗传调控机制, 可依据多元化市场需求分子设计改良大豆种子颜色, 以期最大发挥大豆的价值。
4 结语与展望
历经100多年, 种皮及子叶色的遗传规律基本明确[89], 相关位点、基因及互作机制也逐步被解析。遗传学分析发现控制大豆种皮色的位点有I、R、T、O、W1、K1、G、D1、D2、CytG[21]。利用遗传群体连锁分析和自然群体的关联分析, 获得控制种皮色的分子标记位点30余个, 除K1、CytG其他8个经典遗传学位点均有与之连锁的分子标记[41-42]。T位点的GmF3’H基因首个被克隆, 随后通过图位克隆、转录组和基因组重测序等方法, 相继获得其他9个位点的候选基因[61]。这些基因都与色素的代谢有关,其中I、T、W1、O位点内为类黄酮生物合成途径关键酶基因,R和K1位点内分别为类黄酮生物合成途径酶基因的转录因子及调控基因,G、D1、D2、CytG位点内为叶绿素调控基因。此外通过基因编辑及目标基因的差异表达分析发现, 经典遗传位点外其他基因也有调控种皮色的功能, 如DCL2、CHI1A/2、F3H、DFR1/2、ANS2/3、UF3GT基因等[32,60,68]。这些基因的编码产物均参与类黄酮合成途径, 表明类黄酮代谢与种皮色密切相关, 代谢产物含量与组成比例决定了种皮颜色。
纵览种子颜色的遗传调控研究历史, 20世纪以经典遗传研究为主, 21世纪以分子调控机制及网络解析为主。位点间互作、基因间的调控以及类黄酮代谢通路, 共同构成种皮色调控网络[72]。此网络包含的调控基因数目众多, 调控机制复杂。不仅有传统遗传调控, 还有表观遗传调控。如I位点存在基因结构变异, 同时存在RNA干涉现象[51,53]。此位点更是重要的驯化位点, 在进化过程中出现大片段反转、重复插入等, 导致种皮色从黑到黄的变化[54]。T位点有等位基因的序列变化[62], 同时存在转座子插入调控, 导致同株不同色现象[63]。R位点调控机制更为复杂, 有单碱基缺失、有转座子插入、更有甲基化程度的改变[64]。由于受遗传背景的影响, 同一个性状如黄色的遗传也不同, 既有显性[26], 也有隐性[21]。I基因型时, 在G基因控制下绿色为显性, 黄色为隐性[65]。此外G基因还有调控种子休眠的功能,在驯化过程中受到选择[66]。由此可知调控种皮色的基因, 也有可能存在其他重要的未知功能。与种子颜色遗传研究相比, 我国开展黑大豆的药用功能研究更早, 距今已有千年历史[85]。现代医学研究证实,黑豆皮中的花色苷具有促进脂类代谢良性循环、预防心脑血管疾病、降血糖等功能[86-88]。近年来, 由于生物染料具有安全健康等优势, 黑豆花色素也应用于蚕丝等织物的染色[84]。研究表明深色大豆种子含有多种花色苷, 种质资源间花色苷组分含量差异显著, 抗氧化能力也不尽相同[90]。大豆中花色苷含量受多基因调控, 表现出数量性状的遗传特征。这与本文关于种子颜色遗传调控归纳总结结果一致,目前已知近20个基因参与调控类黄酮代谢途径。还需要进一步筛选挖掘调控种子颜色的结构基因、转录因子等, 完善相关基因的功能和分子调控机制,补充绘制调控网络。随着技术的发展以及研究的深入, 更多遗传调控机制会被发现, 不仅能进一步完善已有种子颜色的调控网络, 也可利用大数据, 构建新种子颜色的代谢网络[91]。进而实现种子颜色的定向分子设计与改良, 创制出如黑子叶、紫种皮等更具药用、营养价值的大豆, 为满足多样化消费需求提供科技支撑。
