1株蔬菜源mcr-1阳性多重耐药大肠杆菌特征分析
2021-08-06梅彩月马沁春周艳阳李云赟沈鹏程焦新安
梅彩月,马沁春,王 燕,2,周艳阳,李云赟,沈鹏程,2,王 晶,2,焦新安,2
早在20世纪50年代,黏菌素就一直被用于治疗由革兰氏阴性菌引起的感染,主要是多黏菌素B和多黏菌素E,到1970年前后因为黏菌素具有肾毒性和神经毒性的副作用而被停止在临床使用[1-2]。但在中国等多个国家,黏菌素被用作饲料添加剂在畜牧养殖业中广泛使用。20世纪90年代初,随着多重耐药革兰氏阴性菌株的出现和新抗生素的缺乏,黏菌素开始重新被应用于临床,成为治疗碳青霉烯类耐药肠杆菌的最后一道防线[3],因此,世界卫生组织(WHO)将其归类为对人类医学至关重要的药物[4]。
过去认为,革兰氏阴性菌对多黏菌素耐药的主要机制是通过正电荷的方式修饰脂质A,如氨基阿拉伯糖或磷酸乙醇胺[5-6]。自2015 年我国在猪源大肠杆菌中首次发现了质粒介导的可水平转移的多黏菌素耐药基因,将其命名为mcr-1(Mobile Colistin Resistance, MCR),随后在全球各地引起研究mcr-1的热潮[7]。mcr-1基因在食品动物和动物性食品中最为流行,也陆续在宠物、野生动物、人、环境和蔬菜中发现[8]。目前,在中国、韩国、瑞士等国家中陆续在蔬菜中检出mcr-1,检出率较低(0.076%~3.6%)且大肠杆菌是mcr-1的主要宿主[9-12]。可生食蔬菜有可能被浇灌的粪肥、水或土壤中耐药细菌污染,并可能通过食物链将耐药菌传递给人类,因此有必要对可生食蔬菜进行耐药菌的监测。本研究对扬州市可生食蔬菜进行mcr-1基因的检测,检测到1株mcr-1阳性大肠杆菌,对其耐药特点和菌株特征进行分析。
1 材料和方法
1.1 样品来源 2019年11月在扬州2家超市采集零售蔬菜样品251份,包括黄瓜66份、西红柿62份、胡萝卜60份、生菜63份。
1.2 抗菌药物 氨苄西林、头孢唑啉购自中国食品药品检定研究院,头孢噻肟、氯霉素、氟苯尼考、多黏菌素购自上海阿拉丁生化科技股份有限公司,庆大霉素、链霉素、环丙沙星购自生工生物工程(上海)股份有限公司,阿米卡星、美罗培南、磷霉素购自大连美仑生物技术有限公司,盐酸四环素购自北京索莱宝科技有限公司,萘啶酸、磺胺甲恶唑-甲氧苄啶购自Sigma-Aldrich。
1.3 培养基 麦康凯琼脂购自广州环凯微生物有限公司,伊红美兰琼脂购自青岛海博生物技术试剂有限公司,LB 琼脂和LB 肉汤购自美国BD公司。
1.4 细菌分离鉴定 在超净工作台中将采集到的蔬菜样品接种于40~45 mL LB 肉汤试管中,生菜样品接种于无菌采样袋,37 ℃恒温摇床中培养24 h。使用麦康凯琼脂进行细菌纯化,培养 16~18 h后,用接种环挑取粉色并且中间颜色深的单菌落于伊红美蓝琼脂板上进行二次纯化,挑选具有金属光泽疑似大肠杆菌,用30%甘油肉汤保存在-70 ℃,以备后续实验使用。
1.5 提取DNA模板 挑取麦康凯板上生长的单菌落接种至LB琼脂板上,继续培养12~18 h,刮取适量菌苔,充分悬浮于含500 μL 1×TE Buffer的1.5 mL离心管中,100 ℃加热15 min,冰浴15 min,12 000 r/min离心5 min,取上清液移至另一支1.5 mL离心管,即制得模板DNA,将其放于4 ℃冰箱保存备用。
1.6 PCR检测耐药基因mcr-1引物序列参考相关文献[13]进行设计,由南京金斯瑞公司合成。采用 25 μL的 PCR 反应体系,并设立阳性对照。取5 μL PCR产物进行1%琼脂糖凝胶电泳,缓冲液为0.5×TBE,DL2000作为DNA分子量marker,120 V/cm电压下电泳30 min后用凝胶成像系统观察拍照分析。将阳性PCR产物送南京金斯瑞生物科技有限公司进行测序,并将测序结果提交至NCBI(http://blast.ncbi.nlm.nih.gov/BLAST)进行比对。同时,利用16S rRNA基因扩增和测序对该mcr-1阳性菌进行菌种鉴定[14]。
1.7 药物敏感性测定 对mcr-1阳性大肠杆菌采用微量肉汤稀释法测定对16种常用药物的最小抑菌浓度(Minimum Inhibitory Concentration,MIC),药敏结果根据CLSI或EUCAST标准进行判读,大肠杆菌ATCC 25922为药物敏感性测定的质控菌株。
1.8 全基因组测序及分析 按照天根全基因组提取试剂盒说明书进行提取,将样品送至北京诺禾致源生物有限公司进行二代测序,通过软件SPAdes 3.10.0进行组装,组装好的全基因组数据利用 CGE 数据库(https://cge.cbs.dtu.dk/)进行多位点序列分型(Multilocus sequence typing, MLST)、耐药基因、染色体位点突变以及质粒分析。
2 结 果
2.1 大肠杆菌分离及mcr-1基因检测 从251份蔬菜样品中共分离获得189株肠杆菌,包括麦康凯板分离的138株肠杆菌,和含2 mg/L 头孢噻肟的麦康凯板分离的51株肠杆菌,仅在1株(0.53%)药板分离的生菜来源的肠杆菌YZ19VCLC47中检测到mcr-1基因,16S rRNA基因测序结果证实其为大肠杆菌。
2.2mcr-1阳性大肠杆菌特征 菌株YZ19VCLC47对黏菌素的MIC为8 mg/L,且对氨苄西林、头孢唑啉、头孢噻肟、链霉素、四环素、氯霉素、氟苯尼考、奈啶酸、环丙沙星、磷霉素和复方新诺明耐药。对该菌株全基因组序列进行分析,结果发现该菌株为ST359型大肠杆菌,除携带mcr-1外,还同时携带多种耐药基因,如blaTEM-1b等,详见表1。同时菌株还存在喹诺酮耐药相关染色体基因gyrA和parC的突变,与oqxAB共同作用导致其对环丙沙星耐药。菌株YZ19VCLC47携带IncI1、IncI2和F18:A-:B1质粒,其中mcr-1位于IncI2质粒上。

表1 1株mcr-1阳性多重耐药大肠杆菌的菌株特征
2.3 质粒分析 对大肠杆菌YZ19VCLC47携带的mcr-1质粒pYUYZV47-MCR(GenBank收录号MW373507)与不同地区、来源和菌种的mcr-1阳性IncI2质粒序列进行比较分析(图2),发现pYUYZV47-MCR具有典型的IncI2骨架结构,包括复制区、接合先导区和接合转移区,与全球流行的mcr-1阳性IncI2质粒序列高度相似。pYUYZV47-MCR与首次发现携带mcr-1的质粒pHNSHP45相似性高达99.6%,覆盖率达89%。不同的是,质粒pYUYZV47-MCR中mcr-1基因上游无ISApl1的插入,并缺少包含IS683转座酶基因tnpA和stbD/stbE的片段。
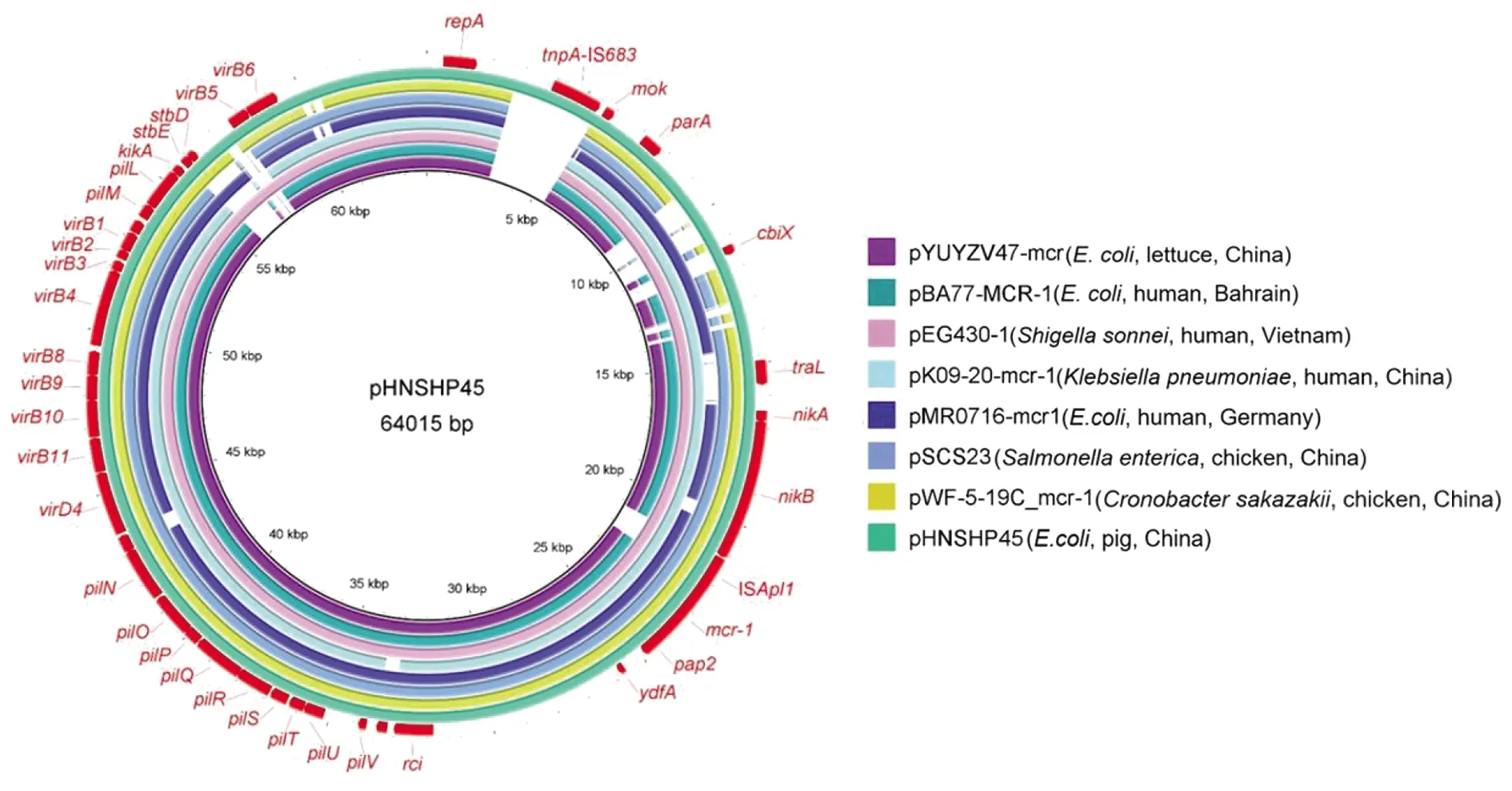
图2 pYUYZV47-mcr与mcr-1阳性IncI2质粒比较
3 讨 论
自2015年首次在猪源大肠杆菌中发现mcr-1基因后,该基因陆续在全球食品动物、宠物、野生动物、人、环境、蔬菜、动物性食品等多种来源肠杆菌中被发现,其中mcr-1在食品动物和动物性食品中检出率较高,可能与黏菌素作为饲料添加剂在养殖业中被广泛使用有关[8,15]。mcr-1在蔬菜中的检出率显著低于动物中的检出率[4]。本研究中,mcr-1在蔬菜源中的检出率只有0.53%,低于国外和我国其他地区蔬菜中mcr-1的检出率[9-10,12]。在瑞士Zurfuh等[9]从进口蔬菜中分离到2株(3.33%)携带mcr-1的产超广谱β-内酰胺酶(Extended spectrum β-lactamases, ESBLs)大肠杆菌。在我国,Luo等[10]对广州2015—2016年间采集的708份市售蔬菜样品进行mcr-1的检测,结果150株大肠杆菌中有3株(2%)携带mcr-1,202株产ESBLs肠杆菌中6株(2.97%)检测到mcr-1基因,包括4株大肠杆菌和2株拉马尔菌。
本研究中检测到的1株mcr-1阳性大肠杆菌YZ19VCLC47,多序列位点分型结果为ST359型。ST359大肠杆菌是目前流行的产ESBLs克隆型之一[16],此外ST359型大肠杆菌主要分离自动物和零售鸡肉(火鸡、产蛋鸡、老母鸡)样品[16-20],且与分离自人类样品的具有高度相似性[20],说明ST359菌株具有人兽共患病潜能,我们在蔬菜中发现ST359型大肠杆菌,提示有可能是通过动物粪肥传递到蔬菜中,而可生食蔬菜若未清洗干净,病原菌可通过食物链传播给人类。目前已陆续在猪肉、鸡肉、牛肉、蔬菜、水等不同样品中检出mcr-1[4],且mcr-1已在不同菌种间传播,可能是因为mcr-1主要存在于可接合质粒中,使得mcr-1基因可以在不同宿主间快速传播。本研究中大肠杆菌YZ19VCLC47的mcr-1位于IncI2质粒pYUYZV47-MCR上,并且与不同来源、菌种和地区携带mcr-1的IncI2质粒高度相似。除IncI2质粒外,IncX4和IncHI2质粒也是mcr-1在全球传播的主要载体[21]。可移动元件ISApl1常介导mcr-1的转移,帮助mcr-1在不同质粒之间以及质粒与染色体之间转移,然而本研究中并未在mcr-1的上游或下游发现ISApl1,可能是在进化或传播过程中丢失ISApl1以保证基因的稳定性[22]。此外,该mcr-1阳性菌株还同时携带多种耐药基因,如β-内酰胺酶基因(blaCTX-M-14)、磷霉素耐药基因(fosA3)、氟苯尼考耐药基因(floR)、喹诺酮耐药基因(oqxAB)等,导致其对氨苄西林、头孢唑啉、头孢噻肟、链霉素、四环素、氯霉素、氟苯尼考、萘啶酸、环丙沙星、磷霉素和复方新诺明耐药。虽然黏菌素禁止作为饲料添加剂在动物饲料中使用[23],可能会减缓黏菌素的传播[24],但头孢菌素、氟苯尼考等其他药物在养殖中的使用可能对mcr-1存在共选择作用。
虽然mcr-1在蔬菜沾染细菌中检出率较低,但可生食蔬菜可通过动物粪便、土壤、水等途径获得耐药菌,并由食物链传播给人类,威胁人类健康,因此需要加强对蔬菜中耐药菌的监测。
利益冲突:无
