微小膜壳绦虫感染对ICR小鼠小肠LY6A(Sca-1)及IFN-γ、STAT1表达的影响
2021-08-06杨汉蕾陈素素
赵 敬,杨汉蕾,陈素素,牟 荣
微小膜壳绦虫(Hymenolepisnana)是一种人兽共患寄生虫,主要寄生于人及啮齿类动物的肠道。我国主要分布在17个省市和自治区,其中新疆维吾尔自治区的感染率最高[1]。近年来,在贫困地区和儿童中微小膜壳绦虫的感染更是带来了很多流行病和公共卫生的新兴问题[2]。目前微小膜壳绦虫在流行病学、临床表现及治疗方面的研究比较常见,但在免疫方面的研究并不多见。
LY6家族可参与T细胞活化[3-4]、嗅觉[5]和细胞粘附[6]等多种功能。其中LY6A(Lymphocyte antigen 6 complex locus A)又叫作Sca-1(Stem cell antigen-1),它是LY6基因家族中第1个被鉴定的成员,也是一种糖基磷脂酰肌醇(GPI)锚定细胞表面蛋白。其广泛表达于不同的细胞类型,包括造血干细胞、大多数淋巴细胞、胸腺细胞、单核细胞、肾上皮细胞和成骨细胞[7-10]。研究发现LY6A(Sca-1)的表达对与炎症性肠病(IBD)免疫发病机制有关的趋化因子分泌产生影响[11]。此外,γ-干扰素(IFN-γ)等细胞因子可以广泛促进LY6A(Sca-1)的表达,并且细胞因子介导的LY6A(Sca-1)的诱导依赖于信号转导和转录激活因子1(Signal transducerand activator of transcription 1,STAT1)[12]。近年来有学者研究发现LY6A在多形螺旋线虫感染的小鼠小肠肉芽肿中表达升高[13]。但是目前尚无微小膜壳绦虫感染后小肠组织中LY6A(Sca-1)及IFN-γ、STAT1表达的研究报道。因此本研究在建立微小膜壳绦虫实验感染ICR小鼠动物模型的基础上,对感染后第2 d和第8 d的小鼠小肠采用HE染色进行组织病理学观察,RT-PCR技术检测LY6A、IFN-γ和STAT1的mRNA相对表达量,免疫组织化学技术检测小肠中LY6A(Sca-1)蛋白阳性细胞百分比,并用PRM技术对LY6A(Sca-1)蛋白和STAT1蛋白的相对丰度进行定量,以探讨微小膜壳绦虫感染小鼠小肠组织中LY6A(Sca-1)、IFN-γ和STAT1表达情况,为深入研究微小膜壳绦虫所致宿主肠道免疫病理损伤的分子机制提供基础资料。
1 材料与方法
1.1 材 料
1.1.1 虫体来源 微小膜壳绦虫标本采自贵州省贵阳市花溪区野生小鼠,前期课题组经形态学和分子生物学鉴定,确定采集虫体为微小膜壳绦虫。
1.1.2 实验动物 120只4~6周龄ICR小鼠购自贵州医科大学,体重约26 g,体健,经粪检证实无寄生虫感染。
1.1.3 主要试剂和仪器 主要试剂Trizol试剂购自美国Sigma公司,逆转录试剂盒和实时荧光定量PCR试剂盒均购自日本TAKARA 公司,PCR引物由上海生工生物工程有限公司合成,二甲苯、无水乙醇、4%多聚甲醛、苏木素、伊红均购自北京索莱宝科技有限公司,兔抗鼠LY6A/Sca-1单克隆抗体(ab109211)购自美国Abcam公司,通用二步法试剂盒、封闭用羊血清、DAB显色试剂和柠檬酸盐修复液均购自北京中杉金桥公司。主要仪器荧光定量PCR仪(7300)为美国ABI公司产品,轮转式切片机及成像系统均为德国公司产品,型号分别为Leica RM2255和Leica DM6B。
1.2 方 法
1.2.1 虫卵收集和计数 将微小膜壳绦虫的末段孕节放在盛有生理盐水的培养皿中用注射器针头沿纵轴划破孕节使虫卵溢出,并用生理盐水反复清洗,2 000 r/min离心10 min,收集虫卵备用。使用光学显微镜观察收集的虫卵并反复计数5次,取平均值,定量300 μL生理盐水中虫卵数为1 000个备用。
1.2.2 实验动物感染和标本采集 将ICR小鼠随机分为实验组和对照组各6只,实验组以定量1 000个/只虫卵通过灌胃感染。于感染后第2 d和第8 d按照编号处死实验组和对照组小鼠各6只,采集实验组和对照组肠组织,随机取3只小鼠距回盲部6~8 cm的小肠放入盛有1 mL的EP管内液氮速冻后再置于-80 ℃冰箱保存备用。另外3只小鼠取小肠相同部位放入4%多聚甲醛中固定后保存。
1.2.3 小肠组织病理学观察 小肠组织固定后经脱水、包埋、切片,切片厚度为4 μm,然后进行苏木精-伊红染色(hematoxylin-eosin staining,H&E stain)。连续切片并选择染色良好的肠管横切面,在显微镜下观察组织病理变化。
1.2.4 实时荧光定量PCR 使用上海生工公司在线软件设计并合成LY6A(Sca-1)、IFN-γ、STAT1和3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)实时荧光定量 PCR 引物,并由其合成(表 1)。使用Trizol法提取各组小肠组织总RNA,按照试剂盒说明逆转录为cDNA。PCR反应条件:95 ℃ 30 s; 95 ℃ 5 s,60 ℃ 34 s,72 ℃ 30 s,共40个循环。将实时荧光定量PCR得出的各组LY6A(Sca-1)、IFN-γ、STAT1和内参基因GAPDH的CT值记录下来,重复3次取平均值。计算LY6A(Sca-1)、IFN-γ和STAT1的△△CT值,采用2-△△CT法计算出各组LY6A(Sca-1)、IFN-γ和STAT1的相对表达量。
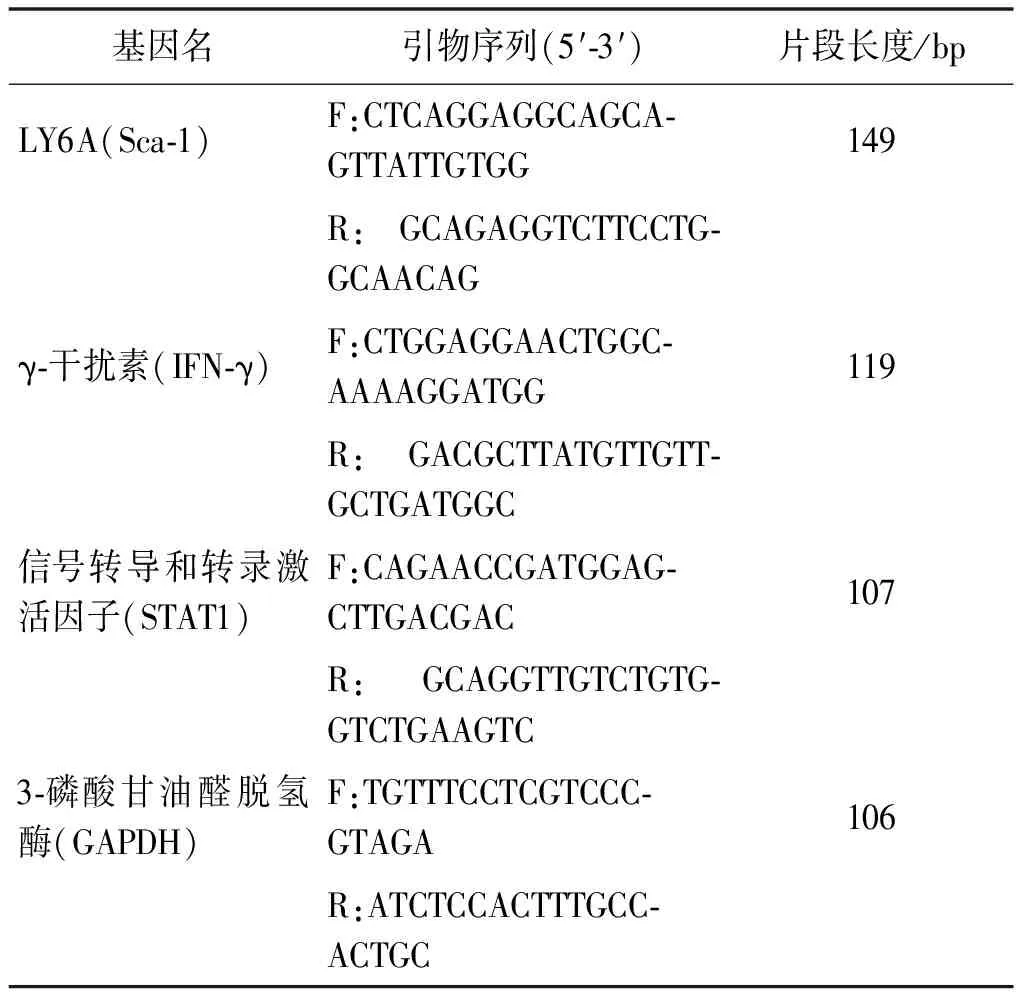
表1 荧光定量PCR引物
1.2.5 免疫组织化学 常规制作石蜡切片,厚度为3 μm,并进行脱蜡、脱水、过氧化氢阻断内源性过氧化物酶、柠檬酸盐修复,然后加入一抗LY6A(1∶50)4 ℃孵育过夜。复温30 min,再加入二抗37 ℃孵育30 min,DAB显色3 min,苏木素复染10 s,中性树胶封片后显微镜下观察。PBS代替一抗作为阴性对照。
结果判定:阳性细胞表现为细胞质棕黄色着色。每张组织切片随机选取10个高倍视野,观察阳性细胞数占总细胞数的百分比[14]。
1.2.6 PRM技术检测 样品从-80 ℃取出,称取适量组织样品至液氮预冷的研钵中,加液氮充分研磨至粉末提取动物总蛋白,并利用BCA试剂盒进行蛋白浓度测定。将蛋白进行胰酶酶解,肽段使用液相色谱-质谱联用分析。最后采用所选肽段的碎片离子峰面积对LY6A和STAT1蛋白的相对丰度进行定量[15]。
2 结 果
2.1 微小膜壳绦虫实验感染ICR小鼠结果 ICR小鼠可以感染微小膜壳绦虫虫卵,自感染后第7 d开始,实验组小鼠在距回盲部6~12 cm处可见白色虫体(图1),检获率100%。
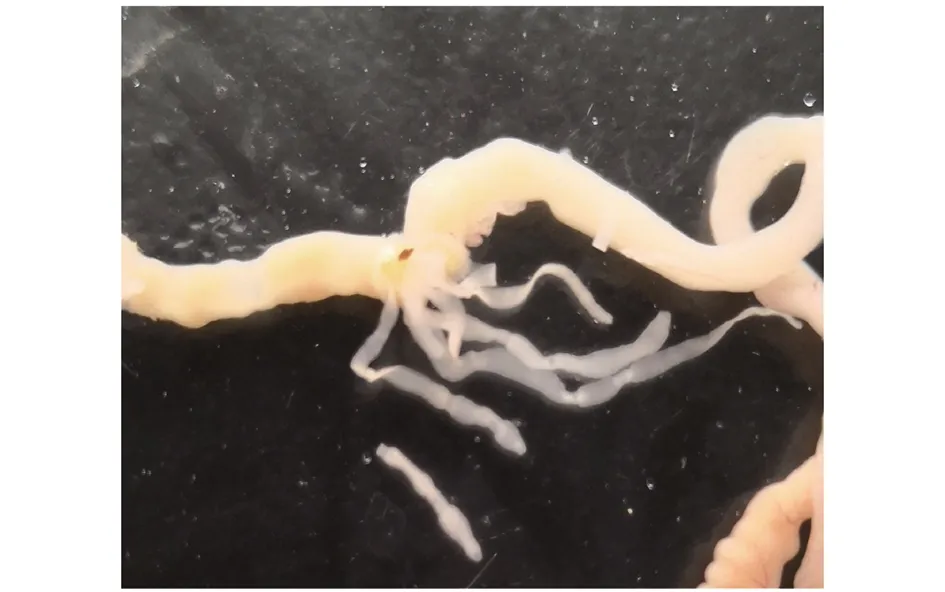
图1 小鼠小肠感染后获取的微小膜壳绦虫
2.2 小肠组织病理观察结果 感染后第2 d,HE染色连续切片显示小肠组织结构正常,无明显病理变化(图2A)。感染第8 d,小肠肠腔内可见成虫节片,且成虫寄生部位嗜酸性粒细胞明显增多(图2B)。
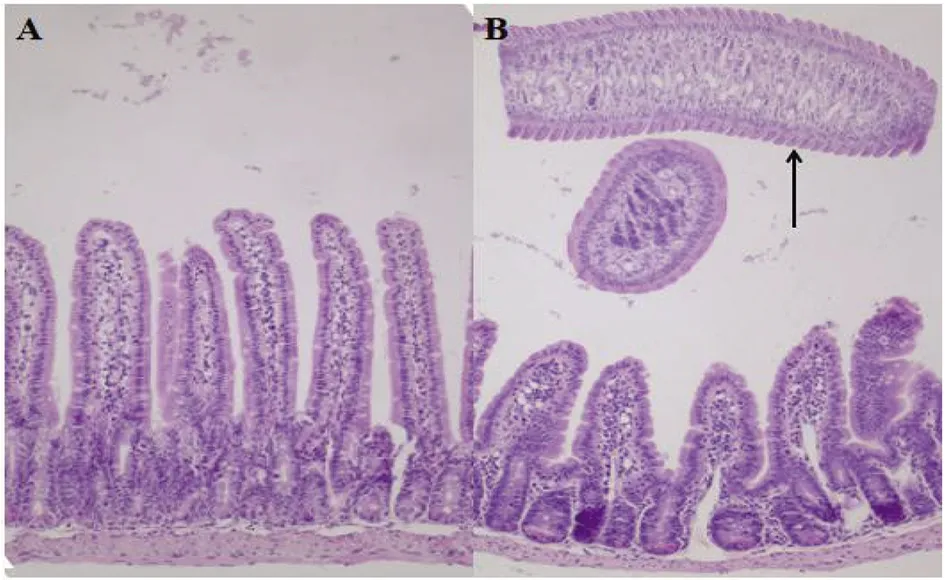
A:感染后第2 d小鼠肠组织HE染色结果;B:感染后第8 d小鼠肠组织HE染色结果,↑示成虫节片。(放大倍数=100倍)
2.3 实时荧光定量PCR检测LY6A(Sca-1)、IFN-γ和STAT1的mRNA相对表达量结果 感染后第2 d,实验组LY6A的mRNA相对表达量低于对照组,差异具有统计学意义(t=12.57,P<0.001);感染后第8 d实验组LY6A的mRNA相对表达量明显高于对照组,差异具有统计学意义(t=10.01,P<0.001)(图3A)。感染后第2 d,实验组IFN-γ的mRNA相对表达量高于对照组,差异具有统计学意义(t=7.78,P<0.01);感染后第8 d,实验组IFN-γ的mRNA相对表达量低于对照组,差异具有统计学意义(t=26.47,P<0.001)(图3B)。在感染后第2 d,实验组STAT1的mRNA相对表达量低于对照组,差异有统计学意义(t=12.13,P<0.001);而在感染后第8 d实验组STAT1的表达量高于对照组,差异有统计学意义(t=11.19,P<0.001)(图3C)。
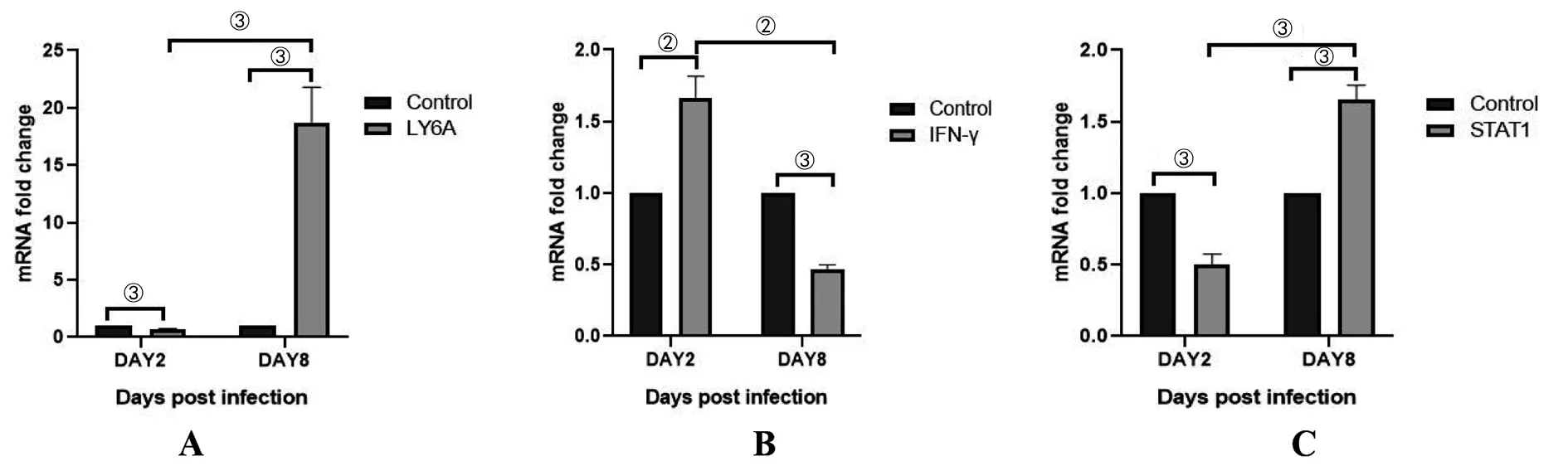
注:①P<0.05;②P<0.01;③P<0.001
2.4 免疫组织化学检测小肠LY6A蛋白表达结果 显微镜下观察实验组和对照组肠组织LY6A蛋白染色均可见阳性细胞,阳性细胞主要出现在小肠间质细胞的细胞质上(图4A-D)。感染后第2 d实验组阳性细胞百分比高于对照组,差异有统计学意义(t=4.26,P<0.01);感染后第8 d实验组阳性细胞百分比显著高于对照组,差异有统计学意义(t=8.18,P<0.001)(图5)。
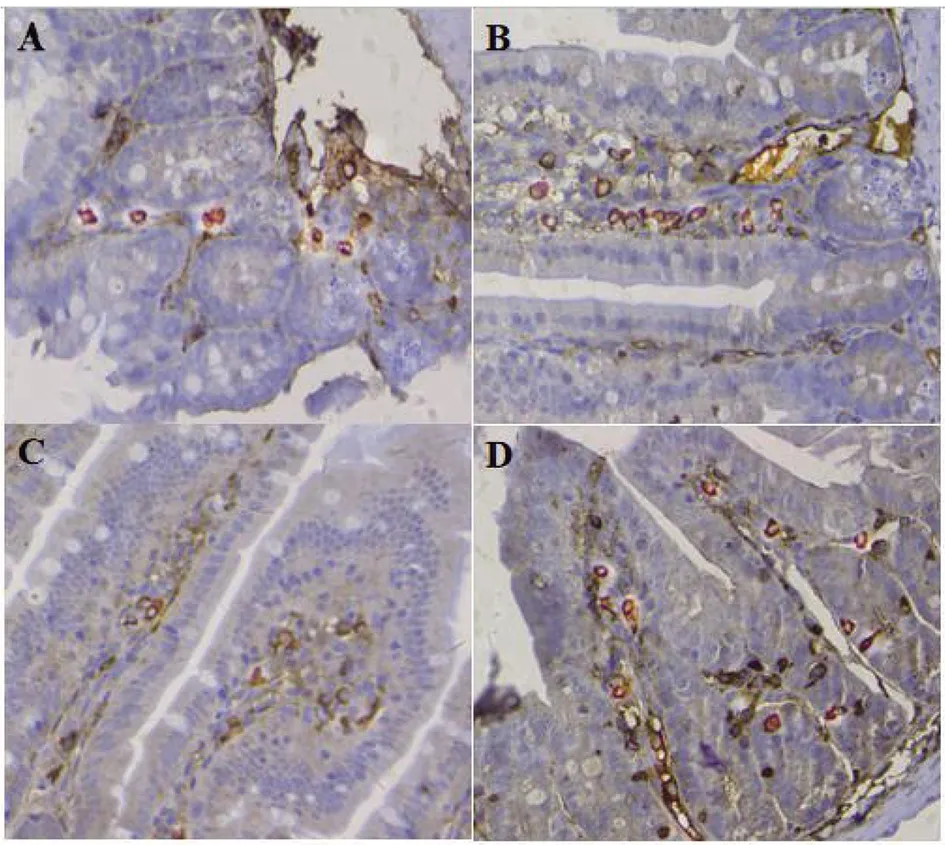
A:第2 d对照组小鼠肠组织LY6A蛋白免疫组化结果;B:感染后第2 d实验组小鼠肠组织LY6A蛋白免疫组化结果;C:第8 d对照组小鼠肠组织LY6A蛋白免疫组化结果;D:感染后第8 d实验组小鼠肠组织LY6A蛋白免疫组化结果。(A-D放大倍数为200倍)
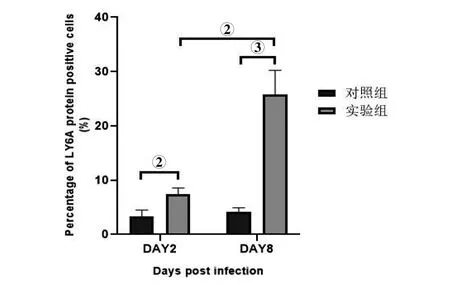
注:①P<0.05;②P<0.01;③P<0.001
2.5 PRM检测小肠LY6A和STAT1蛋白表达结果 感染后第2 d实验组LY6A蛋白表达量低于对照组,差异有统计学意义(t=6.55,P<0.05);而感染后第8 d实验组与对照组相比LY6A蛋白表达增加,差异有统计学意义(t=4.95,P<0.05)(图6A)。感染后第2 d STAT1蛋白实验组与对照组相比无统计学差异,但在感染后第8 d实验组STAT1蛋白的表达高于对照组,差异有统计学意义(t=2.91,P<0.05)(图6B)。
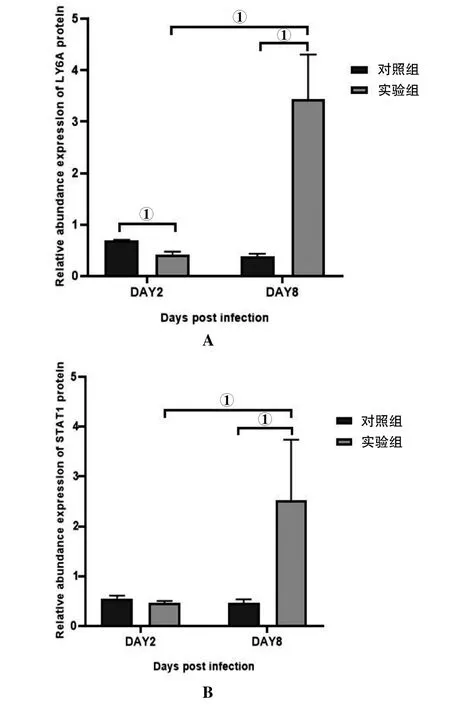
注:①P<0.05
3 讨 论
T细胞可介导很多与寄生虫感染免疫相关的反应[16]。目前研究已证实辅助性T淋巴细胞(Th)可通过分泌细胞因子介导宿主抗微小膜壳绦虫感染的保护性免疫[1]。IFN-γ作为Th1型细胞主要分泌的细胞因子,在先天性免疫和适应性免疫中都发挥了重要作用[17-18]。有研究发现旋毛虫感染小鼠的第3 d和第6 d,IFN-γ和Th2型细胞因子的表达明显升高,呈现出Th1/Th2混合型免疫应答[19]。Toenjes研究肥头绦虫(Taeniacrassiceps)感染BALB/c小鼠的第3 d、第5 d和第7 d,肠系膜淋巴结细胞的检测结果中发现感染早期IFN-γ增加,随后IFN-γ的表达水平下降,IL-10快速增加[20]。本实验发现微小膜壳绦虫感染第2 d实验组IFN-γ的mRNA相对表达量高于对照组,目前已知微小膜壳绦虫感染小鼠后其虫卵在小肠内经消化液的刺激,六钩蚴破壳而出,钻进肠绒毛,在肠绒毛中逐渐发育,经3~4 d形成似囊尾蚴,据此推测微小膜壳绦虫感染后早期侵入的幼虫在肠绒毛内的发育很可能激发了Th1型免疫应答。本实验发现在感染后第8 d,实验组IFN-γ的mRNA相对表达量明显低于对照组,且小肠组织切片显示肠腔内含有成虫节片,考虑微小膜壳绦虫在肠腔发育为成虫时,宿主的Th1型免疫应答已不占主导地位,但它是否激发了宿主的Th2型免疫应答,还有待进一步研究。
细胞因子IFN-γ被认为与促进调节性T细胞中Sca-1(LY6A)的表达有关[21-22]。本研究发现微小膜壳绦虫感染小鼠后第8 d虫体寄生处小肠黏膜出现急性炎症反应,表现为嗜酸性粒细胞明显增多,而且LY6A的表达水平高于对照组,IFN-γ的表达水平却下降。但是有研究报道LY6A(Sca-1)的RNA表达水平在结肠炎小鼠的肠道上皮细胞中呈现高表达,同时IFN-γ的表达也升高[11]。这与我们的研究结果有矛盾之处,可能反映了内源性IFN-γ在系统感染中作用的复杂性,因为在系统性感染中,T细胞抗原受体(TCR)和其他细胞因子都容易促进LY6A(Sca-1)的表达[12]。弓形虫病中 IFN-γ作为关键细胞因子诱导LY6A(Sca-1)的表达,但使用抗IFN-γ抗体处理弓形虫感染后的小鼠发现IFN-γ的阻断反而增加了LY6A(Sca-1)的表达,可见LY6A(Sca-1)的表达并未因IFN-γ的缺乏而下降,这可能是由于IFN-γ的缺乏导致寄生虫复制和抗原负荷显著增加,从而导致了T细胞活化增加[12]。据此我们推测微小膜壳绦虫感染小鼠后小肠的免疫病理变化是一个复杂的过程,IFN-γ对小鼠小肠LY6A的表达并不起关键作用,LY6A的表达是否受其他因子的调控尚有待进一步研究。
细胞因子所介导的信号通路中有几个共同要素可以最有力地诱导Sca-1(LY6A)的表达,特别是激活STAT1和上调T盒子转录因子(T-bet)表达的能力[23-25]。研究发现STAT1在IFN-γ介导的Sca-1(LY6A)诱导中起关键作用[12]。本研究结果显示感染后第2 d实验组STAT1在mRNA和蛋白水平的表达量均低于对照组,而感染后第8 d实验组STAT1在mRNA和蛋白水平的表达均明显高于对照组,因此推测微小膜壳绦虫感染可激活STAT1的表达,从而在Sca-1(LY6A)的诱导中起作用。
综上所述,本实验发现微小膜壳绦虫感染ICR小鼠小肠后LY6A(Sca-1)的mRNA水平和蛋白水平在幼虫侵入早期呈低表达,成虫期呈高表达;IFN-γ对LY6A的表达不起主导作用,STAT1可能对LY6A(Sca-1)的表达起诱导作用。今后可进一步检测其他细胞因子如Ⅰ IFN和IL-27对微小膜壳绦虫感染小鼠小肠LY6A(Sca-1)表达的影响,并进一步研究LY6A(Sca-1)在促进T细胞活化和迁移中的具体机制。
利益冲突:无
