中国小肠结肠炎耶尔森菌分布及分子流行病学特征
2021-08-06贺兆锴吕东月汤德铭杨晋川景怀琦
穆 慧,段 然,秦 帅,肖 萌,贺兆锴,吕东月,汤德铭,杨晋川,景怀琦,詹 军,王 鑫
小肠结肠炎耶尔森菌是一种重要的人兽共患肠道病原菌,人类感染主要导致急性胃肠炎、肠系膜淋巴结炎等伪阑尾炎症状,有时会出现反应性关节炎或结节性红斑等后遗症[1]。根据是否携带染色体的粘附侵袭基因(ail)、小肠结肠炎耶尔森菌耐热性肠毒素A基因(ystA)以及毒力质粒上的粘附素基因(yadA)、yop调节子的转录活化因子(virF),可分为致病性菌株与非致病性菌株[2-3]。致病性小肠结肠炎耶尔森菌与生物1B、2、3、4、5型有密切关系,其中1B被认为是高致病性,生物2-5型为低致病菌[4]。ail基因通常存在于致病性菌株中,但近年来越来越多的研究在生物1A型菌株中检测到该基因[5-6]。国内学者黄瑛等人[6]报道了ail基因的不同序列型A1型-A3型:A1型与A3型存在于低致病菌与部分生物1A型菌株,A2型存在于高致病菌。小肠结肠炎耶尔森菌最早在美国纽约被报道,此后在世界各国均有发现,是欧洲某些国家腹泻的主要病原菌[7]。我国小肠结肠炎耶尔森菌分布广泛[8-9],在中国的家畜家禽和野生动物等中均有分离,曾引起两次大流行,造成数百人感染[10]。为了解我国小肠结肠炎耶尔森菌的流行分布情况,本研究对从腹泻患者、动物、食品和环境标本来源的小肠结肠炎耶尔森菌进行病原学和脉冲场凝胶电泳(PFGE)分子型别特征分析。
1 材料与方法
1.1 菌株来源 依托国家科技部重大专项与全国小肠结肠炎耶尔森菌病原学监测工作,自1980-2019年中国22个省市自治区,来源于腹泻病人、家畜家禽、野生动物、食品及外环境的标本分离获得6 847株小肠结肠炎耶尔森菌。少部分菌株由福建省疾病预防控制中心于恩庶教授惠赠。
1.2 生化表型、血清型、生物型与毒力基因鉴定 对分离到的菌株使用梅里埃Api-20E进行系统生化鉴定,对鉴定为小肠结肠炎耶尔森菌的菌株进行血清型及生物分型,5种(ail、ystA、ystB、yadA、virF)毒力基因的普通PCR检测[11],生物型分型方法参照文献[12]。采用玻片凝集法进行血清分型,分型血清分别来自日本生研株式会社分型血清(O∶3、O∶5、O∶8、O∶9),丹麦SSI诊断血清(O∶3、O∶5、O∶8、O∶9),本研究组研制的单克隆抗体(O∶3、O∶8、O∶9)及中国生物制品检定所(现更名为:中国食品药品检定研究院)分型血清产品(其他血清型)。自中国医学菌种保藏中心购买的国际参考菌株52203、52211、52212分别用于O∶3、O∶8、O∶9血清型参比。对部分菌株进行ail基因测序,与NCBI参考序列构建Neighbor-joining系统发育树(Mega 5.0)。
1.3 脉冲场凝胶电泳(PFGE)分型 参考中国疾病预防控制中心Pulse Net实验手册,使用NotI进行酶切;电泳脉冲时间:2~20 s;电泳时间:19 h。具体操作步骤见文献[13]。采用非加权配对算术平均法(unweighted pair group average method,UPGMA)进行聚类分析,并构建聚类树。
2 结 果
2.1 来源分布 6 847株小肠结肠炎耶尔森菌主要来源于动物(88.36%,6 050/6 847),其次是腹泻病人(6.44%,441/6 847)、食品(4.76%, 326/6 847)及外环境(0.44%, 30/6 847)。在动物源菌株中,家畜以猪源株占比最高(38.21%,2 616/6 847),野生动物中,啮齿类相对较高(24.46%,1 675/6 847)(表1)。
2.2 生物血清型分布 2 047株致病性小肠结肠炎耶尔森菌仅存在O∶3和O∶9两种血清型,其中O∶3血清型以3/O∶3(87.79%,1 797/2 047)为主,其次为4/O∶3(1.07%,22/2 047)、5/O∶3(0.10%, 2/2 047)型;O∶9血清型以2/O∶9型为主(10.45%,214/2 047),其次为3/O∶9型(0.59%, 12/2 047)。非致病菌4 800株,以生物1A为主(91.4%, 4 387/4 800),生物型2型、3型、4型、5型共计413株(8.6%,413/4 800),血清型众多、占比前5位的O∶8、O∶5、O∶3、O∶6、O∶9依次为10%(480/4 800)9.7%(466/4 800)、5.6%(269/4 800)、1.8%(88/4 800)、1.5%(70/4 800)。
2.3 毒力基因分布 如表1所示,致病株共有两种组合,其中I型占92.67%(1 897/2 047),携带ail、ystA、yadA和virF基因,II型占7.33%(150/2 047),为丢失毒力质粒的致病菌。非致病株以携带ystB基因的III型和所有毒力基因均不携带的IV型占比较高,分别占62.83%(3 016/4 800)、36.19%(1 737/4 800)。上述4种典型的基因型别(I、II、III、IV)在所有调查的22个省份多有分布。此外,非致病株还存在仅携带ail基因(VI型)或同时携带ail和ystB基因(V型)的菌株分布于个别省份。对这两类菌株的ail进行CDS测序,并与NCBI中的参考序列构建系统进化树,结果显示VI型[14]菌株的ail基因与已发表的A1序列型相同,V型菌株ail基因与既往发表的A1、A2、A3型序列均不相同[6],为新的ail序列型。
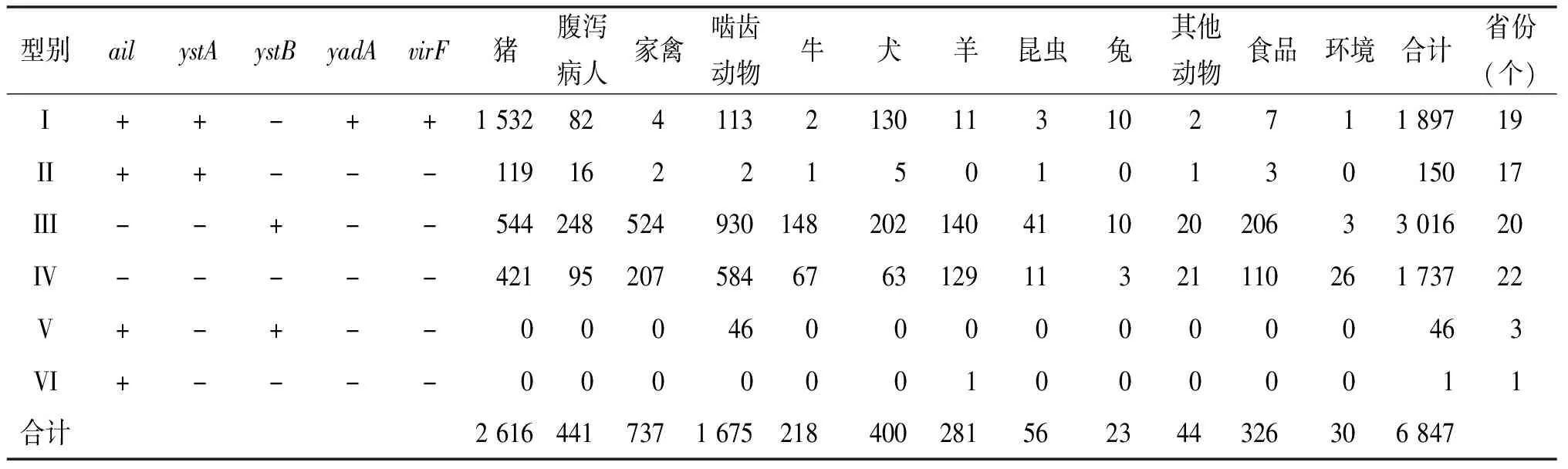
表1 不同来源小肠结肠炎耶尔森菌毒力基因分布
2.4 地域分布特征 本研究自22个省市自治区分离到小肠结肠炎耶尔森菌,其中非致病菌在22个省份均有分布,致病菌分布19个省市自治区、分别位于华东(江苏、浙江、安徽、山东、上海)、华北(北京、天津、内蒙古)、西北(青海、宁夏)、西南(四川、贵州、云南)、东北(吉林、黑龙江)华南(福建、广西)、华中(江西、河南)。不同省份致病性菌株的优势血清型存在不同,18个省市自治区以O∶3血清型为主,宁夏以O∶9血清型略占优势。
2.5 生化反应 系统生化结果显示致病株与非致病株的主要生化编码不存在交叉,如致病株的主要生化编码1014522、1014520、1015523等未见于非致病株的主要生化编码,非致病株的主要生化编码1155723、1155523、1114523未见于致病株的主要生化编码(表3)。比较两类菌株占比前10位的生化编码发现,非致病菌普遍比致病性菌株具有更多的阳性生化反应。致病株中,O∶3血清型的主要生化编码为1014522、1014520、1015523,O∶9血清型的主要生化编码为1154523。
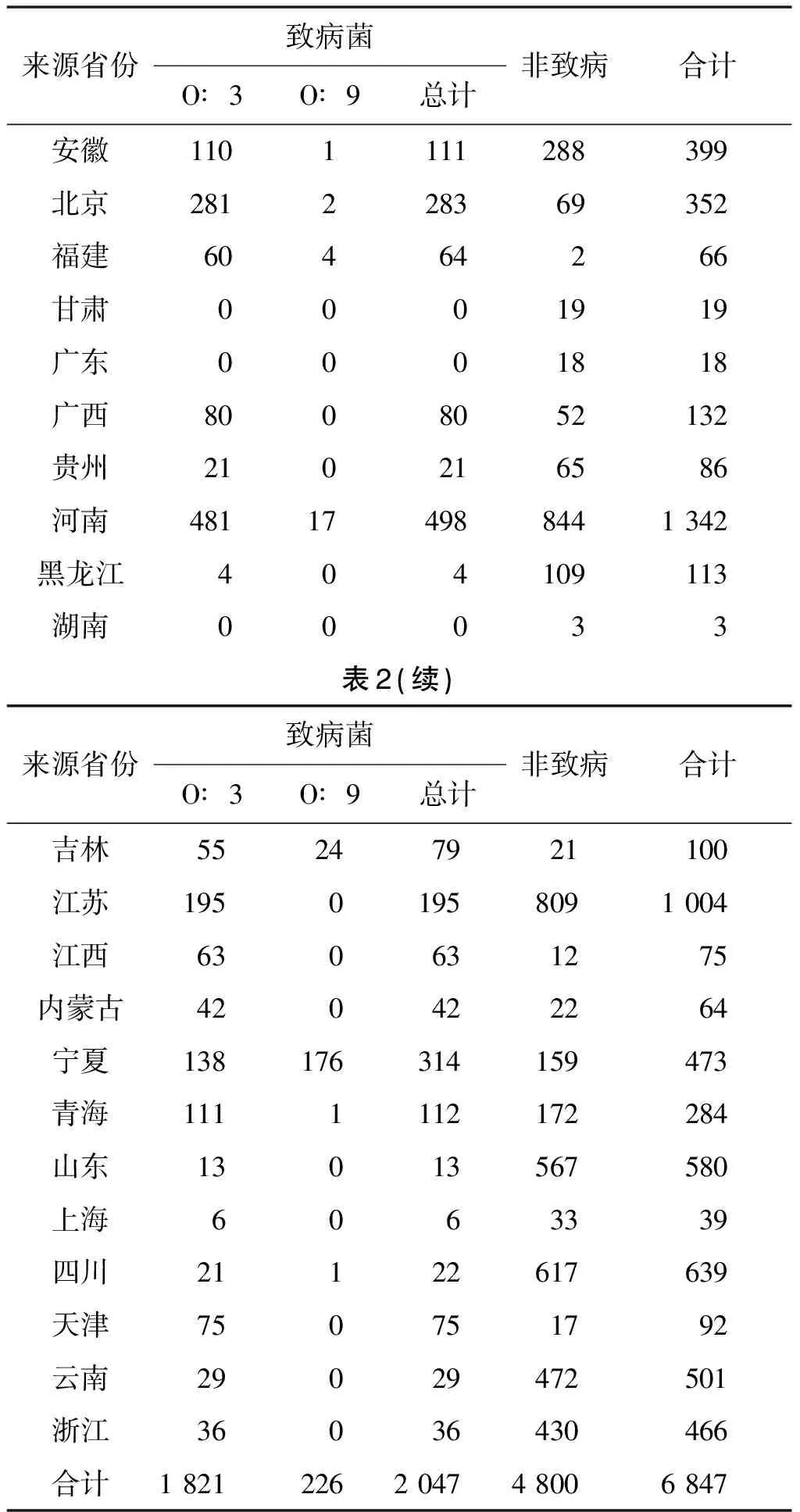
表2 致病性与非致病性小肠结肠炎耶尔森菌在不同省市自治区的分布
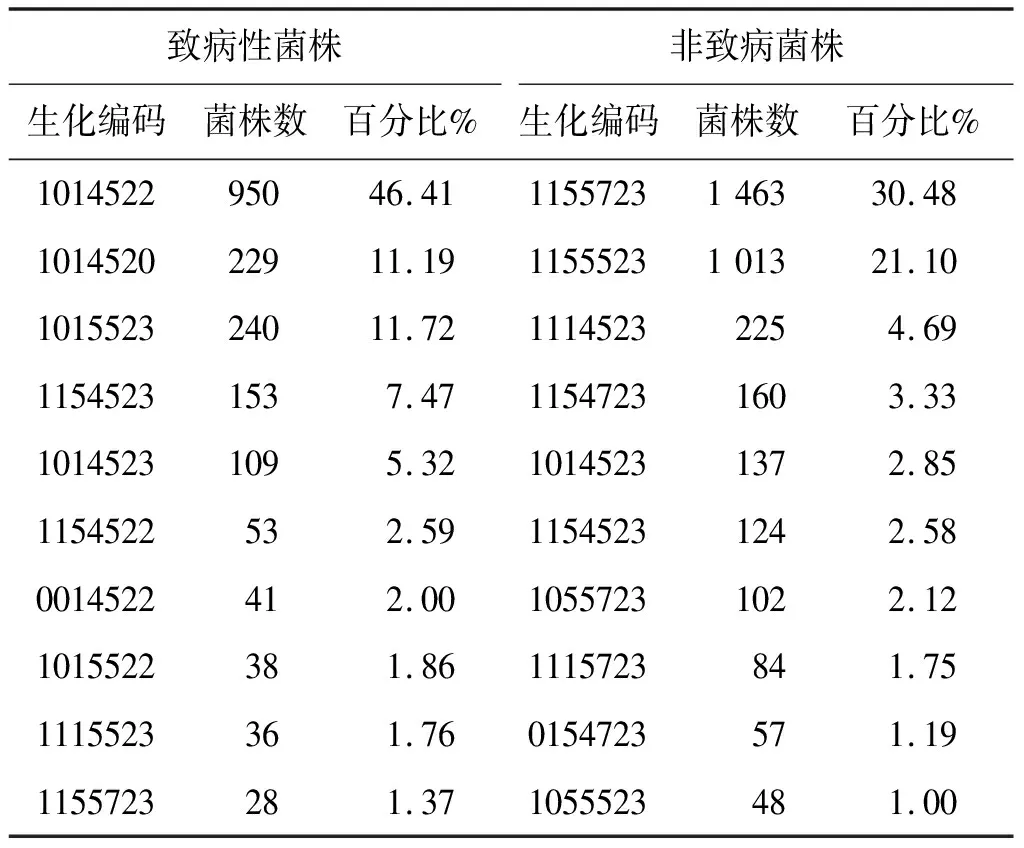
表3 占比前10位的致病性、非致病性小肠结肠炎耶尔森菌生化编码
2.6 PFGE分型结果 依次分析O∶3血清型与O∶9血清型致病性小肠结肠炎耶尔森菌PFGE型别。1 821株O∶3致病株酶切为93种带型,占比前5的带型依次为K6GN11C30021、K6GN11C30012、K6GN11C30068、K6GN11C30042、K6GN11C30058,分别占比46.35%(844/1 821)、22.5%(410/1 821)、4.89%(89/1 821)、4.23%(77/1 821)、1.65%(30/1 821)。优势带型K6GN11C30021、K6GN11C30012地域分布最广泛,分布于17个省市自治区,K6GN11C30012型别的小肠结肠炎耶尔森菌宿主分布最广泛,除了分布于腹泻病人、家畜家禽及食品,啮齿动物和兔中也有分布且为这两种宿主的优势带型。对89株来源于腹泻病人的小肠结肠炎耶尔森菌菌株进行分析,88.76%(79/89)的人源株与分离自动物或食品的分离株共有20种相同的带型;75.38%(67/89)人源菌株与当地的动物或食品具有相同的带型。其他人源株暂未发现与动物及食品菌株一致的带型。
226株O∶9血清型菌株分为14个带型,占比前5的带型依次为K6GN11C90008、K6GN11C90010、K6GN11C90018、K6GN11C90004、K6GN11C90003,分别占比26.11%(59/226)、23.89%(54/226)、21.24%(48/226)11.06%(25/226)、7.52%(17/226),其中与人相关的带型有5种(图1),3种带型K6GN11C90003、K6GN11C90004、K6GN11C90008为人源菌株与当地动物或食品中菌株共有,涉及77.78%(7/9)人源菌株。
3 讨 论
小肠结肠炎耶尔森菌是一种重要的人类肠道致病菌,本研究对6 847株菌进行病原学与脉冲场凝胶电泳分子分型特征分析发现,我国小肠结肠炎耶尔森菌地域分布广泛,宿主众多,在腹泻病人、家畜家禽、及野生动物中都有分布,众所周知,猪为小肠结肠炎耶尔森菌的主要宿主[15-17],农家犬可能是我国致病性小肠结肠炎耶尔森菌感染的重要来源[18-19]。农家犬携带的致病性菌株比例较高、与腹泻患者及猪分离株具有相似的带型模式(图2),部分地区的犬分离株与腹泻患者及猪分离株具有相同的PFGE带型(图1),提示农家犬与人类感染密切相关。既往研究表明致病性小肠结肠炎耶尔森菌分布具有地域差异,主要分布于北方寒冷地区[20],本研究显示分布于我国华东、华北、西北、西南、华南等地区均检出致病性小肠结肠炎耶尔森菌,初步推测随着时间的迁移,致病性菌株的分布可能已经没有明显的地域差异,这可能与经济发展,各地区间交通贸易往来频繁有关。

(红色为人源株相关信息)
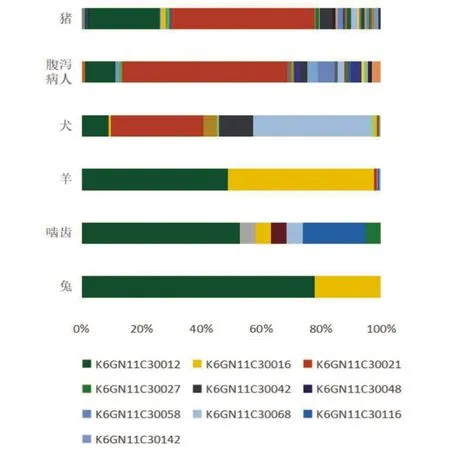
图2 宿主来源占比前6位的O∶3血清型致病性小肠结肠炎耶尔森菌PFGE带型构成(图注仅包含前10种带型)
不同国家地区的小肠结肠炎耶尔森菌生物血清型分布不同,欧洲、日本、加拿大等国家4/O∶3占主导地位[21-22]。本研究表明,中国致病性菌株仅存在于O∶3与O∶9血清型中,其中O∶3型菌株1 821株,O∶9型菌株226株,以3/O∶3型为主要生物血清型,其次为2/O∶9。3/O∶3型致病菌多分离自猪源株,而2/O∶9型致病菌主要分离自啮齿类,提示不同宿主动物可能对不同生物血清型菌株的易感性存在差异。生化结果显示致病性菌株与非致病菌的主要生化编码不存在交叉,非致病菌普遍比致病性菌株具有更多的阳性生化反应,表明其可能具有更强的生化代谢能力与环境适应力。致病株中,O∶3血清型与O∶9血清型的主要生化编码亦不存在交叉,表明二者可能具有不同的生化分解能力与生态位。
位于染色体上的ail、ystA基因和位于毒力质粒上的yadA、virf基因决定了小肠结肠炎耶尔森菌的致病性[23],后者在人工传代中容易丢失[3]。ail基因既往仅存在于致病菌中,但越来越多的研究在生物1A型菌株中发现该基因[24],如德国的生猪肉,芬兰病人与食品分离株[25-26]。国内学者黄瑛等人[6]报道了致病性小肠结肠炎耶尔森菌中ail编码序列(CDS)A1型-A3型:A1型存在于低致病菌与部分生物1A型菌株,A2型存在于的高致病菌、与A1型相比有21个碱基突变,A3型来自我国低致病菌,与A1型相比存在3个碱基突变。本研究发现多个省份的非致病菌中存在ail基因,只携带ail基因的菌株与黄瑛等人[6]报道的A1序列型相同,同时携带ail、ystB基因的菌株与既往发表的A1、A2、A3等序列均不相同[6],为新的ail序列型。
中国致病性小肠结肠炎耶尔森菌PFGE型别多样,不同地区的PFGE带型既有共性,又有独特性,提示小肠结肠炎耶尔森菌的基因有一定的遗传稳定性及多态性[27]。O∶3血清型菌株的聚类相似性为79.63%,O∶9血清型菌株聚类相似性为83.25%,说明O∶3血清型菌株的PFGE型别更多样化。来自于19个省市自治区的O∶3血清型菌株,酶切为93种带型,分布较广的带型有5个,菌株数目占比79.63%,其中K6GN11C30021、K6GN11-C30012为优势带型,分别占比46.35%、22.5%。K6GN11C30021是人感染小肠结肠炎耶尔森菌株的主要带型,也是猪和犬的主要带型。K6GN11C30012带型宿主分布最广泛,除了分布于腹泻病人、家畜家禽及食品中,啮齿类和兔源株中也有分布且为这两种宿主的优势带型。不同带型的菌株地域分布范围具有差异:K6GN11C30021、K6GN11C30012分布最广泛、均分布于17个省市自治区,其次为K6GN11C30042(13个省)、K6GN11C30068(8个省)、K6GN11C30058(5个省),而K6GN11C30064仅分布于广西,K6GN11C30051仅分布于江苏。不同宿主中带型种类最为多样的为猪源菌株,其次为人和犬分离菌株。毒力质粒的丢失不影响PFGE带型。
不同地区人源菌株PFGE型别分析发现,共有14个省份的人源菌株与当地动物、食品分离株具有相同的PFGE型别,提示动物或食品分离株与人类感染间可能存在关联。O∶3血清型人源菌株分布于14个省份共有20种带型,多数省份人源菌株具有2种以上带型,在当地动物、食品分离株发现相同带型。O∶9血清型人源菌株分布于5个省份共有5种带型,4个省份在当地动物、食品分离株发现相同带型。因此应加强动物及食品的监测力度,防止人群通过染疫的动物及食品感染。
利益冲突:无
