从线粒体凋亡通路探讨参附注射液对脓毒症小鼠心肌损害的影响
2021-07-18徐坡谢靖彭媛陆士奇
徐坡 谢靖 彭媛 陆士奇
脓毒症是严重创伤、重症感染等多种危重疾病应激状态下的常见并发症,具有高发病率,高死亡率的特点,其高死亡率与它易致多脏器功能损伤直接相关。40%~50%的脓毒症可导致心功能不全[1],心肌细胞损伤是脓毒症心功能不全发生的主要原因,细胞凋亡在脓毒症的发生、发展中起重要作用,早在2008年Flierl MR等[2]的研究就证明抗凋亡治疗有逆转脓毒症心肌损伤的作用。本研究通过观察参附注射液对脓毒症小鼠心肌细胞凋亡指数、心肌线粒体超微结构及心肌组织B细胞淋巴瘤/白血病-2基因(B-cell lymPhoma-2,Bcl-2)、BH3介导的死亡域激动剂(BH3 interacting-domain death agonist,Bid)、截短型Bid(truncated Bid,tBid)、半胱胺酸-天门冬胺酸酶(cysteine-dePendent asPartate-sPecifc Proteases-9,Caspase-9)蛋白表达的影响,从线粒体凋亡通路探讨参附注射液对脓毒症小鼠心肌线粒体损伤的保护作用及其机制。
1 材料与方法
1.1 动物
选取56只5~6周龄SPF级雄性C57/B6J小鼠[由常州卡文斯实验动物有限公司提供,许可证号:SCXK(苏)2016-0010。动物合格证编号:201915419],动物饲养在苏州大学附属第一医院实验动物中心,温度22~24℃、相对湿度为40%~70%的SPF环境中,自由进食和饮水,适应性喂养1周后进行实验。
1.2 分组与造模
56只雄性C57/B6J小鼠被随机分为4组,具体分组如下:正常对照组9只(NC组,不做任何处理);假脓毒症组9只(Sham组,腹腔注射溶媒);脂多糖(Lipopolysaccharides,LPS)腹腔注射诱导脓毒症模型组12只(LPS组);LPS造模+参附注射液腹腔注射组(SFI组)26只。造模予LPS(sigma L2880)按8 mg/kg单次腹腔注射LPS溶液;SFI组在造模前24小时、12小时、6小时分别腹腔注射参附注射液(雅安三九药业有限公司,剂量按10.0 mL/kg进行)。除NC组外,另外3组别动物,每组分别于造模后6小时,12小时各处死3只,剩余动物和全部对照组动物,于实验24小时全部统一处死取材,并按要求保存。所有动物实验均得到苏州大学实验动物保护协会批准。
1.3 电镜观察小鼠心肌超微结构
选用仪器:透射电镜(日本电子JEM1400型);超薄切片机(leica UC-7);数码相机(EMSIS,morada G3)。取1 cm3心肌组织若干块,于戊二醛中固定(2.5%),倒掉固定液入PBS缓冲液,1%锇酸后固定2小时,乙醇梯浓度脱水(30%、50%、70%、80%、95%、100%),环氧丙烷和环氧树脂1∶1浸透,纯环氧树脂包埋入烤箱,超薄切片(70 nm),铅铀染色。JEM1400型透射电镜(日本)观察心肌超微结构,数码相机(EMSIS,morada G3)拍照。
1.4 苏木精—伊红染色
心肌组织样本放置于4%甲醛中固定,梯度乙醇脱水,二甲苯2次透明,浸蜡,石蜡包埋切片,厚度在4 μm;铺片,烤片,脱蜡,苏木精浸染,冲洗,0.5%氨水返蓝,伊红染色,冲洗,脱蜡,封片,晾干。于显微镜下观察不同视野病理切片状态,不同倍数下拍照,分析病理结果。
1.5 TUNEL 法检测心肌细胞凋亡
取石蜡包埋的心肌组织4 μm切片,以TUNEL法按试剂盒说明进行心肌组织切片细胞凋亡检测。具体方法如下:先将硬石蜡包埋的切片进行二甲苯脱蜡,逐级乙醇脱水。用PBS润洗样本3次,滴加100 μL 1×Equilibration Buffer,室温孵育30分钟。解冻FITC-12-dUTP Labeling Mix,加入缓冲液;37℃孵育60分钟,避免光照;移除封口膜,切片置于PBS溶液中室温孵育5分钟;重复该步骤1次;染色,洗涤样本,室温放置5分钟,重复两次,在荧光显微镜(OLYMPUS IX53)下分析样本(×100),选择有意义的组织,经登录、编号、采集、分析、读取数据。
1.6 蛋白质免疫印迹法
将研碎的心肌组织加入细胞裂解液,低温匀浆,离心,应用SDS-PAGE进行蛋白分离,30%丙烯酰胺凝胶中电泳,CD63、CD81-200 mA、70分钟条件下电转膜,TBST封闭液浸泡PVDF膜于Bcl-2、Bid、tBid一抗中(稀释比例分别为1∶1000、1∶1000、1∶2000),4℃孵育过夜。再加入HRP标记二抗(稀释比例为1∶50000),进行免疫反应,ECL显色系统显色,保存结果图片,用Image J图像分析软件分析胶片灰度值。以上小鼠心肌病理损伤检测每组均选取3只小鼠的心肌组织进行。
1.7 统计学处理
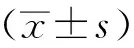
2 结果
2.1 各组小鼠脓毒症心肌损伤模型鉴定
通过预实验及天津市心血管中心发表的脓毒症心肌损伤小鼠模型建立和评价[3]证实建模方法可靠,实验结果显示脓毒症小鼠心肌组织在光镜和电镜下均可见心肌小血管周围大量炎性细胞浸润,心肌肌丝紊乱,细胞间质水肿等表现。
2.2 透射电镜下各组小鼠心肌超微结构改变情况
电镜显示,对照组心肌肌丝排列规则、整齐,粗细相见,各条带均较清楚,肌节结构正常,线粒体丰富,分布在肌丝之间,大小正常,形状多为圆形和椭圆形,线粒体的嵴很密集,平行排列,基质内有较多致密的基质颗粒。Sham组与对照组相比无明显区别,脓毒症小鼠心肌肌丝紊乱,线粒体肿胀明显,部分出现“空泡样变”、边界不清晰、基质密度降低、不均匀等。造模后12小时LPS模型组小鼠线粒体改变最严重,线粒体平均面积和体密度明显增大,和Sham组相比差异具有统计学意义(P<0.05)。经过参附注射液处理小鼠心肌线粒体有明显缓解情况,空泡样变明显减少,线粒体肿胀有所缓解,参附组较Sham组相比线粒体立体计量指标均有明显下降,差异具有统计学意义(P<0.05)。详情见图1及表1。
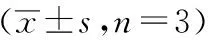
表1 各组别线粒体立体计量比较
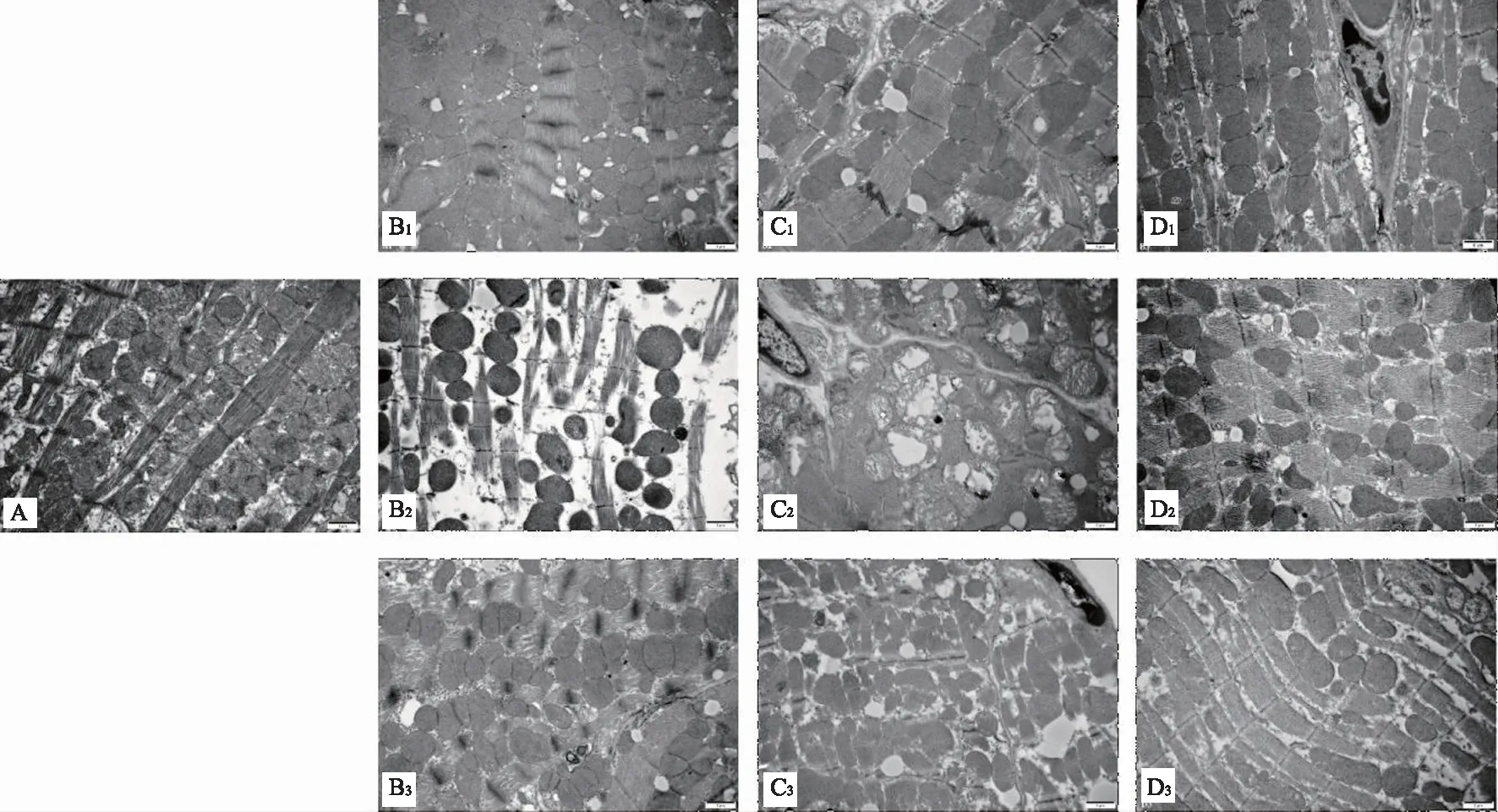
注:A:正常对照组;B:Sham组;C组:LPS组;D组:SFI组;阿拉伯数字1、2、3分别对应相应组别的6小时、12小时、24小时。A组为正常对照组,只选取24小时进行心肌切片,故只有1张图片图1 电镜下各组小鼠心肌超微结构影响(1 μm)
2.3 光镜下各组小鼠心肌细胞凋亡情况
HE染色结果:与正常对照组相比,Sham组心肌结构大致正常,LPS组心肌组织可见结构破坏、纤维不完整、肌质溶解、局部心肌坏死,间质水肿以及炎性细胞浸润,心肌细胞空泡样变;SFI组心肌结构基本完整,心肌纤维断裂减少,间质水肿明显好转,炎性细胞浸润明显改善,病理损害明显减轻。详细情况详见图2。
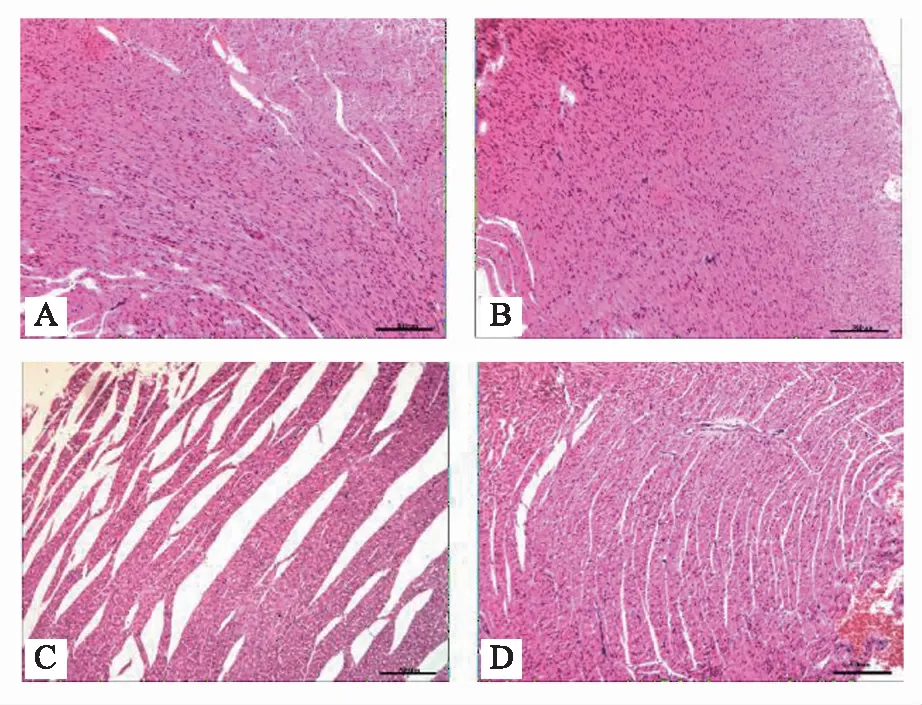
注:A:正常对照组;B:假脓毒症组(Sham);C:脓毒症模型组(LPS);D:参附组(SFI)图2 各组小鼠心肌细胞HE染色(×100)
TUNEL染色结果:TUNEL检测心肌细胞凋亡,正常细胞核呈淡蓝色,形态清晰、完整。凋亡细胞核呈荧光色,研究显示,与正常对照组相比,Sham组心肌组织凋亡无明显变化,LPS组、SFI组小鼠心肌细胞 TUNEL 凋亡率均高于Sham组(P<0.05),但SFI组较LPS组凋亡率明显下降(P<0.05)。详细情况详见图3。
2.4 各组小鼠心肌组织Bcl-2、Bid、tBid、Caspase-9表达水平变化
与对照组比较,造模后12小时LPS组小鼠心肌Bcl-2表达明显抑制(P<0.05),Bid、tBid、Caspase-9表达上调明显(P<0.05);SFI组小鼠心肌Bcl-2表达较LPS组明显增强,差异具有统计学意义(P<0.01),同时SFI组Bid、tBid、Caspase-9表达较LPS组降低,差异有统计学意义(P<0.01)。具体见图4及表3。
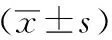
表2 各组小鼠心肌细胞凋亡率的比较
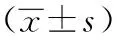
表3 各组小鼠不同时间点心肌组织Bcl-2、Bid、tBid、Caspase-9灰度值比较
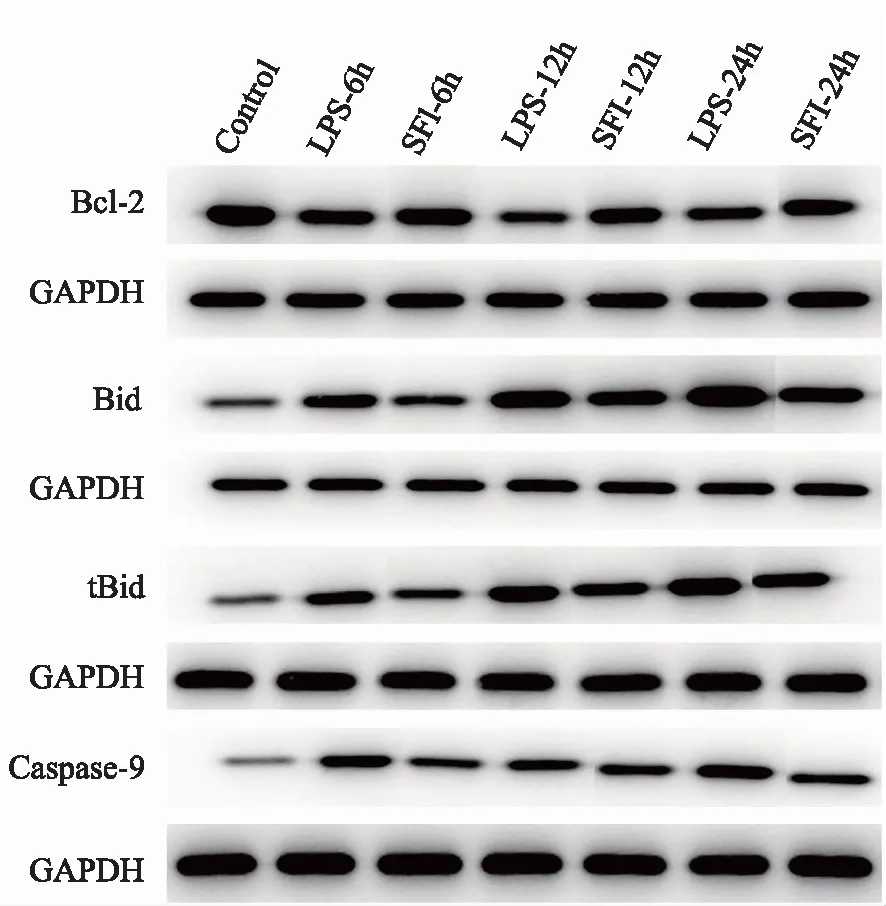
图4 各组小鼠不同时间点心肌组织Bcl-2、Bid、tBid、Caspase-9蛋白表达
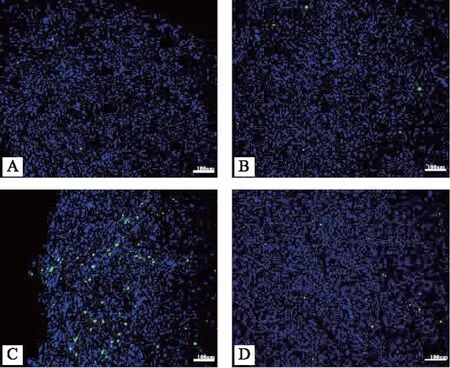
注:A:正常对照组;B:假脓毒症组(Sham);C:脓毒症模型组(LPS);D:参附组(SFI)图3 各组小鼠心肌细胞TUNEL检测及凋亡率比较(×100)
3 讨论
脓毒症,是宿主对感染产生的失控反应,并出现危及生命的器官功能障碍。心脏是脓毒症损伤中最为重要的靶器官。研究指出20%~60%的脓毒症可发生心肌抑制[1],脓毒症诱导的心肌功能障碍(sepsis induced myocardial dysfunction,SIMD)死亡率更是高达50%~70%,心功能对脓毒症患者的预后判断起关键作用。目前关于脓毒症心肌损伤的机制研究方向繁多,归根结底,不同机制最终都会导致心肌细胞凋亡,这是脓毒症心肌损伤的关键原因。
Bcl-2家族包括多结构域抗凋亡蛋白(BH1-BH4),多结构域促凋亡蛋白(BH1-BH3)和促凋亡BH3-only蛋白三大类。促凋亡成员和抗凋亡成员之间的相互平衡被破坏导致了凋亡的发生。当抗凋亡蛋白占优势时,便可调节线粒体膜通透性,抑制凋亡发生。Bcl-2是其家族中最重要的抗凋亡蛋白,孙彬栩等[4]以及Zhang N等[5]的研究指出,Bcl-2可通过编码自身蛋白而具有抗心肌细胞凋亡的功能。Bid是只含有BH3结构域的促凋亡蛋白,它能裂解形成tBid,激活Caspase级联反应,引发细胞凋亡[6]。罗敏等[7]研究中,右美托咪定预处理的方式可促使心肌缺血再灌注损伤大鼠心肌组织中Bcl-2蛋白过表达,诱导Bax蛋白表达下降,最终有助于改善大鼠心肌缺血再灌注损伤。而陈华文等[8]对脓毒症大鼠应用丹参酮ⅡA,发现脓毒症大鼠心肌细胞Bcl-2蛋白表达会上调,心肌细胞凋亡则会相应减少。本研究表明,小鼠注射LPS后通过促凋亡蛋白(Bad、t-Bid)激活细胞凋亡(Caspase-9),同时减少抗凋亡蛋白Bcl-2,增加TUNEL凋亡细胞数,这些结果与之前报道一致。
参附注射液是一个由红参、附片提取制成,被广泛用于休克、心跳呼吸骤停、心力衰竭等急危重症的中药注射剂[9-11],并且因为大量的循证医学证据,被众多国内急危重症治疗指南[12-13]收录。参附注射液的药理成分主要是人参皂苷[14]。研究证实参附注射液给药剂量与体内暴露量呈线性关系,多次给药不影响药物体内代谢、无蓄积[15]。其作用包含了改善循环、干预血流动力学、保护脏器细胞、减轻炎症反应、抗氧化应激、增强免疫、减轻肿瘤药物化疗的外周毒性作用等方面。本研究应用参附注射液可减轻脓毒症小鼠的心肌损伤,开拓了参附注射液的应用范围。本研究清楚地表明,与LPS组比较,SFI组小鼠心肌 Bcl-2 表达明显上调,同时SFI组Bid、tBid、Caspace9表达较LPS组明显降低(P<0.01)。Bcl-2水平的升高反映了线粒体对凋亡的易感性下降,且SFI组小鼠Bcl-2/Bid以及Bcl-2/tBid较LPS组明显升高,说明参附注射液可以使Bcl-2的抗凋亡作用在细胞内占优势。故参附注射液可以通过上调心肌细胞 Bcl-2 表达,下调Bid表达,抑制tBid活化,抑制Caspase-9释放,减少脓毒症小鼠心肌线粒体凋亡,反映SFI对线粒体凋亡的保护作用。此外,通过电镜还观察到脂多糖诱导的线粒体肿胀被SFI减轻,线粒体平均面积以及线粒体体密度均明显下降,支持了SFI对线粒体凋亡的作用。
综上,SFI可通过增加Bcl-2的表达,降低Bid、t-Bid的表达,改善LPS诱导的线粒体形态,保护线粒体的完整性,阻止caspase-9释放,减少脓毒症小鼠心肌细胞凋亡,减轻与脓毒症相关的心肌损伤。
