基质匹配曲线校正-HPLC-MS/MS法同时测定干性食品包装纸中8 种甜味剂
2021-07-08廖惠云马梦婕毛淑蕊朱怀远陈晶波朱龙杰袁益来
廖惠云,吴 洋,马梦婕,毛淑蕊,朱怀远,陈晶波*,张 华,曹 毅,朱龙杰,袁益来
(江苏中烟工业有限责任公司,江苏 南京 210019)
近年来,非营养性合成甜味剂的消费增加已成为全球趋势[1]。为改进食品口味和食用性质,食品包装纸常会施加人类喜好的甜味剂[2-3]。我国食品添加剂相关标准允许使用十余种合成甜味剂,并对其在不同基质食品中的使用量进行了限定[4]。合理使用人工合成食品甜味剂是安全的,不会对食用者的健康产生风险。但如果超限量、超范围,或者使用劣质的人工合成食品甜味剂,则会对消费者的身体健康产生负面影响[5-7]。因此,建立一种具有高通量、高准确度、高灵敏度的甜味剂检测方法,加强监测纸质食品包装材料中甜味剂的应用情况就显得尤为必要。
目前,对于甜味剂的测定主要集中于饮料、白酒、乳制品等食品基质[8-9]。分析方法分别有液相色谱法[10-11]、离子色谱法[12-14]、毛细管电泳法[15-17]、气相色谱法[18-21]等,主要以液相色谱法为主。由于不同甜味剂的物理化学性质、电化学性质和光谱性质存在显著差异,液相色谱法很难满足多种甜味剂同时检测要求,离子色谱法、毛细管电泳法等也由于灵敏度低等原因应用不多。随着各国对甜味剂使用要求越来越严格,使得开发更为简单快速、灵敏度高的检测方法成为必要。由于液相色谱-串联质谱技术具有检测通量大、准确、灵敏的特点,被广泛用于食品领域的检测,运用该技术同时分析多种甜味剂已经成为一种趋势[22-27]。然而,在分析基质复杂样品时,样品本身所带来的基质效应给质谱分析带来一定挑战,必须采用适当的措施降低或消除样品基质效应,以确保分析结果的可靠性及准确性。
考虑到现代食品工业对甜味剂的使用都以多种复配的形式添加。因此,在参考相关研究基础上[28-29],基于优选样品前处理方式和目标物检测效率考虑,创新采用基质匹配溶剂标准曲线定量,使用高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)仪同时测定干性食品包装纸中安赛蜜、糖精钠、甜蜜素、三氯蔗糖、阿斯巴甜、新橙皮苷二氢查尔酮、纽甜、甜菊糖苷8 种甜味剂的含量。该方法基本上排除了基质效应的影响,具有简单、快捷、准确可靠的特点。在确保检测结果质量的同时,也在很大程度上提高了检测效率,适用于干性食品包装纸中甜味剂的监测。
1 材料与方法
1.1 材料与试剂
包装材料用原纸由高邮卫星卷烟材料有限公司提供;市售不同品牌共10 个不同规格糖果、巧克力用干性食品包装纸。
甲醇、乙腈(均为HPLC级) 美国Tedia公司;甲酸、三乙胺(均为色谱纯)、乙酸铵(分析纯) 国药集团化学试剂有限公司;安赛蜜(CAS号为33665-90-6)、糖精钠(CAS号为128-44-9)、甜蜜素(CAS号为139-05-9)、三氯蔗糖(CAS号为56038-13-2)、阿斯巴甜(CAS号为22839-47-0)、新橙皮苷二氢查尔酮(CAS号为20702-77-6)、纽甜(CAS号为165450-17-9)及甜菊糖苷(CAS号为57817-89-7)均为标准品,含量≥98.0%,分别购自美国Aladdin公司、美国Sigma-Aldrich公司和北京百灵威科技有限公司。
1.2 仪器与设备
1260/6460 高效液相色谱-三重四极杆质谱仪(配备电喷雾电离源) 美国Agilent公司;KQ-500DE超声波发生器 昆山市超声仪器有限公司;TDZ4A-WS离心机 湘仪实验室仪器开发有限公司;T201电子天平(感量0.000 1 g) 瑞士Mettler-Toledo公司;Milli-Q超纯水系统 美国Millipore公司。
1.3 方法
1.3.1 标准工作溶液配制
1.3.1.1 基质匹配溶剂
取包装材料用原纸,准确裁取面积为4 cm×4 cm试样,将其剪碎成约1 mm×1 mm大小纸片,并全部转移至50 mL具塞锥形瓶中,准确加入10 mL甲酸-三乙胺缓冲溶液(pH 4.5),于60%功率条件下超声萃取45 min,结束后摇匀,静置片刻,经0.22 µm水相滤膜过滤,得基质匹配溶剂。
1.3.1.2 标准工作溶液
分别准确称取40 mg安赛蜜、50 mg糖精钠、30 mg甜蜜素、60 mg三氯蔗糖、40 mg阿斯巴甜、20 mg新橙皮苷二氢查尔酮、10 mg纽甜、30 mg甜菊糖苷(精确至0.1 mg),转移至100 mL容量瓶中,用基质匹配溶剂稀释并定容至刻度,混匀,制得8 种甜味剂混合标准储备液。再分别准确移取标准储备液10、25、50、250、500 µL和1 000 µL,用基质匹配溶剂稀释定容至10 mL容量瓶中,配制得到6级标准工作溶液。
1.3.2 样品前处理
将0.8 mL甲酸加入1 L水中,然后在搅拌的状态下用约2.5 mL三乙胺调pH值至4.5,配制成三乙胺缓冲溶液。然后,取干性食品包装用纸,裁取面积为4 cm×4 cm试样,并准确称其质量(精确至0.1 mg),将其剪碎成约1 mm×1 mm大小纸片,并全部转移至50 mL具塞锥形瓶中,准确加入10 mL三乙胺缓冲溶液,浸润1 h,然后于60%功率条件下超声萃取45 min,结束后摇匀,试样溶液4 000 r/min离心5 min,静置片刻,取上层清液得样品进样液,待上机分析。
1.3.3 仪器分析
色谱柱:ZORBAX Eclipse XDB-C18柱(150 mm×4.6 mm,3.5 μm);柱温:40 ℃;进样量:5 µL;流速:0.4 mL/min:流动相:A相为甲醇,B相为5 mmol/L乙酸铵溶液;梯度洗脱程序:0~8 min为30% A和70% B,8.1~30 min为60% A和40% B,30.1~35 min为80% A和20% B,35.1~40 min为30% A和70% B。离子源:电喷雾离子源;离子源温度:100 ℃;干燥气温度:300 ℃;干燥气流量:9 L/min;雾化气压力:275.79 kPa;毛细管电压:正离子为4 000 V,负离子为3 500 V;检测方式:多反应监测模式(multiple reaction monitoring,MRM)。
2 结果与分析
2.1 质谱条件优化
取高浓度混合标准溶液,在电喷雾离子源正负离子模式下进行质谱全扫描检测,得出被测化合物一级质谱图,结果显示:阿斯巴甜[M+H]+和纽甜[M+H]+在正离子模式丰度较高,而安赛蜜[M-K]-、糖精钠[M-Na-2H2O]-、甜蜜素[M-Na]-、三氯蔗糖[M-2H]-、新橙皮苷二氢查尔酮[M-H]-、甜菊糖苷[M-H]-在负离子模式丰度较高,选择每个化合物丰度最高的特征离子为其对应的母离子。在优选的离子模式下对各化合物进行选择离子扫描,对裂解电压进行优化。得到合适的裂解电压后,进行二级质谱扫描确定其子离子,选取两组特征离子作为定量和定性子离子,其中安赛蜜、甜蜜素、三氯蔗糖、新橙皮苷二氢查尔酮和甜菊糖苷裂解时得到的碎片离子较少,依据丰度较强、信号稳定的原则,分别选择m/z162、177、94.3、610.7、802为其定性子离子。最后分别进行碰撞能量优化,得到安赛蜜、糖精钠、甜蜜素、三氯蔗糖、阿斯巴甜、新橙皮苷二氢查尔酮、纽甜、甜菊糖苷8 种甜味剂的较佳质谱参数,如表1所示。
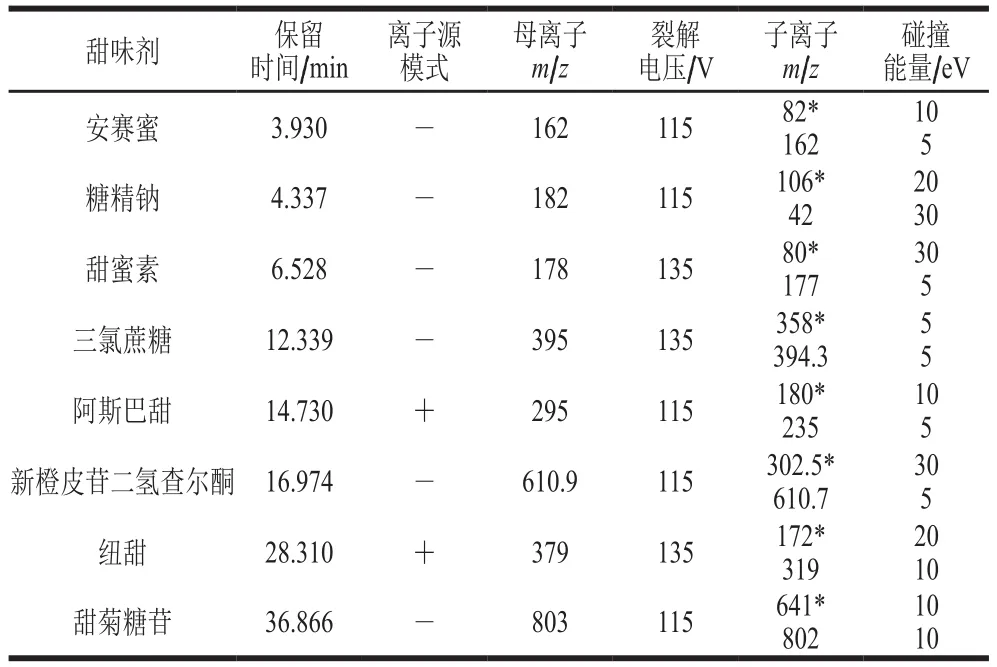
表1 8 种甜味剂的MRM参数Table 1 MRM MS parameters for eight sweeteners
2.2 色谱条件优化
一般来说,反相色谱的流动相常由水和有机溶剂(如甲醇、乙腈)等组成,由于部分被测物质极性较强,流动相的洗脱能力刚开始不宜过强,同时待分离的8 种甜味剂有些极性相近,保留时间相近,采用乙腈为有机相时易导致个别组分共流出情况较甲醇严重,而甲醇可使8 种甜味剂保留时间相对延迟,同时考虑到各目标物的峰面积响应相差不大,且乙腈的毒性较甲醇大,故选择甲醇为实验的有机相。进一步,由于流动相要进入质谱仪,添加一定量的缓冲溶液可以增加响应值,所以考虑甲醇-水溶液、甲醇-乙酸铵溶液、甲醇-甲酸溶液3 种流动相体系。以目标物在色谱柱上的分离度、峰形、灵敏度等为考察指标,对3 种流动相体系进行比较。结果表明,体系中添加乙酸铵,不仅更有利于目标物在色谱柱上的保留,而且能够提高部分物质的电离化程度,增加信号响应,从各目标物分离度、峰形、响应值以及保留时间的稳定性等指标进行综合衡量,甲醇-乙酸铵溶液作为流动相时(图1),各目标物色谱峰出峰情况良好,色谱峰峰形、响应强度以及分离效果总体上优于其余两种流动相。因此,本研究为了避免较高浓度的缓冲盐体系对质谱的影响,在满足要求的情况下选用甲醇-5 mmol/L乙酸铵溶液为流动相进行梯度洗脱。

图1 MRM模式下种8 种甜味剂总离子流色谱图Fig.1 Total ion current chromatograms of eight sweeteners under MRM mode
2.3 样品前处理优化
综合考虑8 种甜味剂的理化性质,可知阿斯巴甜、纽甜等二肽类化合物一般在pH 3~5环境下较为稳定[9],因此以食品包装纸样品对象,添加一定量的混合标准溶液,考察纯水和三乙胺缓冲溶液作为溶剂对目标物萃取效率的影响,结果见表2。可以看出,样品溶液中大部分甜味物质检测结果较为一致,唯有阿斯巴甜的检测结果分别为1.55 µg/mL和1.87 µg/mL,两者相差较大。这可能与目标物所处的环境有关,即阿斯巴甜主要是由天冬氨酸和苯丙氨酸合成的二肽类物质,对酸碱稳定性相比于纽甜稍差,且温度高于80 ℃时不稳定,然而样品前处理采用超声萃取,随着萃取时间延长,水浴温度逐渐升高,进而对目标物的量化结果产生一定影响。为此,选用三乙胺缓冲溶液为样品萃取溶剂。

表2 不同溶剂对8 种甜味剂的检测效果(n=3)Table 2Effect of solvents on the results of determination of eight sweeteners (n= 3)
2.4 基质效应评估
基质效应普遍存在于HPLC-MS/MS检测中,表现为离子增强或离子抑制,从而导致定量结果有一定的偏差。为了考察本方法在去除基质效应方面的效果,按照Matuszewski等[30]报道的方法对其进行基质效应评估。按照1.3.1节所述,以不含目标物的包装材料用原纸为样品对象进行处理,制得基质匹配溶剂,再配制混合标准工作溶液。此外,用超纯水配制同样质量浓度的混合标准溶液。最后用HPLC-MS/MS分别分析以上2 种混合标准溶液。按照公式“基质效应/%=(基质标准溶液峰面积/溶剂标准溶液峰面积)×100”计算基质效应,其中,基质效应大于100%时为基质增强效应,小于100%时为基质抑制效应。不同质量浓度条件下8 种甜味剂在食品纸张样品中的基质效应见图2。可以看出,安赛蜜、糖精钠、甜蜜素、三氯蔗糖、纽甜5 种甜味剂的基质效应均在95%~105%之间,说明基质效应较弱;阿斯巴甜平均基质效应为92.34%,其中较低值为87.36%,说明存在一定的基质抑制效应,而新橙皮苷二氢查尔酮和甜菊糖苷平均基质效应分别为107.03%和105.38%,其中较高值分别为116.39%和108.75%,说明存在一定的基质增强效应。因此,采用基质匹配溶剂配制标准工作溶液消除和(或)补偿基质效应给定量带来的偏差。

图2 8 种甜味剂在纸张样品中的基质效应Fig.2 Matrix effects of eight sweeteners in paper samples
2.5 方法学验证
2.5.1 方法的线性范围、检出限及定量限
采用优化好的HPLC-MS/MS条件对系列标准工作溶液进行测定,以系列标准工作溶液峰面积为纵坐标,其质量浓度为横坐标,绘制标准工作曲线,并进行线性拟合,计算线性回归方程。采用不含目标物样品为对象添加标准溶液,经样品前处理后进样分析,经逐步稀释后以各种甜味剂信噪比(RSN)为3时的进样浓度确定为每种甜味剂的检出限,以各种甜味剂RSN为10时的进样浓度确定为定量限。如表3所示,8 种甜味剂在各自的线性范围内线性关系良好,线性相关系数(R2)均大于0.995,8 种甜味剂的检出限和定量限分别在0.13~2.50 mg/kg和0.43~8.33 mg/kg之间,可以满足各物质的定量分析要求。

表3 8 种甜味剂的回归方程、线性范围、相关系数、检出限及定量限Table 3Calibration curve equations, linear ranges, correlation coefficients, limits of detection and limits of quantification for eight sweeteners
2.5.2 方法的准确度和精密度
以巧克力包装纸样品对象,通过加标样品的回收率实验验证该方法的准确度,并以相对标准偏差(relative standard deviation,RSD)考察精密度。参照相关标准检测方法确认的回收率和精密度测试要求[31],在低、中、高3 个加标水平(LOQ、2 倍LOQ、10 倍LOQ)下进行回收率实验,每个浓度水平重复测定6 次,计算样品中各种甜味剂的回收率和RSD,结果见表4。8 种甜味剂加标回收率在85.49%~108.81%之间,RSD在2.24%~6.03%之间,表明方法具有较好的准确度和重复性,能够满足微量目标物的定量分析。

表4 不同加标样品的回收率和RSD(n=6)Table 4 Recoveries and RSDs of eight sweeteners at different spiked concentrations (n= 6)
2.6 实际样品的测定结果
采用本方法,对市售不同品牌共10 个不同规格糖果、巧克力用干性食品包装纸进行检测分析,结果(图3)显示有1 个样品中检测出含有1#安赛蜜和7#纽甜,含量分别为0.56 g/kg和0.015 g/kg。对比GB 2760—2014《食品添加剂使用标准》中有关甜味剂的使用要求,安赛蜜在不同基质食品中的最大使用量介于0.3~4.0 g/kg之间(其中糖果类为2.0 g/kg),纽甜在不同基质食品中的最大使用量介于0.01~1.0 g/kg之间(其中干性食品中都在0.02 g/kg以上),可知抽检样品结果满足标准限量使用要求。

图3 典型食品包装纸甜味剂检测总离子流色谱图Fig.3 Total ion current chromatogram of typical sweeteners in food wrappings
3 结 论
本实验以原纸为对象配制基质匹配溶剂,采用三乙胺缓冲溶液为萃取溶剂对样品进行超声提取,优化样品前处理条件及色谱条件参数,对比考察基质效应,建立基质匹配曲线校正-HPLC-MS/MS法同时测定干性食品包装纸中安赛蜜、糖精钠、甜蜜素、三氯蔗糖、阿斯巴甜、新橙皮苷二氢查尔酮、纽甜、甜菊糖苷8 种甜味剂含量的方法。实际样品测定结果表明,本方法简便快捷、灵敏度高,可满足现行法规的限量要求,适用于干性食品包装纸中8 种甜味剂的检测需求。
