基于Captiva EMR-Lipid净化的婴儿配方乳粉中氯酸盐和高氯酸盐的离子色谱-串联质谱测定
2021-07-08蒋晓宏霍宗利
张 昊,蒋晓宏,霍宗利,*
(1.江苏省疾病预防控制中心,江苏 南京 210009;2.拉萨市疾病预防控制中心,西藏 拉萨 850000)
氯酸盐和高氯酸盐是水体中常见的2 种氯化消毒副产物。高氯酸盐的离子半径和碘离子的离子半径接近,同时两者电荷价态相同,因此两者在甲状腺吸收中存在竞争关系,体内高浓度的高氯酸盐会抑制碘离子的吸收进而抑制甲状腺素的分泌,从而影响人体的正常代谢,影响身体机能[1-3]。氯酸盐在人体内可以诱发呼吸困难、高铁血红蛋白症等[4]。这两种氯氧化物具有极好的水溶性,可以通过环境水体迁移至土壤中,并被植物根部吸收在果实、茎、叶等部位富集[5-6],动物通过饮水和食用植物将氯氧化合物摄入体内在生物体内进一步富集。目前在粮食、果蔬、饮料、肉制品、乳制品等各类食品中均存在氯酸盐和高氯酸盐的检出[5-13]。通过日常的饮食生活暴露接触氯酸盐和高氯酸盐,人尿液、血液中存在一定程度的高氯酸盐的检出[14-15]。婴幼儿由于自身生长发育需要摄入碘,但存在通过配方奶粉等婴幼儿食品暴露接触高氯酸盐的可能性[10-11],有研究指出长期摄入高氯酸盐会对婴幼儿的认知能力甚至是未来的生育能力造成不利影响[16-17]。因此对于配方奶粉中的高氯酸盐和氯酸盐的检测一直是食品检验工作者的一个关注点。
目前乳制品中氯酸盐或高氯酸盐的检测方法主要集中在离子色谱[18]、离子色谱-串联质谱(ion chromatographytandem mass spectrometry,IC-MS/MS)[9,11,19-22]和液相色谱-串联质谱[6,23-29]。离子色谱法中使用电导检测器为通用性检测器,目标化物的定性只能通过目标化合物在标准品中的保留时间与在样品中的保留时间进行比对确定,但在复杂样品基质中目标物容易受到样品中其他阴离子的干扰。液相色谱-串联质谱法一般采用HILIC柱等亲水色谱柱进行分离[23-24],或测定时在流动相中添加甲酸或乙酸等调节流动相的酸度增加氯氧化物在色谱柱的保留[25-29],但是流动相中添加的酸在一定程度上会抑制在负离子模式下的氯氧化物的电离能力,降低信号响应。IC-MS/MS法分为抑制型[9,19-21]和非抑制型[11,22]两种。抑制型IC-MS/MS法在测定时需要在色谱分离后将淋洗液中氢氧根通过抑制器转变为纯水,并在离子色谱与质谱之间添加专用的插件装置才能进行测定。同时需要在离子色谱与质谱连接处加入管路引入如乙腈作为有机溶剂降低流动相的黏度,提高目标物质的离子化效率。非抑制型IC-MS/MS法主要使用有机胺溶液或在离子源中易分解的无机铵盐溶液作为洗脱液,使用离子色谱柱作为分析柱,在液相色谱-串联质谱仪上完成相应的检测工作,目前尚无非抑制型IC-MS/MS法对于婴儿配方奶粉中氯酸盐和高氯酸盐同时测定的相关报道。
婴儿配方奶粉与普通动物源性产品在样品基质上的区别在于除主要的蛋白质、碳水化合物等营养成分外,还会在原有基础上添加一定量的低聚糖、不饱和脂肪酸(亚麻酸、二十二碳六烯酸)等营养成分。这些营养成分中维生素、脂肪和不饱和脂肪酸等脂质会对检测产生干扰,目前对于婴儿配方奶粉中脂质的净化主要采取液液萃取[19,21,24,28]和固相萃取小柱净化[18,20,22,25-27,29]两种净化方式。其中液液萃取需要使用具有高挥发性、低毒的正己烷,操作更为繁琐、耗时。本实验针对去除脂质操作采用了增强基质脂质去除固相萃取小柱产品(Captiva EMR-Lipid固相萃取柱式净化产品)。这类产品与传统净化方式相比,通过空间位阻和亲水性的协同作用,对于C5及以上碳链化合物具有极强的选择性吸附,可以在去除干扰脂质的同时不吸附目标物,同时该产品无需活化和洗脱,操作简便。目前,EMR-Lipid脂质去除技术已广泛用于动物源性食品中兽药残留[30-31]和环境污染物[32-34]的检测,但是尚无采用EMR-Lipid技术对动物源性食品样品中氯酸盐和高氯酸盐等无机盐进行净化处理的报道。本实验旨在建立了一种基于IC-MS/MS,使用Captiva EMRLipid选择性脂质净化技术,测定婴儿配方奶粉中氯酸盐和高氯酸盐的方法。本方法净化操作简单快速、稳定性好,满足日常样品的测定需要。
1 材料与方法
1.1 材料与试剂
婴儿配方奶粉(6~12 月龄,2 段),购于南京某超市。
氯酸盐标准溶液(1 000 mg/L,以氯酸根计)北京海岸鸿蒙标准物质技术公司;高氯酸盐标准溶液(1 000 mg/L,以高氯酸根计) 美国o2si公司;氯酸盐-18O3同位素标准溶液(100 mg/L,以氯酸根-18O3计)、高氯酸盐-18O4同位素标准溶液(100 mg/L,以高氯酸根-18O4计) 美国剑桥(CIL)公司;40%甲胺溶液(分析纯) 美国Sigma Aldrich公司;乙腈(色谱纯)德国Meker公司;实验用水为实验室自制超纯水(电阻率≥18 MΩ·cm)。
0.7 mol/L甲胺溶液:30.6 mL 40%甲胺溶液使用纯水定容至500 mL。
1.2 仪器与设备
ACQUITY UPLC H-Class超高效液相色谱仪 美国Waters公司;QTRAP 5500质谱仪(配有电喷雾离子源(electron spray ionization,ESI)及MultiQuant2.0数据处理系统) 美国AB SCIEX公司;K2-1台式离心机美国Sigma公司;Vortex-Genie 2涡旋混合器 美国Scientific Industries公司;0.22 μm有机相针头式滤器 上海安谱公司;ENVI-18固相萃取小柱(3 mL/500 mg)、ENVI-Carb固相萃取小柱(3 mL/200 mg)、ENVI-Carb/NH2双层固相萃取小柱(6 mL/500 mg GCB+500 mg NH2) 美国Supelco公司;Captiva EMR-Lipid固相萃取小柱(3 mL/300 mg) 美国Agilent公司;Oasis PRiME HLB固相萃取小柱(3 mL/60 mg) 美国Waters公司。
1.3 方法
1.3.1 色谱条件
色谱柱:Dionex IonPac AS16柱(250 mm×2.1 mm,9 µm);柱温:25 ℃;样品室温度:5 ℃;流速:0.3 mL/min;进样量:5 µL;流动相A:0.7 mol/L甲胺溶液,B:乙腈。梯度洗脱程序:0~4 min,30% A、70% B;4~5 min,30%~1% A、70%~99% B;5~6 min,1% A、99% B;6~7 min,1%~30% A、99%~70% B;7~10 min,30% A、70% B。
1.3.2 质谱条件
离子源:ESI-;喷雾电压:4.5 kV;多反应监测模式进行采集,离子源温度:550 ℃;气帘气压:40 psi;Gas 1:60 psi;Gas 2:60 psi。氯酸盐和高氯酸盐及其同位素内标的相关质谱参数见表1。

表1 氯酸盐和高氯酸盐及其同位素内标质谱参数Table 1Mass spectrometric parameters for chlorate, perchlorate and their isotope-labelled internal standards
1.3.3 样品前处理
称取1 g(精确到0.01 g)婴儿配方奶粉于50 mL离心管,加入160 μL同位素内标使用液,加入7 mL纯水涡旋3 min混匀,超声提取10 min,加入9 mL乙腈混匀,静置5 min沉淀蛋白,8 000 r/min离心5 min,移取3 mL上层清液分批转移至Captiva EMR-Lipid小柱中,弃去前1 mL流出液,收集随后流出液,滤液使用0.22 μm有机针式滤器过滤后上机测定。
1.3.4 标准溶液及内标溶液的配制
混合标准使用液:移取适量氯酸盐标准溶液和高氯酸盐标准溶液,使用纯水配制成氯酸盐质量浓度为4 μg/mL和高氯酸盐质量浓度为1 μg/mL的混合标准使用溶液。
同位素内标使用液配制:移取适量氯酸盐-18O3同位素标准溶液和高氯酸盐-18O4同位素标准溶液,使用纯水配制成氯酸盐-18O3和高氯酸盐-18O4质量浓度为1 μg/mL的混合标准使用溶液。
标准曲线溶液配制:使用空白提取液水-乙腈(7∶9,V/V)稀释混合标准使用液和同位素内标使用液配制成标准溶液序列:5、10、50、100、200 μg/L(以氯酸根计),同位素内标质量浓度为10 μg/L。
1.3.5 氯酸盐和高氯酸盐含量计算
通过标准溶液序列上机测定绘制标准曲线,将1.3.3节获得样品溶液上机测定,以标准混合溶液中氯酸盐和高氯酸盐色谱峰的保留时间定性,通过标准曲线计算得出样品溶液中氯酸盐和高氯酸盐的质量浓度,使用同位素内标校正定量。样品中氯酸盐/高氯酸盐含量(均以其酸根计算)按式(1)计算:

式中:C为样品中氯酸盐/高氯酸盐含量/(μg/kg);c为标准曲线中计算上样溶液中氯酸盐/高氯酸盐的质量浓度/(μg/L);c0为标准曲线中计算出空白实验中氯酸盐/高氯酸盐的质量浓度/(μg/L);16为定容体积(mL);m为样品质量/g。
1.3.6 空白实验
除不称取样品外其他操作均按照样品前处理中步骤进行实验后测定,结果作为空白实验结果。
2 结果与分析
2.1 色谱条件的优化
参考美国EPA Method 331.0中水中痕量高氯酸盐的测定方法[35],本实验使用离子色谱柱作为分析柱。同时考虑到奶粉样品中有机物的组成和含量都远高于自来水,存在有机物残留于色谱柱上、污染色谱柱的风险,于是选用甲胺溶液与有机溶液的两相洗脱,同时使用梯度洗脱,使用高比例的有机相在目标物分离后将可能残留的有机物洗脱下来,延长色谱柱的使用寿命。使用离子色谱柱能够耐受的甲醇和乙腈作为有机相,从色谱柱压力、目标物色谱峰峰形等方面考察两种有机相的优劣。结果显示,0.3 mL/min流速时,甲醇和乙腈分别作为有机相溶剂时,两个目标物的峰形良好。但使用甲醇时色谱柱分离是系统背景压力较高(约1 700 psi),使用乙腈时系统背景压力为较低(约1 400 psi),离子色谱柱的推荐操作背景压力低于1 500 psi,因此选择系统背景压力较低的乙腈作为有机相溶剂。

随后比较氯酸盐和高氯酸盐在3 种离子色谱柱AS11(250 mm×2.1 mm,13 µm)、AS16(250 mm×2.1 mm,9 µm)、AS19(250 mm×2.1 mm,7.5 µm)上的色谱行为,流动相0.7 mol/L甲胺-乙腈(3∶7,V/V),流速0.3 mL/min,3 种色谱柱的填料粒径不同(AS11为13 µm,AS16为9 µm,AS19为7.5 µm),色谱填料的比表面积随着粒径的减小而增大,填料的吸附能力逐渐增大,在洗脱液洗脱能力相同的情况下导致目标物在这3 种色谱柱上的保留时间逐渐变长,色谱峰变宽。综合考虑后使用AS16作为本实验的分析柱。氯酸盐和高氯酸盐及其对应同位素内标在标准溶液中的提取离子流图见图1。

图1 氯酸盐和高氯酸盐及其同位素内标在标准溶液中的提取离子流图Fig.1 Extracted ion chromatograms of chlorate, perchlorate and their isotopic internal standards in standard solution
2.2 前处理方法的优化
2.2.1 溶解样品纯水用量的选择
目前市售的婴儿配方奶粉由于品牌、原料奶奶源、段位的不同,配方中碳水化合物、蛋白质、矿物质等营养元素均存在差异,因此不同品牌、不同段位的配方奶粉在冲调时推荐的用水量也不同,统计后得出目前常见的品牌婴儿配方奶粉推荐1 g奶粉冲调时水的用量为5~7 mL。考虑到适用性,选择最高用水量7 mL作为溶解奶粉样品的纯水用量。
2.2.2 沉淀剂的选择
婴儿配方奶粉中主要的营养成分是蛋白质、糖、脂肪等,其中蛋白质需要沉淀后才能进行进一步的净化操作。因此考察溶解在7 mL水中的1 g样品使用不同蛋白质沉淀溶剂(乙腈、甲醇、丙酮)达到完全蛋白质沉淀的最少用量,以及不同沉淀剂对模拟加标样品(加标量:氯酸盐400 μg/kg、高氯酸盐100 μg/kg)的提取率的影响。表2显示,3 种沉淀剂在提取率均高于80%,但是乙腈的使用量较少,说明样品被溶剂稀释的倍数较少,方法会具有较低的检出限和定量限,因此选择乙腈作为沉淀剂进行进一步优化。

表2 不同沉淀剂对提取率的影响以及沉淀剂最小用量Table 2Effect of different precipitants on extraction efficiency and minimum amount of precipitants added
2.2.3 水和沉淀剂使用量的优化
比较沉淀蛋白时乙腈加入量对模拟加标样品(加标量:氯酸盐400 μg/kg、高氯酸盐100 μg/kg)提取率的影响,结果显示沉淀剂用量为9 mL时两个化合物的提取率最高,因此选择9 mL作为沉淀剂的使用量,具体结果见表3。

表3 沉淀剂用量对于提取率的影响Table 3Effect of precipitant dosage on extraction efficiency
2.2.4 固相萃取小柱的选择
考虑到沉淀蛋白后的提取液中有机物例如糖和维生素在不同类型的固相萃取小柱中的柱填料的保留存在不同,使用SPE小柱净化后的残留基质对两种氯氧化物产生不同的基质效应,以及不同类型柱填料对目标化物的保留程度不同,均会对方法回收率等产生影响。因此考察常见5 种固相萃取柱(PRiME HLB小柱、ENVI-18小柱、GCB小柱、GCB/NH2复合小柱、Capativa EMR-Lipid小柱)对模拟加标样(加标量:氯酸盐400 μg/kg、高氯酸盐100 μg/kg)提取率以及提取基质溶液对目标化合物产生的基质效应。由于无法获得阴性的配方奶粉样品,因此需要计算基质效应,当基质效应值低于80%或高于120%时,表示基质产生严重不可忽视的基质抑制或基质增强。基质效应按下式计算:

式中:ME为基质效应;Ai为样品基质中添加一定量的标准溶液后目标化合物的色谱峰信号峰面积;Ab为样品基质中未添加标准溶液前的目标化合物的色谱峰信号峰面积;As为在空白提取液(水-乙腈(7∶9,V/V))添加一定量的标准溶液后目标化合物的色谱峰信号峰面积。
表4显示,除使用EMR-Lipid小柱净化外的基质溶液对高氯酸盐均产生了不可无视的基质效应,同时使用GCB小柱净化时高氯酸盐的提取率大于120%,值得注意的是,使用GCB/NH2复合小柱和EMR-Lipid小柱净化时样品基质对于氯酸盐产生了一定基质抑制。推测出现该情况的原因,EMR-Lipid填料的空间结构对脂质存在选择性去除,能够有效去除样品基质中的不饱和脂肪酸等脂质,从而有效降低了这类脂质对高氯酸盐的基质抑制,而PRiME HLB小柱和ENVI-18小柱的柱填料也具有一定的去除脂质效果,但去除效果有限,因此只是降低了部分基质抑制,而GCB小柱和GCB/NH2小柱的柱填料对脂质去除的效果较差因此产生了严重的基质抑制;而样品基质中除脂质外还有其他有机物,例如低聚糖等,这类化合物无法被EMR-Lipid吸附去除,因此产生了一部分的基质抑制。因此选择了其余4 种小柱中基质效应和提取率均相对较好(回收率>80%,基质效应>70%)的ENVI-18小柱与EMR-Lipid小柱协同净化,但是该协同净化手段对氯酸盐回收率和基质抑制改善效果不明显,考虑到使用两种小柱净化会增加净化操作的复杂性和实验成本,因此单独使用EMR-Lipid小柱作为本实验的样品净化手段。

表4 不同固相萃取小柱对模拟加标样品的加标回收率和基质效应Table 4Recoveries and matrix effect of spiked samples by using different SPE columns
2.3 方法学考察结果
2.3.1 线性方程和检出限
按照优化好的条件将标准溶液曲线上机测定,以被测组分离子峰面积与同位素内标离子峰面积之比为纵坐标,标准曲线中被测组分质量浓度为横坐标,作标准曲线。所得标准曲线的线性方程回归系数均大于0.999。同时根据氯酸盐和高氯酸盐的信噪比为3确定仪器检出限为0.3 μg/L和0.1 μg/L,计算得出方法检出限分别为4.8 μg/kg和1.6 μg/kg,定量限(RSN=10)分别为16 μg/kg和5.0 μg/kg,结果见表5。
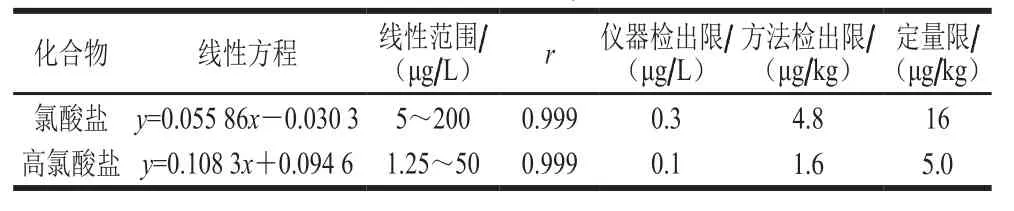
表5 线性方程、线性范围、仪器检出限Table 5Linear equations, linear ranges, and instrumental detection limits for analytes
2.3.2 回收率和相对标准偏差
分别对奶粉进行3 个加标水平的加标实验,表6显示,氯酸盐和高氯酸盐在阳性样品中3 个不同加标水平下的加标回收率分别为98.8%~101%和97.2%~112%,相对标准偏差分别为1.1%~2.6%和1.3%~6.8%,说明方法能够满足实际样品的检测需要。

表6 模拟加标样品的加标回收率和相对标准偏差(n=6)Table 6Recoveries and RSD of simulated spiked samples (n= 6)
2.4 实际样品测定结果
使用本方法对12 份购买于网店或超市的奶粉进行检测,结果显示12 份样品均为氯酸盐和高氯酸盐阳性样本,样品中氯酸盐含量为17.4~203.9 μg/kg,高氯酸盐含量为5.1~14.8 μg/kg。
3 结 论
本实验使用Captiva EMR-Lipid小柱与C18小柱协同净化,IC-MS/MS分离检测,建立了婴儿配方奶粉中的氯酸盐和高氯酸盐的同时测定的方法。与传统液液萃取除脂相比,Captiva EMR-Lipid小柱净化操作简单、无需活化,脂质去除选择性高,能够有效降低奶粉样品基质对于高氯酸盐的机制抑制。方法便捷、准确、可靠,适于婴儿配方奶粉中氯酸盐和高氯酸盐的检测。
