复方鳖甲软肝片治疗肝纤维化的机制研究
2021-07-06邱玲玲陈雯支星肖莹
邱玲玲 陈雯 支星 肖莹
九江职业大学护理学院,江西 332000
肝纤维化是肝脏遭到各种致病原侵袭,引起肝脏损害与炎性反应后,导致肝脏结构和肝功能异常改变的病理过程。在慢性肝病-肝纤维化-肝硬化的病情演变过程中,肝纤维化是关键的中间环节。如何有效地阻断肝纤维化的发生发展,积极治疗和逆转肝纤维化,受到国内外学者的高度重视,对防治肝硬化肝癌具有重要意义[1-3]。复方鳖甲软肝片(Fufang Biejia Ruangan tablet,FFBJ)是原中国人民解放军302医院在30多年临床治疗经验的基础上研制而成的,它是国内第一个以治疗肝纤维化和早期肝硬化为主的国家级中药新药,是《肝纤维化中西医结合诊疗指南》[4]推荐的用于抗纤维化及早期肝硬化的药物。现已广泛用于肝纤维化及多种脏器纤维化疾病的治疗。该复方由鳖甲、莪术、三七、黄芪、赤芍、冬虫夏草等11味中药精制而成,组方复杂、成分繁多,但目前对FFBJ抗肝纤维化作用物质基础及作用机制尚未完全阐明。
网络药理学是基于计算机虚拟计算、高通量组学数据分析,利用生物信息学方法,研究多成分-多靶点-多疾病的机制,在方法学上具有整体性、系统性的特点,现广泛应用于中药复方及单味药的研究[5]。随着网络药理学的完善与发展,中医药发挥临床疗效的分子及机制研究也逐渐变得可视化、效率化和标准化,其理论的建立为多靶点药物的研究提供科学理论支持,也为研发新药提供理论源泉[6]。本研究基于网络药理学的方法和技术,从系统生物整体的角度探讨FFBJ的抗肝纤维化的作用机理,构建成分-靶点网络,为深入探讨FFBJ抗肝纤维化的作用机制提供科学依据。
1 材料与方法
1.1 活性成分的筛选口服生物利用度(OB)和类药性(DL)是药物筛选、评价化合物成药性的重要的动力学参数。因此,通过中药系统药理学技术平台(TCMSP)和文献检索收集复方鳖甲软肝片11味药的所有化合物,并根据其ADME性质进行筛选,以OB≥30%和DL≥0.18为筛选标准,筛选出活性成分。
1.2 潜在作用靶点的预测反向药效团匹配方法(PharmMapper)是通过对Targetbank、Drugbank、Binding DB和PDTD 4大数据库进行快速检索而获得药物靶点信息。该服务器内含7 000多个药效团模型,涵盖110种临床适应证,具有运算速度快、靶点信息全面等优点。本研究挖掘TCMSP数据库中FFBJ活性成分的潜在靶点,并登陆PharmMapper服务器 (http://www.lilab-ecust.cn/pharmmapper/),上传FFBJ的活性成分sdf格式文件,采用“反向药效团匹配方法”得到虚拟筛选结果,将两部分数据进行整合。同时使用蛋白质数据库(UniProt)中UniProtKB搜索功能(https://www.uniprot.org/),通过输入靶点名称并限定物种为人,将检索得到的靶点校正为其官方名称,经上述数据库检索和转化,获取与活性成分相关的靶点信息。
1.3 肝纤维化疾病相关靶点获取登录Drugbank数据库(https://www.drugbank.ca)和OMIM数据库(https://omim.org),以“Hepatic fibrosis”为关键词检索与肝纤维化相关的靶点基因,作为肝纤维化的靶基因。
1.4 活性成分-靶点网络构建与分析将获得的FFBJ活性成分相关靶点与肝纤维化靶点基因相映射,使用Venn作图分析,获得二者交集靶点基因,然后使用Cytoscape 3.7.0软件构建中药-活性成分-靶点网络图,并根据化合物与靶点连接情况进行拓扑分析,预测FFBJ抗肝纤维化的关键活性成分和关键靶点。
1.5 关键靶点的基因本体(GO)和基因组百科全书(KEGG)富集分析 GO分析主要用于注释基因的功能,包括细胞功能、分子功能和生物功能,已被广泛应用于生物基因功能分类[12]。使用clusterprofiler对FFBJ治疗肝纤维化的靶基因进行GO富集分析和KEGG通路富集分析,以研究其主要生物学过程和代谢通路,以统计学超几何分布定量(P值)筛选P<0.05的生物过程及信号通路,用半编程性质的脚本软件Rproject绘图将其可视化。
2 结 果
2.1 FFBJ活性成分的筛选 通过TCMSP数据库筛选出FFBJ中的活性成分,得到符合条件的成分43个。另外,Ginsenoside Rb1、Ginsenoside Rg1、Notoginsenoside R1、Ginsenoside Re、Adenosine虽然其OB值相对较低,但有文献报道这5种化合物为FFBJ中的活性成分且含量较高[5],因此共筛选出48个活性成分,见表1。

表1 FFBJ的主要活性成分
2.2 FFBJ中主要活性成分的潜在作用靶点信息 将PharmMapper返回的各个活性成分的潜在作用靶点根据匹配度fit score由高到低进行排序,每个成分取前30个靶点。并与TCMSP数据库中整理出所有活性成分的潜在靶点进行对比分析,再将所获得的活性成分预测靶点导入Uniprot数据库进行基因标准化,去除重复值,归纳总结筛选出931个潜在靶点。
2.3 肝纤维化疾病相关靶点获取 使用Drugbank、OMIM数据库收集到肝纤维化潜在靶点,合并去重复后共得到1 117个肝纤维化的相关靶点。
2.4 活性成分-靶点网络构建与分析 将931个FFBJ化合物作用靶点与1 117个肝纤维化靶点基因进行Venn分析,获得药物-疾病交集基因70个,从而得到FFBJ治疗肝纤维化的相关作用靶标,将其定义为“关键靶点”,对应FFBJ的44个活性成分(Frutinone A、Peroxyergosterol、Ginsenoside Rg1、Perlolyrine 4个成分未找到交集靶点参与相互作用)。
将FFBJ的活性成分、关键靶点导入Cytoscape软件,构建“活性成分-靶点”网络图,见图1。在网络图中,绿色六边形代表活性成分所作用的靶点,紫色长方形代表FFBJ所含有的活性成分。分析网络图,可知网络图中共包含节点(node)114个,节点与节点之间的作用关系,即边(edge)384条,展示了FFBJ治疗肝纤维化多成分、多靶点的作用。借助Cytoscape对活性成分-靶点网络进行拓扑分析,得到自由度、介数、中心度均大于平均值的成分的交集,筛选出可能是FFBJ治疗肝纤维化的关键活性成分18 个 ,即 Calycosin、Formononetin、Ginsenoside Re、alexandrin_qt、ginsenoside Rg5_qt、bisdemethoxycurcumin、Mandenol、DFV、Spinasterol、CLR、adhyperforin、7-Methoxy-2-methyl isoflavone、Mairin、ZINC03860434、quindoline、24-Ethylcholest-4-en-3-one、hyperforin、poriferast-5-en-3beta-ol。同法筛选出可能是FFBJ治疗肝纤维化的关键靶点20个,即ADK、RXRA、CASP3、MMP2、CYP2C9、MAP2K1、NR3C1、FECH、NR1H4、VDR、RBP4、GC、TGFB2、NR1I2、PPARA、GRB2、IL2、SHBG、SULT2A1、NR3C2。
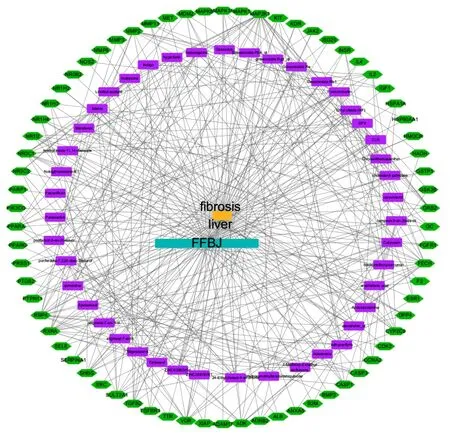
图1 FFBJ活性成分-靶点网络图
2.5 FFBJ治疗肝纤维化作用靶点的GO功能分析与KEGG富集分析 70个药物活性成分-疾病交集基因影响了92个生物学过程(P<0.05),选取排名前20的功能信息绘制柱状图,如图2。结果显示,FFBJ所涉及的生物信息学功能与过程包括类固醇激素受体活性、核受体活性、转录因子活性、激素受体粘合物、肽内切酶活性、细胞因子受体粘合物、类固醇粘合物、蛋白质酪氨酸激酶活性、细胞核激素受体粘合物、羧酸粘合物、有机酸粘合物、转录共激活剂活性、丝氨酸、苏氨酸激酶活性等生物过程。
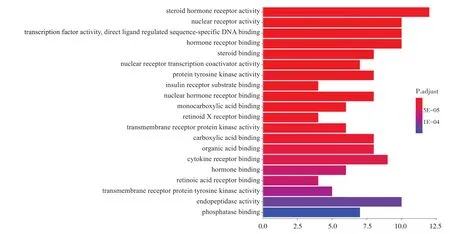
图2 GO功能富集分析柱状图
KEGG富集分析发现FFBJ治疗肝纤维化70个关键靶点显著富集(P<0.05)在128条通路上,其中包括PI3K-Akt、癌症蛋白聚糖、丝氨酸蛋白激酶(MAPK)、乙型肝炎、前列腺癌、IL-17、内分泌抵抗、松弛激素、FoxO、肾素、弓形虫病通路、卡波西肉瘤联合疱疹病毒感染、TGF-β1、PPAR与Janus激酶/信号转导与转录激活因子(JAK/STAR)等多条信号通路。图3展示了前20位KEGG通路富集分析结果,其中参与PI3K-Akt信号通路的关键靶点数量最多,共18个,包括MAP2K1、FGFR1、GRB2、JAK2、IL2、MAPK1、PIK3CG、IGF1等,且靶点MAP2K1、MAPK1、MAPK8、GRB2、MAPK14在前20的信号通路里涉及10个以上的信号通路;靶点CASP3、TGFB2、MDM2、SRC、IGF1、MMP9、MAP2K1、FGFR1、JAK2、HSP90AA1、GSK3B、SRC、MMP2、MET、CDK在前20的信号通路里涉及5个以上的信号通路。
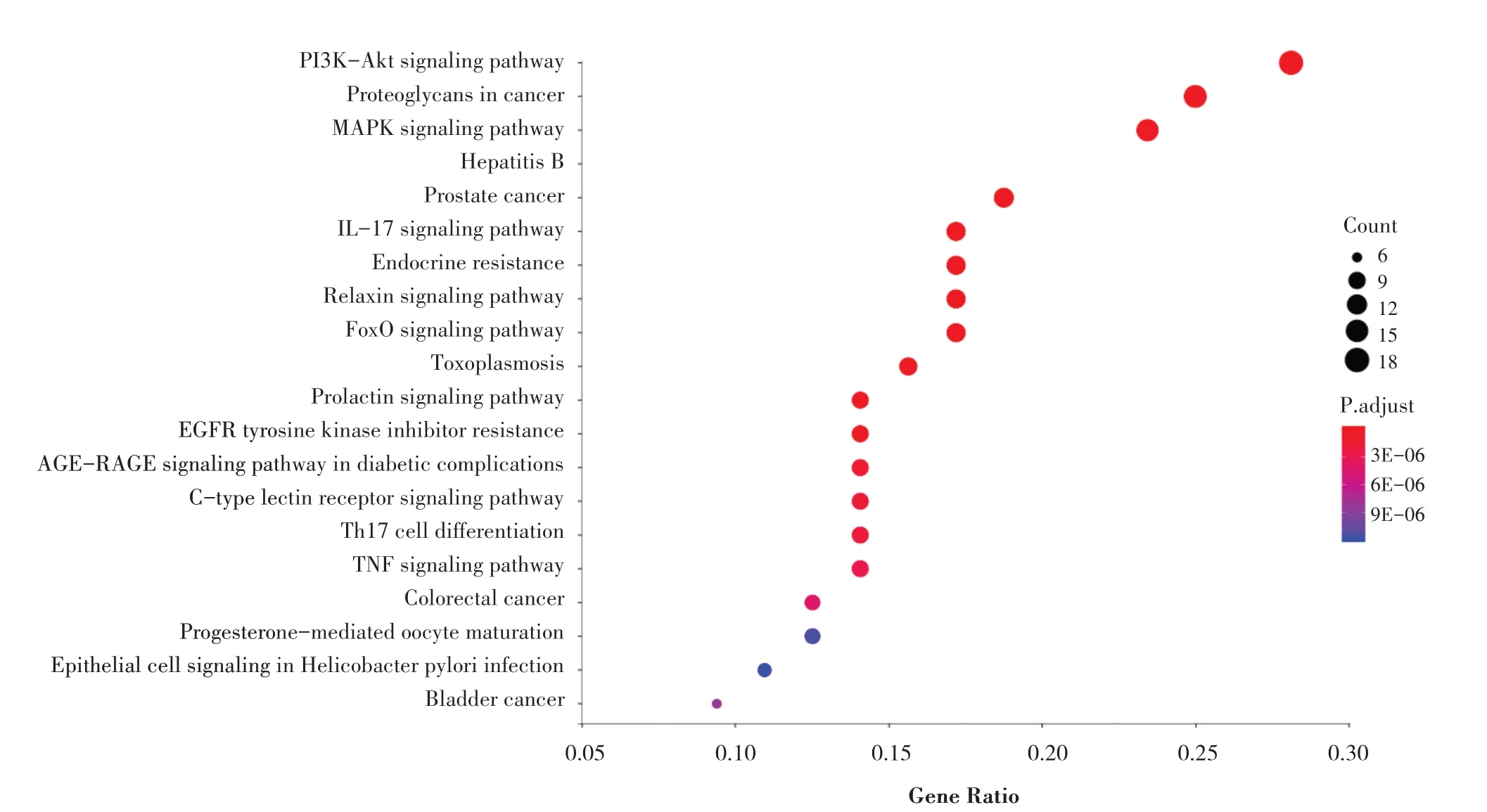
图3 FFBJ治疗肝纤维化关键靶点参与的通路富集信息气泡图
3 讨 论
复方鳖甲软肝片由鳖甲、赤芍、冬虫夏草、三七、紫河车、黄芪、当归、连翘、莪术、党参、板蓝根11味中药组成,是首个用于肝纤维化治疗的中药制剂,其临床疗效显著。因
此,本研究基于网络药理学的方法,借助数据库和软件对FFBJ抗肝纤维化的作用机制进行探讨具有重要意义。
采用Cytoscape 3.7.0软件构建活性成分-靶点网络并进行拓扑分析,共预测到FFBJ治疗肝纤维化的18个活性成分和20个关键靶点。通过Rproject对靶点基因进行GO富集分析和KEGG代谢通路分析,得到GO中92个生物过程条目和128条KEGG通路。图1表明,FFBJ抗肝纤维化的活性成分和靶基因之间是一个复杂的网络,交互作用显著,可见FFBJ治疗肝纤维化具有多成分、多靶点的特点。李艳等[7]表明黄芪的主要成分为黄酮类,可通过抗脂质过氧化,减少肝细胞变性、坏死,产生抗肝纤维化作用。本研究得到的活性成分中的毛蕊异黄酮、芒柄花素度值较高(依次为10、18),均属于黄芪黄酮类成分,这就从理论上印证上述研究结果。Yuan等[8]发现人参皂苷、三七皂苷可通过Notch、TGF-β1/Smad3等信号通路显著抑制肝成纤维细胞发挥抗肝纤维化作用,而本研究也预测出了抗肝纤维化的皂苷类成分如人参皂苷Re、人参皂苷Rg5。此外笔者还发现FFBJ中未见报道的Mandenol、bisdemethoxycurcumin、adhyperforin、Mairin、Spinasterol、7-Methoxy-2-methyl isoflavone、CLR、ZINC03860434、quindoline、hyperforin 24-Ethylcholest-4-en-3-one度值较大(大于9),连接靶点多、类药性也较高,提示这些化合物也可能是FFBJ潜在的抗肝纤维化活性成分,有必要进行后续试验验证。
Venn分析得到FFBJ作用靶点与肝纤维化靶点的交集基因共70个,经拓扑分析得到20个关键靶点,其中MAP2K1、NR3C1、FECH、RXRA、RBP4、TGFB2、PPARA(大于8)等靶基因度值较大,可能是FFBJ治疗肝纤维化的重要靶点。进一步提炼FFBJ治疗肝纤维化的生物学过程,发现其涉及类固醇激素受体活性、转录因子活性、细胞因子受体黏合物、蛋白质酪氨酸激酶活性、丝氨酸/苏氨酸激酶活性等生物过程,这与肝纤维化疾病的发展有一定关联性。另外,通过对70个交集基因进行KEGG信号通路富集分析,发现128条信号通路与肝纤维化的发病显著相关(均P<0.05),包括PI3K-Akt、癌症蛋白多糖、MAPK、乙型肝炎、IL-17、TGF-β1、PPAR、JAK/STAT等信号通路。而拓扑分析得到的关键靶点在上述信号通路中多次富集,如靶点RXRA、CASP3、MMP2、MAP2K1、TGFB2、GRB2、IL2。肝纤维化主要病理特征为细胞外基质(extracellular matrix,ECM)分泌增加以及降解减少,引起ECM大量沉积,而肝星状细胞(hepatic stellate cell,HSC)是分泌ECM的主要效应细胞,在肝纤维化过程中起着关键作用。肝纤维化是多种细胞因子和多条信号通路共同参与、交互作用的复杂过程,从而实现逆转肝纤维化的可能。卢玮等[9]综述肝纤维化相关重要的 主要信号通路,如MAPK、PI3K/Akt、IL-17、TGF-β1、PPAR、JAK/TAT等信号通路。这与本研究中FFBJ肝维化靶点的KEGG代谢通路富集结果几乎一致,表明FFBJ具有多靶点、多通路抗肝纤维化的潜能。
TGF-β1/Smads信号通路是TGF-β1促纤维化作用中最经典的途径,通过作用于HSC表面的TGF-β1受体进而引发促纤维化效应,在HSC的活化与增殖、ECM的沉积和肝纤维化的发展过程中具有重要意义。本研究中GO富集分析的生物学过程也涉及TGF-β1转录因子活性和关键靶点TGFB2。研究表明FFBJ药物血清能显著抑制HSC分泌TGF-β1,抑制肝Kupffer细胞活化,起到抗肝纤维化的作用[10]。且试验证实黄芪总黄酮、黄芪多糖、黄芪甲苷、莪术油、赤芍总苷(芍药苷)、人参皂苷、阿魏酸钠均可通过抑TGF-β1/Smad信号通路的激活,下调TGF-β1、Smad2等蛋白使得HSCs的活化受到抑制[11-12]。此外,FFBJ中动物药成分如虫草多糖、鳖甲水煎液均有报道通过调节TGF-β1下游信号通路,减少ECM的合成,达到治疗肝纤维化的效果[13]。
MAPK能够通过HSC活化、增殖、凋亡等过程参与肝纤维化的形成与逆转,包括细胞外信号调节蛋白激酶(ERK)、p38 MAPK和c-Junnh2末端激酶(JNK)3大类,是介导信号转导的高度保守调节因子。Li等[14]报道黄芪甲苷Ⅳ通过抑制氧化应激的产生和相关的p38MAPK活化来抑制HSC活化,Boye等[15]认为黄芪甲苷可通过调节TGF-β1/Smad途径改善肝纤维化和肝细胞癌。
JAK/STAT信号通路是近年来发现的一条重要的细胞内信号转导通路,该通路参与多种细胞的炎性反应并调节细胞的增殖、分化、凋亡,是众多细胞因子信号转导的共同途径。动物实验显示三七总皂苷能够降低肝纤维化大鼠血清中AST、ALT的表达,下调肝组织中α-SMA、TGF-β1的水平,其作用机制可能是通过JAK/STAT信号通路诱导HSCs凋亡,产生抗纤维化作用[16]。
PPAR-γ信号通路是抗肝纤维化的重要信号通路,可维持HSC处于静止状态,一旦PPAR-γ基因被抑制,PPAR-γ的表达减少,HSC转变为激活状态。此外,还有研究表明,PPAR-γ激动剂可以抑制TGF-β1所诱导的ECM表达上调,发挥其抗纤维化作用。成扬和汪美凤[17]证实黄芪提取物可通过PPAR-γ和RXR信号通路产生抗大鼠肝纤维化的作用。孙利兵[18]发现含有槲皮素和毛蕊异黄酮的沙苑子黄酮(FAC)能抑制β-catenin的表达而导致Wnt信号通路下游靶细胞PPAR-γ表达增加,进而抑制HSC的增殖。
特异性阻断PI3K/Akt信号通路能够抑制HSC的增殖、迁移,促进HSC的凋亡。在本研究中,PI3K-Akt信号通路上富集的核心靶点数最多,达18个,包括RXRA、MAPK1PIK3CG、IGF1、IL-4、JAK2、KDR等。本研究还发现了IL-17通路(富集靶点数11个),Meng等[19]在大量动物实验研究中发现,IL-17通过激活KCs和HSCs中的NF-κB/STAT3发挥促炎和促纤维化作用。NF-κB是不同炎症因子发挥促炎反应导致纤维化的共同信号通路。杨莹[20]研究发现,鳖甲寡肽I-C-f-6能够上调炎性抑制因子IL-4、IL-10的表达,抑制肿瘤坏死因子的合成,下调核转录因子Kappa B(NF-κB)的表达,提高机体的抗炎能力。Zhang等[21]发现木犀草素通过调控Nrf2/NF-κB/P53通路减轻氯化汞诱导的肝损伤。邵丹阳证实[22]芍药苷能降低肝纤维化基本指标α-SMA、Collagen-I的表达,有效地抑制促炎因子的释放,可能通过调控LXRs-STAT3信号通路改善肝纤维化的发展进程。Hou等[23]研究显示,人参皂苷Rb1可通过抑制NF-κB信号通路来完成对炎性反应的应答,促进HSC凋亡。罗飘等[24]研究表明Rg1通过调节NF-κB/VCAM-1信号途径抑制炎症损伤,减轻胆汁淤积性肝纤维化。此外,癌症蛋白多糖在本研究中富集靶点数也较多(16个靶点),蛋白多糖是一类能连接蛋白骨架的多糖分子,如透明质酸酶(HA)、硫酸软骨素等。HSC活化状态下,合成分泌出大量HA,并加剧前胶蛋白合成,而HA可促进胶原白分子的聚集,使肝脏基底骨架不断纤维化,而促进肝纤维化。
综上所述,FFBJ抗肝纤维化的过程涉及多条通路、多个靶点以及多个生物过程,其中本研究预测的MAPK、TGF-β1、PPAR、JAK/STAT信号通路均在理论上得到了验证,且报道的作用于这些通路的成分可能同样存在于FFBJ中。而预测的通路PI3K/Akt、IL-17、癌症蛋白多糖信号通路也有研究证实是抗肝纤维化的作用通路,但涉及的成分与FFBJ相关尚未得到证实;成分木犀草素、人参皂苷Rb1、Rg1、芍药苷、鳖甲寡肽证实可通过NF-κB通路发挥抗肝纤维化作用,但该通路在本研究中未被预测到;这些均为未来实验验证FFBJ抗纤维化关键靶蛋白及作用机制提供了思路与线索。
